
Staraya_papka / Боровская модель атома водорода (mine)
.docСтепаненко Григорий
3 курс 2 группа
Лабораторная работа:
«Экспериментальное изучение структуры серии Бальмера водорода»
Цель работы:
Уяснить природу серии Бальмера. Наблюдать визуально серию Бальмера с помощью монохроматора УМ-2. Проградуировать монохроматор УМ-2. Определить длины волн серии, их частоты и энергии. Экспериментально получить значение постоянной Ридберга R.
КРАТКАЯ ТЕОРИЯ
При рассматривании видимой части спектра атомов водорода в спектроскоп с невысокими разрешающей силой и обратной дисперсией, каким является монохроматор УМ-2 наблюдается совокупность отдельных узких линий разных цветов, называемая серией Бальмера. Частоты этих линий с точностью, определяемой возможностями указанного спектрального прибора, поддаются систематизации формулой Ридберга, найденной первоначально эмпирически Ридбергом в 1890 г.
![]() (1)
(1)
Здесь n=2, а m>2 -числа натурального ряда соответствуют видимой области, т.е. серии Бальмера. Формула (1) может быть получена уже в рамках теории атома Бора. Однако строго последовательно эта формула получается лишь после решения уравнения Шредингера для атома водорода.
Из формулы (1) следует, что
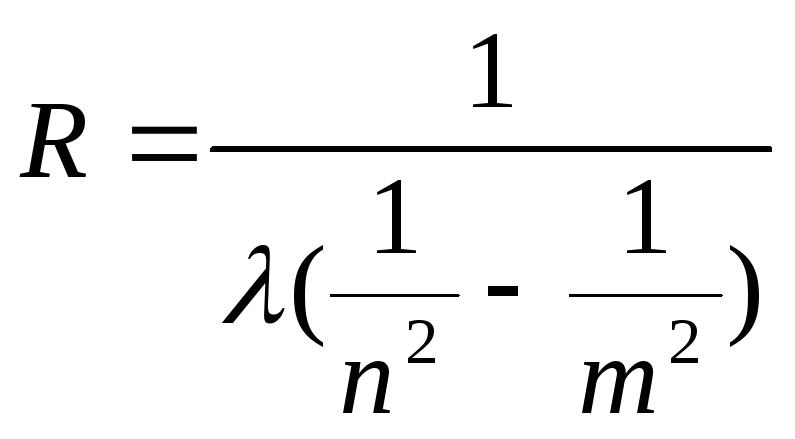 .
.
Тонкая структура линий спектра водорода может быть интерпретирована только на основе квантово-механических представлений, решение уравнения Шредингера дан уровней энергия водородоподобного атома имеет вид
![]() ,
(2)
,
(2)
где Z – заряд ядра атома, n – главное квантовое число. Формула (2) дана в атомной системе единиц для энергии, то есть в Ридбергах.
Уровень - это совокупность состояний с одним и тем же полным внутренним моментом импульса j.
Энергии уровней равны (в ед. Ry):
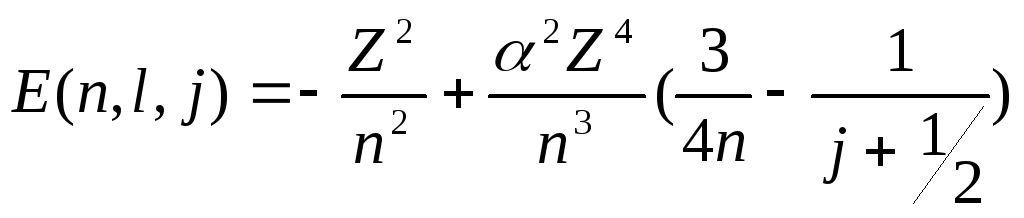 (3)
(3)
То есть
![]() ,
где
,
где
![]() -
Боровский радиус.
-
Боровский радиус.
Уровнем энергии называется одно из дискретных значений энергии, которое может иметь система. Энергия излучается или поглощается системой при переходах ее с одного уровня энергии на другое энергетический уровень.
При этом конечно должны меняться и уровни состояний!
Каждая линия серии Бальмера состоит из пяти компонентов, объединениях в две группы. Наибольшее расстояние между компонентами в группах, как это следует из формулы (3), нужно ожидать у головной линии серии Бальмера.
ОПИСАНИЕ РАБОЧЕЙ УСТАНОВКИ

Рис.1 Устройство монохроматора УМ-2
1 – входная щель
2 – коллиматорный объектив
3 – спектральная призма
4 – объектив
5 – окуляр
6 – поворотный столик
7 – отсчетный барабан
8 – микрометрический винт
9 – микрометрический винт
10 – указатель
11 – массивный корпус
Сложная спектральная призма состоит из трех склеенных призм Р1, Р2 и Р3. Первые две призмы Р1 и Р2 с преломляющими углами 30о изготовлены из тяжелого флинта, обладающего большой дисперсией. Промежуточная призма Р3 сделана из крона. Лучи отражаются от её гипотенузной грани и поворачиваются на 90о, благодаря такому устройству дисперсии призм Р1 и Р2 складываются.
В случае необходимости окуляр может быть заменен выходной щелью, пропускающей одну из линий спектра. В этом случае прибор служит монохроматором.
ОБРАБОТКА ПРОВЕДЕННЫХ ИЗМЕРЕНИЙ
-
Градуировка монохроматора по спектру ртути
|
Цвет |
Длина волны |
Деления барабана |
|
красная |
6234,37 |
2778 |
|
желтая |
5790,65 |
2584 |
|
желтая |
5769,59 |
2562 |
|
зеленая |
5460,74 |
2392 |
|
зелено-голубая |
4916,04 |
1958 |
|
синяя |
4358,35 |
1308 |
|
фиолетовая |
4077,81 |
818 |
|
фиолетовая |
4046,55 |
758 |
Таблица 1 Спектр ртути
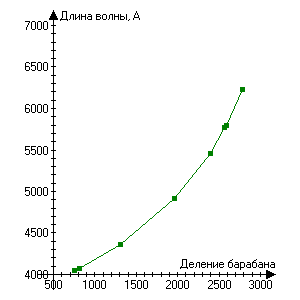
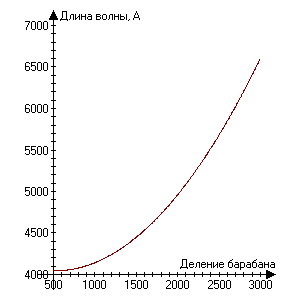
Рис.2 По табличным данным Рис.3 Регрессивный анализ
-
Определение длин волн серии Бальмера атома водорода

Рис.4 Градуировочный график
-
Расчет параметров серии Бальмера атома водорода
|
Цвет |
Деления барабана |
Интенсивность отн. единицы |
Длина волны, А |
Постоянная Ридберга, см-1 |
Энергия, эВ |
|
красная |
2892 |
3000 |
6390 |
1,126*105 |
Е3 = -1,55 (-1,51) Е32 = 1,94 (1,89) |
|
зелено-голубая |
1906 |
500 |
4848 |
1,098*105 |
Е4 = -0,85 (-0,85) Е42 = 2,55 (2,55) |
|
фиолетовая |
1370 |
200 |
4350 |
1,094*105 |
Е5 = -0,54 (-0,54) Е52 = 2,85 (2,86) |
|
фиолетовая |
764 |
100 |
4068 |
1,106*105 |
Е6 = -0,38 (-0,38) Е62 = 3,05 (3,02) |
Таблица 2 Серия Бальмера атома водорода
Расчетные формулы и теоретические данные:
![]()
![]()
![]()
![]()
![]()
