
Нарушение образования коллагена
может быть обусловлено мутациями генов коллагена или изменением активности ферментов, участвующих в его созревании. Это ведет к развитию таких заболеваний соединительной ткани, как: 1) несовершенный остеогенез, характеризующийся повышенной хрупкостью костей. Изменения в первичной структуре сопровождаются усилением гидроксилирования Лиз и гликозилирования оксилизина, повышенной чувствительностью такого коллагена к протеиназам. Меняются механические свойства коллагеновых фибрилл, нарушается минерализация костей; 2) синдром Марфана, при котором из-за мутации гена коллаген обладает слабой механической прочностью. Болезнь характеризуется кифосколиозом, арахнодактилией (паукообразные пальцы), деформацией грудной клетки, аневризмой аорты, эктопией хрусталика, долихостеномелией (длинные тонкие конечности). Предполагают, что легкой формой этого заболевания страдал Паганини; 3) синдром Элерса-Данлоса (СЭД), или «каучуковый человек», - это группа врожденных заболеваний соединительной ткани, для которых характерны истончение и гиперрастяжимость кожи, хрупкость сосудов, гиперподвижность суставов, деформация скелета. Таким больным очень сложно накладывать швы, так как нитки легко разрывают хрупкие ткани, а у женщин возникают преждевременные роды из-за самопроизвольного разрыва плодных оболочек.
При этих заболеваниях, наряду со структурными и регуляторными мутациями генов, наблюдаются врожденные и приобретенные энзимопатии: снижение активности лизилгидроксилазы, лизилоксидазы, недостаток Cu, фосфопиридоксаля (кофакторы лизилоксидазы), О2, вит.С, Fe2+ (кофакторы пролил- и лизилгидроксилаз), Zn (кофактор проколлагенпептидазы), действие ингибиторов лизилоксидазы (содержится, н-р, в душистом горошке), блокирование альдегидных групп альлизина (н-р, гомоцистеином, пеницилламином), неферментативное гикозилирование NH2-групп Лиз и оксилизина при сахарном диабете.
Другой фибриллярный белок соединительной ткани - эластин – тоже содержит много Гли и Про. В отличие от коллагена, в нем мало оксипролина, нет оксилизина, но много валина и других неполярных аминокислот.
При ферментативном гидролизе эластина образуются необычные структуры: 1)десмозин и изодесмозин; 2)лизиннорлейцин. Десмозин и изодесмозин формируются 4-мя остатками лизина, которые соединяются своими радикалами и образуют замещенное пиридиновое кольцо (рис.1).При образовании десмозина сначала 3 остатка Лиз окисляются до ε-альдегидов, а затем соединяются с 4-ым остатком Лиз. Т.о., десмозин и изодесмозин могут одновременно входить в состав 4-х пептидных цепей. Этим объясняют способность эластина растягиваться в двух направлениях. Наряду с десмозином и изодесмозином поперечные связи в эластине обеспечивает и лизиннорлейцин (рис. 2).
Nh co ch
NH
(CH2)3
NH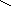


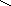
CH
(CH2)2
(CH2)2
CH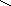



OC
CO

N+
(CH2)4





