
- •4. Активность, коэффициент активности, ионная сила раствора.
- •5. Термодинамическая, концентрационная и условная константы равновесия и их взаимосвязь.
- •6. Характеристика метода титриметрического анализа. Стандартные растворы.
- •7. Виды титрования
- •8. Закон эквивалентов, расчеты в титриметрии
- •9. Теории кислот и оснований. Протолитическая теория кислот и оснований.
- •10. Автопротолиз воды. Ионное произведение воды.
- •17. Ионно-хромофорная теория индикаторов.
- •18. Индикаторные ошибки в протолитометрии.
- •19. Кривая титрования сильной кислоты сильным основанием.
- •20. Кривая титрования слабой кислоты сильным основанием.
- •21. Равновесие в растворах комплексных соединений.
- •22. Хелатометрическое титрование.
- •23. Эдта и ее комплексы с металлами.
- •24. Рабочие растворы и индикаторы в комплексонометрическом титровании
- •25. Равновесный окислительно-восстановительный потенциал и константа равновесия реакции. Уравнение Нернста.
- •26. Расчет электродного потенциала полуреакции.
- •27. Виды окислительно-восстановительного титрования.
- •28. Кривая окислительно-восстановительного титрования.
- •29. Способы определения точки эквивалентности в окислительно-восстановительном титровании.
- •30. Гравиметрия. Характеристика метода.
- •31. Понятие константы растворимости.
- •32. Связь между константой растворимости и растворимостью.
- •33. Факторы, влияющие на процесс образования осадка.
- •34. Загрязнение осадков.
- •35. Этапы гравиметрии.
- •36. Осаждаемая и гравиметрические формы.
- •37. Гравиметрический фактор.
- •38. Факторы, влияющие на полноту осаждения.
- •39. Условия образования кристаллических и аморфных осадков.
- •40. Классификация физико-химических методов анализа.
- •41. Классификация спектральных методов. Электромагнитный спектр.
- •42. Основной закон светопоглощения. Ограничения и условия его применимости.
- •43. Причины отклонения от закона Бугера-Ламберта-Бера.
- •44. Фотометрия. Преимущества и недостатки метода.
- •45. Характеристики светопоглощения в фотометрии.
- •46. Оптимальные условия для проведения количественного фотометрического анализа (выбор длины волны и концентрации).
- •47. Аддитивность оптической плотности.
- •48. Приемы количественного фотометрического анализа.
- •49. Количественный фотометрический анализ смеси светопоглощающих веществ.
- •50. Метод дифференциальной фотометрии.
- •51. Метод эмиссионной фотометрии пламени.
- •52. Пламя и его характеристики.
- •53. Метод градуировочного графика при пламенно-эмиссионном анализе. Самоионизация и самопоглощение.
- •54. Классификация электрохимических методов анализа.
- •55. Прямая ионометрия. Методы градуировочного графика и добавок.
- •56. Потенциометрическое титрование. Способы нахождения точки эквивалентности.
- •57. Классификация электродов в потенциометрии.
- •58. Стеклянный электрод.
- •59. Хлоридсеребряный электрод.
- •60. Законы электролиза.
- •61. Кулонометрия при постоянном потенциале и постоянной силе тока.
- •62. Классификация хроматографических методов анализа.
- •63. Фронтальная, вытеснительная и элюентная хроматография.
- •64. Основные характеристики хроматографического пика.
- •65. Эффективность хроматографической системы. Концепция теоретических тарелок.
- •66. Кинетическая теория хроматографии. Уравнение Ван-Деемтера.
- •67. Критерии разделения в газовой хроматографии.
- •68. Газовая хроматография. Общая характеристика метода.
- •69. Детекторы в газовой хроматографии.
- •70. Качественный анализ в газовой хроматографии.
- •71. Методы количественного анализа в газовой хроматографии.
- •73. Характеристика ионитов и реакций в ионообменной хроматографии.
- •74. Плоскостная хроматография. Принципы и характеристики.
8. Закон эквивалентов, расчеты в титриметрии
Расчеты результатов титриметрического анализа: Основаны на принципе эквивалентности (закон эквивалентов) — вещества реагируют между собой в эквивалентных количествах. aS + bX = продукт S — титрант, x — определяемое вещество, a, b — стехиометрические коэффициенты. 1. a/b = 1 , CXVX = CSVS , mX = CSVSMX 2. a/b ≠ 1 , NXVX = NSVS , mX = NSVSMэX , где N — нормальность.
9. Теории кислот и оснований. Протолитическая теория кислот и оснований.
Теория |
Кислота |
Основание |
Реакция нейтрализации |
Электролитической диссоциации |
НА=Н++А- НА+Н2О= Н3О++А- Диссоциирует в водном растворе с образованием катиона гидроксония Н3О+ |
КОН=К++ОН- Диссоциирует в водном растворе с образованием аниона гидроксила ОН- |
Н3О+ + ОН- = 2Н2О |
Протолитическая |
Донор протона HCl↔H++Cl- H2O↔H++OH- |
Акцептор протона NH3+H+↔NH4+ H2O+H+↔H3O+ |
Образование сопряженных пар «кислота-основание» HCl+H2O↔Cl-+H3O+ к.1 о.2 о.1 к.2 |
Электронная |
Акцептор неподеленной электронной пары, обладает свободной орбиталью. |
Донор неподеленной электронной пары. |
H3N: + ◘H+ + Cl- ↔ NH4+Cl- |
Автопротолиза или сольвосистем |
Соединение, диссоциирующее с образованием катиона, соответствующего катиону растворителя, - иона лиония. |
Соединение, диссоциирующее с образованием аниона, соответствующего аниону растворителя, - иона лиата. |
Н3О+ + ОН- ↔ Н2О NH4+ + NH2-↔ 2NH3 |
Усановича |
Вещество, способное отдавать катион, соединяющееся с анионом или электроном или нейтрализующее основание с образованием соли |
Вещество, способное отдавать анион или электрон, соединяющееся с катионом, нейтрализующее кислоты с образованием соли |
Этому определению отвечают любые реакции, в том числе и окислительно-восстановительные. Право на существование теории спорно. |
Основой протолитометрии является протолитическая теория Бренстеда-Лоури (1923). «В протолитической теории кислотами называют вещества, способные отдавать протон другому веществу, а основаниями — вещества, способные принимать протон». Кислотно-основные реакции осуществляются за счет переноса протона от кислоты к основанию. Кислотно-основные взаимодействия приводят к тому, что кислота оказывается в равновесии с сопряженным основанием, а основание — с сопряженной кислотой. HA + B ↔ A- + BH+, где HA — кислота, В — основание, A- — сопряженное основание, BH+ — сопряженная кислота. Суть теории в том, что она учитывает влияние растворителя на процесс переноса протона. Диссоциация кислоты: HA + H2O ↔ A- + H3O+ Диссоциация основания: B + H2O ↔ BH+ + OH-
10. Автопротолиз воды. Ионное произведение воды.
Автопротолиз
SH
+ SH ↔ S- + SH2+

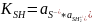 Автопротолиз
воды
H2O + H2O ↔ H3O+ + OH-
Автопротолиз
воды
H2O + H2O ↔ H3O+ + OH-
Константа
автопротолиза воды

При автопротолизе воды образуются равные количества ионов H3O+ и OH-. KW = [H3O+] * [OH-] = 1,0 * 10-14. [H3O+] = [OH-] = 10-7. Водородный показатель — характеристика кислотности раствора. рН = -lg aH+ = -lg CH+ -lg KW = - lg aH+ - lg aOH- pKW = pH + pOH = 14 [H+] = [OH-] pH = 7 [H+] > [OH-] pH < 7 [H+] < [OH-] pH > 7
Константы кислотности и основности связаны соотношением:
Kw = Ka •Kв,
где Kw — константа автопротолиза растворителя
Ионное произведение воды
При определенных условиях, вода может вести себя как акцептор протонов (в присутствии кислоты) или как донор протонов (в присутствии основания). Интересной особенностью воды является то, что она может подвергаться процессу самодиссоциации (автоионизации), т.е. быть одновременно и донором и акцептором протонов по отношению к самой себе.
2H2O ↔ H3O+ + OH—
Эта реакция – самопроизвольная диссоциация, осуществляется в небольшой степени. Ее можно упростить, если H3O+ заменить на H+
H2O ↔ H+ + OH—
Запишем выражение для константы равновесия, опираясь на закон действия масс:
K = [H+]·[OH—]/[H2O]
Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды:
KН2О = [H+]·[OH—]
При температуре 25ºС ионное произведение воды KН2О = 1·10-14 и остается постоянным в водных растворах кислот, щелочей, солей или других соединений.
KН2О = [H+]·[OH—] = 1·10-14
При повышении температуры ионное произведение воды сильно возрастает.
Полученное выражение применимо не только к чистой воде, но и к растворам.
Если осуществляется условие [H+] = [OH—], то раствор называется нейтральным, но обычно эти величины не совпадают, тогда при увеличении одного показателя, другой должен уменьшаться, так, чтобы их произведение оставалось постоянным (1·10-14)
11. Константы кислотности и основности.

12. Расчет pH в растворах сильных протолитов.


13. Расчет pH в растворах слабых протолитов.
 14.
Расчет рН в растворах солей.
14.
Расчет рН в растворах солей.

15. Буферные растворы. Расчет рН в буферных растворах.


16. Кислотно-основные индикаторы.
В методе кислотно-основного взаимодействия с этой целью используют такие вещества, окраска которых меняется в кислой и щелочной среде. Их называют кислотно-основные индикаторы или рН-индикаторы.
Кислотно-основные индикаторы представляют собой слабые органические кислоты или основания, протонированные и непротанированные формы которых различаются по структуре и окраске. Существуют одноцветные (например, фенолфталеин) и двуцветные (например, метиловый оранжевый) индикаторы. Окраска каждого из индикаторов изменяется в пределах определенного узкого интервала значений рН, его называют интервале значений рН, его называют интервале перехода окраски индикатора. Для двуцветных индикаторов он рассчитывается по формуле:
∆рН=рКи±1,
где Ки – константа диссоциации индикатора.
В пределах интервала перехода наиболее резко изменение индикатора наблюдается при определенном значении рН, которое называется показателем титрования и обозначается рТ. Величина рТ находится приблизительно в середине интервала перехода и фактически отождествляется м рКи.
Выбирают индикатор для титрования так, чтобы интервал перехода окраски индикатора (или рТ) ближе всего совпадал бы с рН титруемого раствора в точке эквивалентности. Поэтому для правильного выбора индикатора необходимо проследить характер кривой титрования, величину скачка титрования и установить рН, соотвествующее точке эквивалентности.
Для сужения интервала перехода и получения более резкого перехода окраски применяют смешанные индикаторы, которые составляют из индикатора и красителя. При определенном значении рН цвет красителя является дополнительным к цвету индикатора. В результате в этой точке окраска будет серой, а переход от окрашенного раствора к серому – контрастным.
Так как в кислотно-основных титрованиях обычно в качестве титранта применяют либо сильную кислоту, либо сильное основание, при выборе индикатора для титрования кислот и оснований можно пользоваться следующими общими указаниями:
Например – фф, метиловый красный, лакмус, метиловый оранжевый.
