
- •Курсовая работа на тему:
- •Содержание
- •Расчет показателей качества воды для установки
- •1. Исходная вода
- •Определение стабильности воды
- •Расчет удельной электропроводности исходной воды
- •2. Осветленная и умягченная вода
- •3. Технологический расчет механических и Na-катионитных фильтров.
- •1) Механические фильтры.
Определение стабильности воды
Расчет производится сравнением равновесной и фактической концентрации углекислоты в воде. Поскольку значения рН исходной воды не задано, принимаем рН=7. Для определения активностей ионов в воде найдем ионную силу (μ) и коэффициенты активности γIи γII.
=0,5(Сizi2) (2);
![]() (3);
(3);
где, Сi– концентрации ионов, моль/л;z– зарядi-го иона.
μ=0,5[ССа2+ ∙Z2Ca2+ +CMg2+ ∙Z2Mg2+ +СNa+ ∙Z2Na+ +CSO42- ∙Z2SO42-+CCl- ∙Z2Cl-+CNO3- ∙Z2NO3-
+CHCO3- ∙Z2 HCO3-]=0,5∙10-3(0,8 ∙22 +0,35 ∙22 +0,4∙12+0,055 ∙22+0,33 ∙12+0,16 ∙12+
+2,1 ∙12)=3,905∙10-3
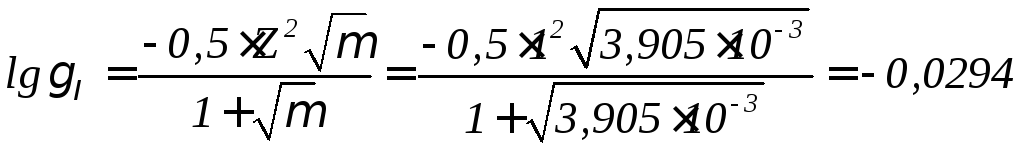
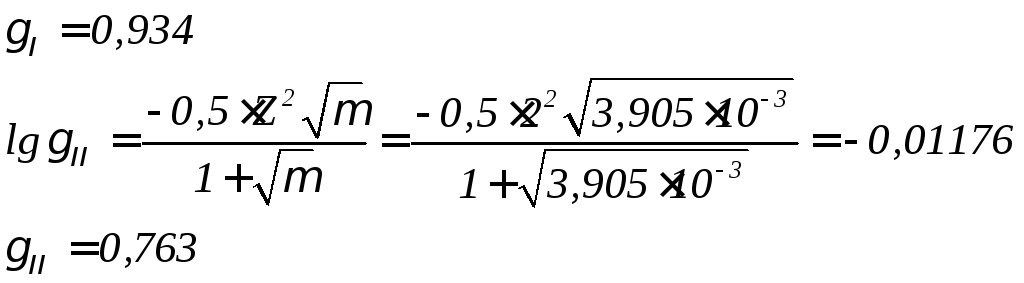
Определение равновесной концентрации угольной кислоты
Н2СО3 →;← НСО3– + Н+
НСО3– →;← СО32– + Н+
СО32– + Ca2+ →;← CaСО3 ↓(тв)
В этом случае концентрации ионов и молекул определяются совместным решением уравнений (4)÷(6):
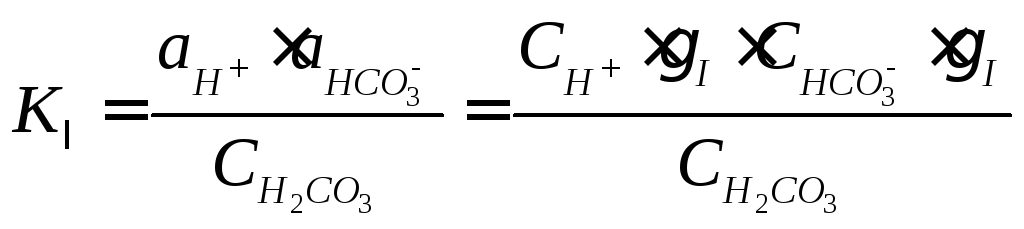 (4)
(4)
 (5)
(5)
![]() (6)
(6)
Равновесная концентрация углекислоты равна:
 (7)
(7)
где КIи КII– константы диссоциации углекислоты
поIиIIступеням;![]() - произведение растворимости СaCO3;
- произведение растворимости СaCO3;![]() ,
,![]() - концентрации ионов кальция и бикарбонатов,
моль/л.
- концентрации ионов кальция и бикарбонатов,
моль/л.
Фактическая концентрация углекислоты определяется из уравнения диссоциации по Iступени: Н2СО3→;← НСО3–+ Н+, по закону действующих масс, откуда
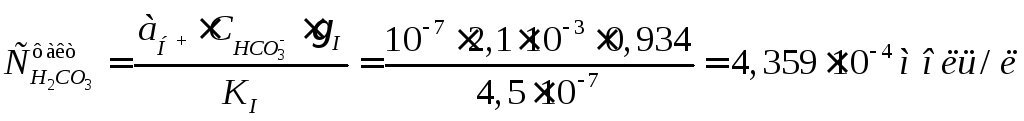 (8)
(8)
![]() =5,218·10-5моль/л <
=5,218·10-5моль/л <![]() =4,359·10-4моль/л.
=4,359·10-4моль/л.
То есть исходная вода – агрессивная, осадок СаСО3не выпадает.
Расчет удельной электропроводности исходной воды
В данном случае могут быть использованы выражения для расчета средних значений эквивалентных электропроводностей в виде уравнений (9)÷(11):
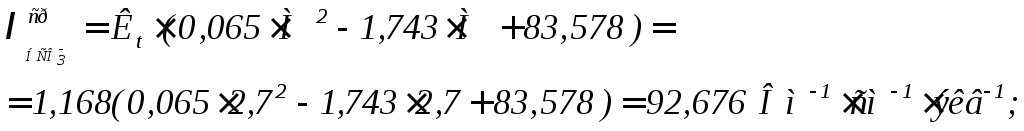 (9)
(9)
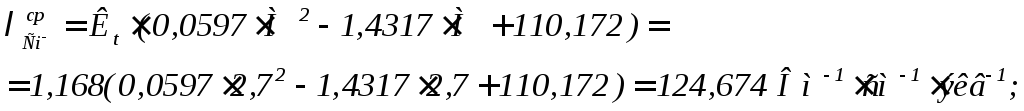 (10)
(10)
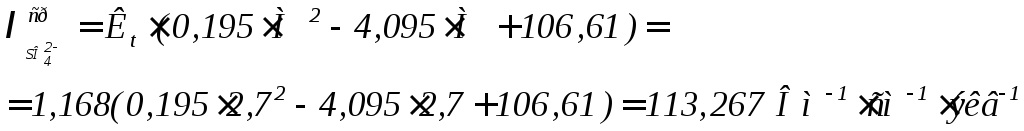 (11)
(11)
где, М=ΣKt=ΣAn– минерализация воды, мг-экв/л; Кt= 1 + 0,024(t– 18 °С) – температурный коэффициент, электропроводности при температуре раствораtºС.
Тогда, удельная электропроводность воды (χ, мкСм/см) определяется так:
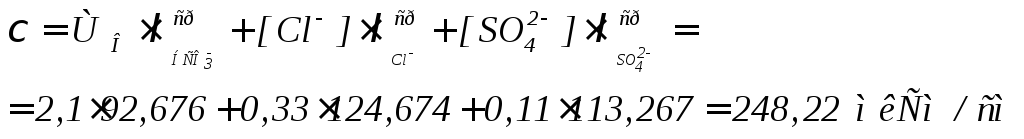 (12)
(12)
где,
![]() и
и![]() - концентрации хлоридов и сульфатов,
мг-экв/л.
- концентрации хлоридов и сульфатов,
мг-экв/л.
2. Осветленная и умягченная вода
Принципиальная схема предочистки и умягчения воды может быть представлена по рис. 1
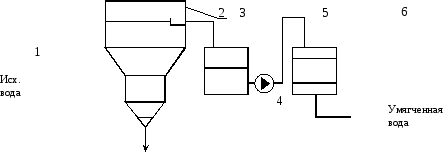
Рис. 1. Принципиальная схема осветления и умягчения воды.
1 – подогреватель сырой (исходной) воды; 2 – осветлитель; 3 – бак осветленной воды; 4 – насос подачи осветленной воды на механические фильтры; 5 – механические фильтры; 6 – Na-катионитные фильтры.
В подогревателе (1) исходная вода подогревается до температуры 30÷50 ºС для ускорения химических реакций. В осветлителе производится коагуляция коллоидных (органических) примесей и удаление шлама и грубодисперсных (взвешенных) примесей. Обычно, при ЩО>2 мг-экв/л рекомендуется наряду с коагуляцией производить известкование воды в осветлителе с целью снижения щелочности (или всех форм углекислоты) в воде. Обычно при этом уменьшается общая жесткость и кремнесодержание воды. Переливом вода из осветлителя поступает в бак осветленной воды (3), откуда насосом (4) прокачевается через механические (5) иNa-катионитные фильтры (6). При этом из воды удаляется «проскочивший» из осветлителя шлам и удаляются катионы накипеобразователи (Ca2+,Mg2+) в обмен наNa+из катионита. Умягченная вода накапливается в баке и расходуется на технологические нужды, в том числе, на питание установок обратного осмоса с целью обессоливания.
Щелочность природной воды по табл. 1 равна 2,7 мг-экв/л, т.е. более 2 мг-экв/л и в этом случае рекомендуется совмещение коагуляции воды с ее известкованием в осветлителе. Принципиальная схема осветлителя для коагуляции с известкованием приведена на рис. 2.
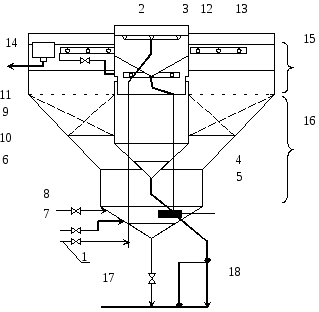
Рис. 2. Схема осветлителя типа ВТИ для известкования и коагуляции воды:
1 – подача обрабатываемой воды; 2 – воздухоотделитель; 3 – распределительная система; 4 – опускная труба; 5 – тангенциальный ввод воды; 6 – смеситель; 7 – подача раствора ИМ; 8 – подача раствора коагулянта; 9 – шламоприемные окна; 10 – шламоуплотнитель; 11 – слой контактной среды; 12 – водозаборное устройство; 13 – сборный желоб с отверстиями; 14 – выход осветленной воды; 15 – зона осветления; 16 – зона контактной среды; 17 – периодическая продувка; 18 – непрерывная продувка
В качестве коагулянта используется обычно сульфат железа (II), кристало-гидрат которого имеет химическую формулуFeSO4·7H2O. Известь вводится в виде известкового молока – суспензииCa(OH)2в воде. В ряде случаев используется насыщенный растворCa(OH)2, чтобы избежать процесса растворения твердогоCa(OH)2и ускорить химические реакции.
Показатели качества осветленной воды при разных схемах осветления воды могут быть определены по табл. 3.
Таблица 3. Показатели качества осветленной воды после разных схем предочистки
|
Показатель |
-М- |
-К-М- |
-К-И-М- |
-К-И-С-М- |
|
Остаток коагулянта, мг/л |
– |
<0,2 |
<0,1 |
<0,1 |
|
Снижение окисляемости, % |
0 |
50–75 |
40–50 |
40-50 |
|
Снижение содержания кремниевой кислоты, % |
0 |
10–20 |
30–40 |
30–40 |
|
Свободная углекислота, мг/л |
|
|
0 |
0 |
|
Щелочность общая, мг-экв/л: гидратная карбонатная бикарбонатная |
0 0
|
0 0
|
0,7–1,3 0,1–0,2 0,6–1,2 ~0 |
1–1,5 0,1–0,2 0,8–1,4 ~0 |
|
Жесткость общая, мг-экв/л, в т.ч. Жнк ЖMg |
|
|
(1–0,8) |
1–1,5 0
(0–0,2) |
|
Сульфаты, мг-экв/л |
|
|
|
|
|
Взвешенные в-ва, мг/л |
£2 |
£2 |
£2 |
£2 |
|
Прозрачность "шрифт", см |
³40 |
³40 |
³40 |
³40 |
|
рН |
рНисх |
рНисх– (0,1–0,5) |
9,5–10,5 |
9,5–10,5 |
|
Солесодержание, мг/л |
Sисх |
Sисх +ЭкDк |
Sисх–ЭкDк–50Що–3,5Ок | |
|
Примечание. исх – соответствует концентрации такого показателя в исходной воде; ос - соответствующий концентрации такого показателя в осветленной воде; Эк – эквивалент коагулянта; Дк – доза коагулянта, мг-экв/л; Ок – окисляемость исходной воды, г3/л | ||||
Показатели качества осветленной воды при дозе коагулянта 0,5 мг-экв/л:
- окисляемость – Окосв=0,5 ∙ 2,8=1,4 мгО/л;
- щелочность: общая (ЩОосв)=1,1 мг-экв/л;
гидратная (ЩГосв)=0,2 мг-экв/л;
карбонатная (ЩКосв)=0,9 мг-экв/л;
- жесткость общая ЖОосв=ЩОосв+ЖНКисх+ДК=1,1+0,2+0,5=1,8 мг-экв/л;
- сульфаты [SO42-]осв=[SO42-]исх+ ДК=0,11+0,5=0,61 мг-экв/л;
- взвешенные вещества – 10 мг/л;
- рН - 10 ед.рН;
- натрий - 0,4 мг-экв/л;
- хлориды - 0,33 мг-экв/л.
Проверка ионного состава примесей по уравнению электронейтральности дает ошибку:
![]()
Расчетная (требуемая) величина дозы извести вводимая в обрабатываемую воду (Дитр, мг-экв/л) определяется уравнением (13):
 (13)
(13)
при выражении всех концентраций в мг-экв/л.
При этом избыток извести (Ии) можно
принять равным гидратной щелочности
осветленной воды (Щг); величину![]() =0,8∙
=0,8∙![]() .
.
Количество образующегося в осветлителе осадка Си, мг/л, равно:
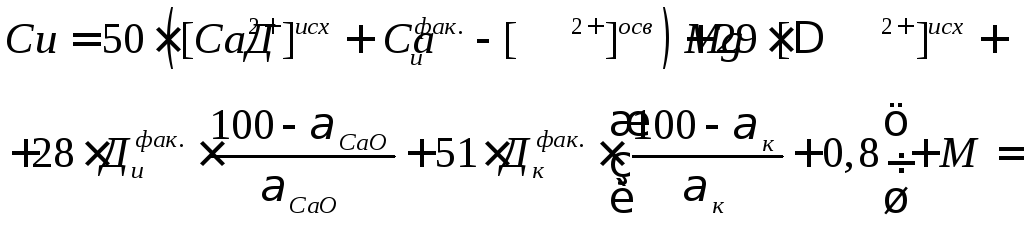
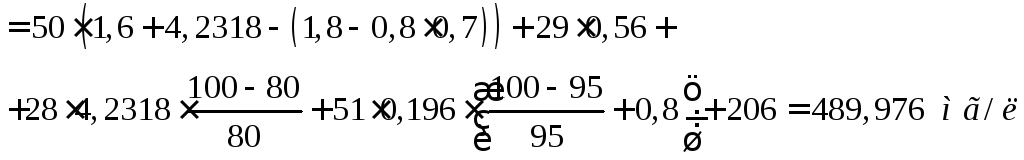 , (14)
, (14)
где СаО–
содержание окиси кальция в технической
извести в % от общей массы; М – содержание
механических примесей, мг/л;к– содержание коагулянта (FeSO4)
в техническом продукте, в % от общей
массы; [Са2+]исх, [Са2+]осв– концентрация катионов кальция в
исходной и в осветленной воде, мг/л;![]() мг-экв/л;
мг-экв/л;![]() –
фактическая доза коагулянта, мг-экв/л:
–
фактическая доза коагулянта, мг-экв/л:
![]() (15)
(15)
Основной характеристикой химического состава шлама, показывающей отношение Mg(OH)2/СаСО3, являетсям. Оптимальные значениямсоставляют от 0,050,1 до 0,20,25.
Расчетом параметр мопределяется
![]() , (16)
, (16)
где
![]() ;
;
где а – масса Са(ОН)2в известковом молоке, мг/л; с – количество СаСО3в известковом молоке, мг/л; можно принять с/а=0,05.
