
- •Министерство здравоохранения российской федерации
- •2. Ковалентные связи в соединениях углерода
- •3. Факторы, влияющие на доступность электронов
- •1. Индуктивный эффект – используется для характеристики электронного облака σ-связи
- •4. Энергетика реакции
- •5.Ароматичность Прежде чем приступить к рассмотрению темы, необходимо вспомнить теорию резонанса. Основные положения теории резонанса
- •Определение и классификация
- •Структурная формула бензола
- •Строение бензола
- •Строение и ароматичность нафталина
- •Механизм электрофильного замещения на примере бензола
- •Правила ориентации в бензольном кольце. Заместители первого и второго рода.
- •Теория ориентации
- •Электрофильное замещение в нафталине
- •Глава 1. Методы получения органических сульфокислот и сульфохлоридов
- •1. Общие сведения о процессе сульфирования
- •2. Схемы и механизм сульфирования аренов
- •3. Особенности сульфирования аренов серной кислотой
- •4. Особенности сульфирования аренов олеумом и серным ангидридом
- •5. Основные способы выделения сульфокислот
- •6. Сульфирование растворами триоксида серы в инертных растворителях
- •7. Сульфирование комплексными соединениями триоксида серы
- •8. Сульфирование хлорсульфоновой кислотой
- •9. Другие методы получения сульфокислот
- •10. Получение хлорангидридов сульфоновых кислот
- •Основные методы получения ароматических сульфохлоридов
- •Сульфохлорирование ароматических углеводородов
- •Сульфохлорирование аренов хлорсульфоновой кислотой в среде инертного органического растворителя
- •Сульфохлорирование алканов
- •Глава 2. Процессы нитрования органических соединений
- •1. Механизм реакции нитрования ароматических соединений
- •2. Влияние основных технологических параметров на процесс нитрования
- •3. Типовой процесс выделения нитропродуктов
- •4. Нитрование смесью азотной и серной кислот
- •5. Нитрование концентрированной азотной кислотой
- •6. Нитрование смесью азотной и уксусной кислот
- •7. Нитрование смесью концентрированной азотной кислоты или ее солей с уксусным ангидридом
- •8. Нитрование разбавленной азотной кислотой
- •Глава 3. Методы получения органических галогенидов
- •1. Галогенирование ароматических соединений
- •Влияние основных технологических факторов на процесс галогенирования аренов
- •Особенности технологии процесса галогенирования ароматических соединений
- •Хлорирование аренов в безводной среде
- •Бромирование ароматических соединений
- •1. Окисление растворов бромида натрия хлором
- •2. Окисление растворов бромида натрия гипохлоритом натрия:
- •Иодирование ароматических соединений
- •Примеры галогенирования ароматических соединений в производстве лекарственных веществ и витаминов
- •2. Галогенирование алканов и в боковую цепь аренов Реакции с молекулярным галогеном
- •Галогенирование с использованием специфических переносчиков галогена (спг)
- •Особенности технологии гомолитического галогенирования
- •Примеры гомолитического галогенирования в производстве лекарственных веществ и витаминов
- •3. Синтез галогенидов из непредельных соединений
- •4. Галогенирование альдегидов, кетонов и карбоновых кислот Радикальное галогенирование альдегидов, кетонов и карбоновых кислот
- •Примеры реакций галогенирования карбонильных соединений
- •Гетеролитическое галогенирование карбоновых кислот
- •Синтез геминальных полигалогеналканов из карбонильных соединений и карбоновых кислот
- •5. Замена гидроксильных групп в спиртах, фенолах и карбоновых кислотах на галоген
- •6. Замещение одних атомов галогена на другие
- •Глава 4. Процессы нитрозирования. Основные реакции диазосоединений
- •1. Химизм процесса и краткая характеристика продуктов реакции
- •2. Влияние основных технологических параметров на ход процесса диазотирования
- •3. Кислотно-основные превращения ароматических диазосоединений
- •4. Реакции замены диазониевой группы
- •5. Реакция азосочетания
- •6. Некоторые реакцииполучения нитрозо- и диазосоединений
- •Глава 5. Замещение галогена и сульфогруппы на другие функциональные группы
- •1. Нуклеофильное замещение галогена в молекуле органического соединения
- •Сведения о механизме реакции
- •Основные факторы, влияющие на ход процесса
- •Использование катализаторов
- •Процессы гидролиза галогенидов
- •Замена атома галогена на алкокси- и феноксигруппы
- •Замена атома галогена на меркапто- и алкил(арил)тиогруппы
- •Замена атома галогена на аминогруппы
- •Замена атома галогена на цианогруппу
- •Замена атома галогена на группу -so3Na
- •2. Нуклеофильное замещение сульфогруппы
- •Реакции щелочного плавления
- •Примеры нуклеофильной замены сульфогруппы в промышленности
- •Глава 6. Процессы алкилирования
- •1. Алкилирование аренов по Фриделю-Крафтсу
- •2. Особенности технологии алкилирования аренов по Фриделю-Крафтсу
- •4. Алкилирование по атому азота (n-алкилирование)
- •6. Гидрокси-, галоген- и аминометилирование
- •Глава 7. Процессы ацилирования
- •1. Ацилирование по атому углерода (с-ацилирование)
- •2. Ацилирование по атому азота (n-ацилирование)
- •Глава 8. Методы восстановления
- •1. Химические методы восстановления
- •Восстановление металлами и солями металлов
- •Восстановление натрием
- •Восстановление оловом и хлоридом олова (II) в кислой среде
- •Восстановление цинком
- •Восстановление железом
- •Восстановление алкоголятами алюминия (метод Меервейна-Понндорфа-Верлея)
- •Восстановление гидридами металлов
- •Восстановление по Кижнеру-Вольфу
- •Восстановление соединениями серы
- •Восстановление сульфидами щелочных металлов
- •Восстановление нитрогруппы серой в щелочной среде
- •Восстановление сернистой кислотой и ее солями
- •Восстановление дитионитом натрия
- •Каталитическое восстановление водородом
- •Восстановление на никелевых катализаторах
- •Восстановление на платиновых и палладиевых катализаторах
- •3. Электролитическое восстановление
- •Глава 9. Методы окисления
- •1. Синтез алкенов методами каталитического и окислительного дегидрирования
- •2. Синтез альдегидов с использованием методов окисления и дегидрирования
- •3. Окислительные методы получения кетонов
- •4. Окислительные методы получения карбоновых кислот
- •5. Окисление непредельных углеводородов
- •6. Окисление ароматического цикла
3. Типовой процесс выделения нитропродуктов
Типовой процесс выделения нитропродуктов из реакционной массы включает следующие стадии:
1. Отстаивание или сепарация реакционной массы для отделения нитропродукта от отработанной кислоты. Если нитропродукт является в обычных условиях жидкостью, то отстаивание проводят при температуре производственного помещения, а если твердым веществом, то при повышенной температуре, чтобы продукт находился в расплаве.
2. Нейтрализация и промывка нитропродуктаразбавленным раствором соды или аммиака и водой для очистки его от примесей отработанных кислот.
3. Очистка нейтрализованных и промытых жидких нитропродуктов перегонкой. Легко застывающие продуктыкристаллизуют, гранулируют и сушат.
4. Экстракция нитропродукта из отработанной кислоты после сепарации реакционной массы. Это позволяет увеличить выход целевого продукта и облегчить утилизацию отработанной кислоты.
Экстракцию проводят обычно субстратом. Если отработанная смесь содержит азотную кислоту, то параллельно происходит частичное нитрование экстрагента за счет остатков азотной кислоты. После разделения в отстойнике отработанную кислоту направляют на концентрирование и денитрацию, а раствор нитропродукта в субстрате загружают в нитратор.
4. Нитрование смесью азотной и серной кислот
Использование смеси азотной и серной кислот — самый распространенный и детально разработанный метод нитрования ароматических соединений. В производстве лекарственных веществ и витаминов применяется чаще всего.
Нитрующая смесь готовится смешением концентрированных серной (иногда олеума) и азотной кислот. При мононитрованииизбыток азотной кислоты ~ 5 %, а при получении полинитросоединений — 10—20 % от теории.Концентрация серной кислоты в нитрующей смеси должна быть тем выше, чем меньше реакционная способность субстрата и чем больше нитрогрупп вводится в его молекулу. Например, состав смеси для мононитрования толуола: 35 %HNO3, 50 %H2SO4, 12 %H2O, а для введения второй нитрогруппы необходима безводная смесь, состоящая из 33 %HNO3и 67 %H2SO4.Состав нитрующей смесистрого определен в каждом конкретном случае. При этом к концу реакции на 1 мольH2SO4должно приходиться не более двух молей воды, образующейся во время реакции и введенной с нитрующей смесью или нитруемым соединением.
Схема приготовления нитрующей смеси включает аппаратуру для отмеривания, смешения и хранения приготовленных смесей.
В качестве смесителяможет быть использован любой аппарат, обеспечивающий интенсивноеперемешиваниежидкости иотвод тепла, выделяющегося в результате смешения кислот, внутренние поверхности которого защищены от кислойкоррозии.
Интенсивное перемешивание компонентов осуществляется при помощи погружногонасоса, механическоймешалкии путембарботированиявоздуха через реакционную массу. Однако, воздух, барботируя через смесь кислот, вносит с собой влагу и выдувает из смеси некоторое количество окислов азота, снижая концентрацию азотной кислоты. Кроме того, барботеры весьма быстро разъедаются и выходят из строя.
Температура смеси не должна быть выше 35—40 °С. Превышение этой температуры приводит к частичномуразложению азотной кислоты с образованием окислов азота. В случае использования отработанной кислоты, содержащей небольшое количество нитропродуктов и нитрозилсерную кислоту, повышение температуры может привести к ухудшению качества реакционной массы иобразованию взрывчатых полинитросоединений, а также кповышенной коррозии аппаратуры.
Установку для смешения кислот большой производительности снабжают выносным теплообменником, что позволяет поддерживать температуру смеси на заданном уровне.
Нитрование аренов ведут при температурах тем ниже, чем активнее субстрат. Это связано с опасностью образования взрывоопасных ди- и тринитропродуктов.
В синтезе билигноста бензойную кислоту нитруют при 30—40 °С:
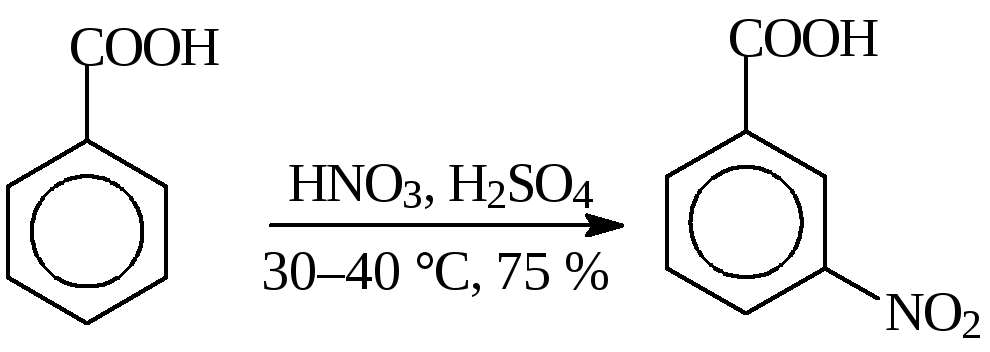
При получениихлорбутинареакцию фенилмасляной кислоты с нитрующей смесью проводят при 14—15 °С:

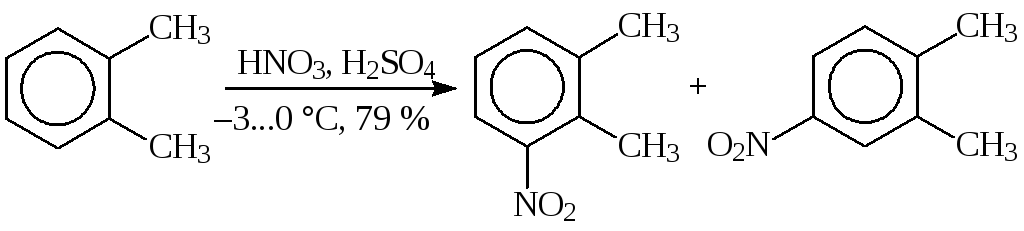
В производстве мефенамовой кислоты нитрованиео-ксилола ведут при –3…0 °С
L-Тирозин, вследствие высокой реакционной способности и легкой окисляемости субстрата, нитруют до 3,5-динитротирозина при температуре –5…0 °С(получениемеотиронина):
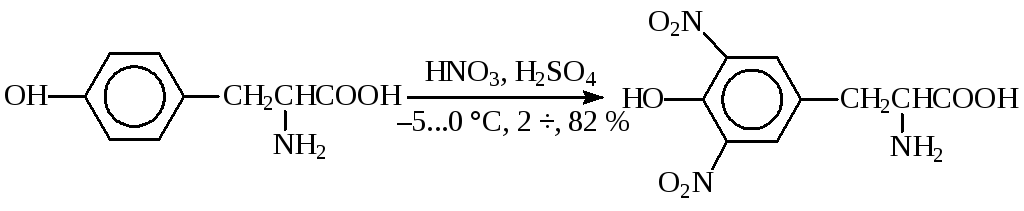
Для введения нитрогруппы в трудно нитруемые соединения используют смесь нитратов щелочных металлов (KNO3, NaNO3) и концентрированной серной кислоты. Высокая нитрующая активность такой смеси объясняется отсутствием воды в исходной системе. Так, нитрование пиридина с выходом 15—20 % удалось провести добавлением небольших порций нитрата калия в раствор пиридина в 18%-ом олеуме, нагретый до 330 °С.
К преимуществам метода можно отнести: а) возможность применения стехиометрического количества азотной кислоты; б) почти постоянную концентрацию NO2+в широком диапазоне соотношенийH2SO4/HNO3(см. рис. 4); в) низкое окислительное действие азотной кислоты; г) низкую коррозию (или отсутствие таковой) стальной и чугунной аппаратуры в серно-азотных нитрующих смесях; д) хорошую растворяющую способность серной кислоты, ее высокую температуру кипения и теплоемкость.
Недостатком метода нитрования смесями азотной и серной кислот (или олеума) является необходимостьрегенерациисерной кислоты после разбавления нитромассы водой. Особенно сложной является эта проблема на химфармпредприятиях, производящих, как правило, мононитросоединения в сравнительно небольших количествах, где строительство цехов для регенерации отходов серной кислоты экономически невыгодно.
Для решения этой проблемы серную кислоту заменяют другими кислотными агентами, легче поддающимися регенерации. С этой целью применяютполифосфорную кислоту (при выделении получаются фосфорные удобрения); нерастворимыекатиониты типа сульфированного полистирола (например, амберлитIR-120), обезвоженные азеотропной отгонкой воды с толуолом или другими способами;каталитические количества серной или фосфорной кислот, нанесенные на носители (например,Al2O3,Al2O3сSiO2).
При использовании катионитов нитрование, возможно, проходит через образование нитроний-катионов или их ионных пар с анионными центрами смолы типа R–(SO3–…+NO2). Увеличение размера «нитрующей частицы» в последнем случае и регулярное строение катионита вследствие стерических препятствий уменьшаеторто-замещение. Так, если при нитровании толуола серно-азотными нитрующими смесями, в зависимости от температуры, отношениеорто- :пара-изомеров около 1,5, то при использовании концентрированнойHNO3на катионите оно уменьшается практически в 2 раза.
