
- •Ответы на экзаменационные вопросы 2014 года.
- •Глава 3. Основы химической термодинамики и биоэнергетики (1-4)
- •Глава 4. Основы кинетики биохимических реакций и химического равновесия. (5-8)
- •Глава 5. Растворы и их коллигативные свойства. (9-11)
- •Глава 6. Растворы электролитов и ионные равновесия. (12-13)
- •Глава 7. Теория кислот и оснований Бренстеда. Протолитические равновесия. (14-15)
- •Глава 8. Окислительно – восстановительные реакции. (16-18)
- •Глава 9. Комплексные соединения и их свойства (19-20)
- •Глава 10. Химия Биогенных элементов. (21-26)
- •Глава 11. Химия ионов – металлов жизни. (27-28)
- •Глава 12. Межфазные электрические потенциалы. Гальванические цепи. (29 –32)
- •Глава 13. Физико - химические основы поверхностных явлений. (33-38)
- •Глава 14. Физико – химия дисперсных систем. (39-44)
Глава 9. Комплексные соединения и их свойства (19-20)
Сущность реакций комплексооборазования. Комплексные соединения и природа связи в них. Комплексообразователи (акцепторы) координационное число. Лиганды, дентанотность и типы лигандов. Внутренняя и внешняя сфера комплекса.
Сущностькомплексооборазования заключается во взаимодействии двух противоположностей:акцептораэлектронной пары идонораэлектронной пары.
Комплексные соединения– устойчивые химическое соединения сложного состава, в которых обязательно имеется хоть одна связь, возникшая по донорно – акцепторному механизму.
M([ ])n+n[![]()
![]() ]⇌
[M([
]⇌
[M([![]()
![]() L)n]
L)n]
Комплексные соединения состоят из:
- Комплексообразователь ( центральный атом ) – атом или ион, который является акцептором электронных пар, предоставляя свободные атомные орбитали ,и занимает центральное положение в комплексном соединении.
Комплексообразователи (акцепторы) координационное число - число молекул или ионов, соединенных непосредственно с атомом-комплексообразователем. (Это число связей, которое комплексообразователь способен образовать)
- Лиганды – молекулы или ионы, которые являются донорами электронных пар и непосредственно связаны с комплексообразователем.
Лиганды – анионы: F-, Cl-, Br-, I-, OH-, NO2-, CN-(цианид), CNS-(роданид), RS-(тиолат), RCOO-(карбоксилат)
Лиганды –
молекулы:
H2O,
ROH,
R-O-R,
CO,
NH3,
RNH2,
RNHR,
RCH=CH2,
RC=-CH
(этиленовые и ацетиленовые углеводороды
(за счет электронных пар
![]() - связей).
- связей).
Типы лиганд:
- Монодентантные (все вышеуказанные).
- Бидентантные (доноры двух электронных пар: молекула этилендиамина, дианион щавелевой кислоты, анион аминоуксусной кислоты).
- Полидентантные (более двух электронных пар: дианион порфирина, тетранион этилендиаминтетраукусуной кислоты (EDTA)).
Дентантность – число связей одного лиганда с комплексообразователем.
Внутренняя сфера комплексного соединения есть совокупность центрального атома и лигандов. В этой сфере связь комплексообразователя с лигандами имеет донорно-акцепторное происхождении и является ковалентной. Может быть: заряжена положительна – катион; заряжена отрицательно – анион; электронейтральна.
Внешняя сфера комплексного соединения – это положительно или отрицательно заряженные ионы, нейтрализующие заряд комплексного иона и связанные с ним ионной связью. Суммарный заряд этой сфера всегда равен по значению и противоположен по знаку заряду внутренней среды, чтобы молекула комплексного соединения была электронейтральна.
Учебник: 244 - 246.
Химическая связь в комплексных соединениях. Особенности строения внутренней сферы. Жесткие и мягкие акцепторы и лиганды в теории Пирсона. Хелаты. Диссоциация комплексных соединений в растворах. Константы нестойкости.
В образовании химической связи в комплексах главную роль играет донорно – акцепторное взаимодействие лигандов ( доноры ) и комплексообразователя ( акцептор ). При этому между ними возникает ковалентная и не сильно полярная связь.
Особенности свойств внутренней сферы комплекса: строго определённое пространственное расположение лигандов вокруг комплексообразователя и достаточно высокая устойчивость к диссоциации связи лиганда с комплексообразователем.
Структура
внутренней сферы определяется типом
гибридизации исходных свободных атомных
орбиталей комплексообразователя.

Если два одинаковых лиганда расположены рядом, то такое соединение называется цис – изомером, если эти лиганды расположены по разные стороны от комплексообразователя, то это транс – изомер. [Pt(NH3)2Cl2] – пример.
Поляризуемость – способность трансформировать свои электронные оболочки под внешним воздействием.
По этому признаку реагенты подразделяются
на «жесткие»,
или малополяризуемые, и «мягкие»
- легкополяризуемые. Чем меньше
радиус
и число e-
у частицы, тем менее она поляризуема.
Хелаты – устойчивые комплексы металлов с полидентантными лигандами, в которых центральный атом является компонентом циклической структуры. (глицин, этилендиаминтетрауксусная кислота (EDTA) или ее динатриевая соль, называемая трилон Б – образуют хелаты)
Диссоциация комплексов:
Первичная диссоциация комплексного соединения – это распад комплексного соединения в растворе на комплексный ион внутренней сферы и на ионы внешней сферы.
[Ag(NH3)2)]Cl [Ag(NH3)2]+ + Cl-
Вторичная диссоциация комплексного соединения – это распад внутренней сферы комплекса на составляющие ее компоненты.
[Ag(NH3)2)]+ ⇌ [Ag(NH3)]+ + NH3 – 1 ступень
[Ag(NH3)]+ ⇌ Ag+ + NH3 – 2 ступень
Константа нестойкости (Кнест) – константа равновесия, описывающая полную ее диссоциацию.
[Ag(NH3)2)]+ = Ag+ + 2NH3
Kнест
=
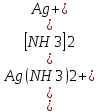
Чем меньше Kнест, тем стабильнее внутренняя сфера комплекса, т.е. тем меньше диссоциирует в водном растворе.
Учебник: 246 - 252.
