
- •Предмет, задачи общей и неорганической химии. Роль химии в естественных науках.
- •Основные понятия химии
- •Основные стехиометрические законы.
- •4. Важнейшие классы и номенклатура неорганических веществ.
- •5. Строение атома; развитие учения о строении атома; модели Томсона, Резерфорда, Бора.
- •6. Строение электронных оболочек атомов.
- •7. Периодический закон и периодическая система элементов.
- •8. Периодичность свойств химических элементов.
- •9. Природа химической связи. Основные типы химической связи.
- •10. Ковалентная химическая связь. Способы образования ковалентной связи. Основные характеристики.
- •11. Свойства ковалентной связи. Степень окисления атома.
- •12. Геометрия структур с ковалентным типом связи (гибридизация sp, sp2, sp3)
- •13. Основы метода валентных связей и метода молекулярных орбиталей.
- •14. Ионная и металлическая связь. Водородная связь. Межмолекулярное взаимодействие
- •15. Кристаллическое, жидкое и аморфное состояние веществ.
- •16. Скорость химических реакций. Константа скорости и ее физические свойства
- •17. Влияние температуры на скорость химических реакций. Основные положения теории активации Аррениуса.
- •18. Катализ. Влияние катализаторов на скорость химических реакций.
- •19. Необратимые и обратимые реакции. Принцип Ле Шателье.
- •20. Дисперсные системы и их характеристика. Коллоидные растворы
- •3. По агрегатному состоянию дисперсионной среды и дисперсной фазы.
- •21. Растворение как физико-химический процесс.
- •22. Растворимость веществ. Состав растворов.
- •23. Основные положения теории электролитической диссоциации.
- •24. Сильные и слабые электролиты. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
- •25. Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
- •26. Константа диссоциации слабых электролитов. Закон разбавления Оствальда
- •27. Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
- •28. Диссоциация воды. Константа диссоциации, ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •29. Произведение растворимости. Условия образования и растворения осадков. Реакции обмена в растворах электролитов.
- •30. Гидролиз солей. Количественные характеристики гидролиза.
- •31. Теория окислительно-восстановительных реакций. Важнейшие окислители и восстановители. Составление уравнений окислительно-восстановительных реакций. Метод электронного баланса.
- •32. Ионно-электронный метод (метод полуреакций). Классификация окислительно-восстановительных реакций.
- •33. Электрохимические процессы. Электродный потенциал. Стандартные электродные потенциалы. Водородный электрод.
- •34. Электрохимический ряд напряжений металлов. Уравнение Нернста. Гальванический элемент и его э.Д.С. Влияние условий на протекание окислительно-восстановительных процессов.
- •35. Основные положения координационной теории. Строение комплексного соединения.
- •36. Устойчивость комплексных соединений. Понятие о двойных солях. Биологическая роль комплексных соединений.
- •37. Общая характеристика водорода. Гидриды. Ион водорода и ион гидроксония.
- •38. Галогены. Общая характеристика элементов. Особенности фтора. Свойства простых веществ галогенов.
- •39. Галогеноводороды. Галогениды. Особенности плавиковой кислоты. Соляная кислота. Роль соляной кислоты и хлоридов в живых организмах.
- •40. Кислородсодержащие соединения галогенов. Кислородные кислоты хлора и их соли. Хлорная известь. Бертолетова соль. Перхлораты. Кислородосодержащие кислоты брома, иода и их соли.
- •41. Общая характеристика элементов via группы. Особенности кислорода. Аллотропия и изоморфизм серы. Свойства простых веществ. Применение и биологическое значение халькогенов.
- •42. Гидриды типа н2э. Ассоциация молекул воды. Токсичность сероводорода и других халькогеноводородов, их физиологическое действие.
- •43. Вода. Клатраты. Вода как растворитель. Вода в природе и ее роль в жизнедеятельности организмов. Пероксид водорода.
- •44. Халькогениды. Растворимость и гидролиз сульфидов металлов. Полисульфиды.
- •45. Оксиды халькогенов. Диоксиды и триоксиды элементов. Сернистая, селенистая и теллуристая кислоты.
- •52. Фосфорные удобрения. Сложные минеральные удобрения.
- •1. Мышьяк
- •2. Сурьма
- •3. Висмут
- •54.Общая характеристика элементов iva группы. Способность
- •56.Кислородсодержащие соединения углерода. Оксиды углерода.
- •57. Угольная кислота и ее соли. Временная жесткость воды и
- •57.Угольная кислота и ее соли. Временная жесткость воды и способы ее устранения. Карбонатное равновесие в природе.
- •59.Общая характеристика металлов. Общая характеристика валентных состояний металлов а и в групп. Значение и роль металлов в жизнедеятельности живых организмов.
35. Основные положения координационной теории. Строение комплексного соединения.
Основные положения «Координационной теории» Вернера
1. В любом комплексном соединении есть внутренняя и внешняя сфера.Внутренняя сфера называется «комплексным ионом» и заключается в квадратные скобки. В химических реакциях или в кристаллической структуре комплексный ион выступает как самостоятельная единица: K3[Fe(CN)6] ↔ 3K+ + [Fe(CN)6]3─
2. Центральный атом внутренней сферы называется комплексообразователем (КО) или ядром комплекса. Роль комплексообразователя выполняют чаще всего катионы металлов, напр. [Fe(CN)6]3─, [Co(NH3)6]2+, реже нейтр.атомы - Ni(CO)4 или анионы - [NH4]+.
3. Ионы или молекулы, которые координируются вокруг центрального атома во внутренней сфере, называются лигандами (от латинского liganda - «то, что связано») или аддендами (от латинского addenda - «то, что добавлено»).
4. Координационное число – это число лигандов, которое удерживается комплексообразователем. Координационное число обычно бывает больше, чем степень окисления КО:
Заряд центр.иона координац.число
+1 2
+2 4, 6
+3 6, 4
+4 8
Координационное число (к.ч.) зависит от: 1) природы КО и лигандов; 2) размеров КО и лигандов.
5.Число мест во внутренней сфере, которые занимает один лиганд, называется координационной емкостью лиганда. Монодентатный лиганд связан с комплексообразователем только одним из своих атомов: NH3, OH─.
Бидентатный лиганд – двумя атомами: CO32-, SO42-, C2O42- и т.д.
Полидентатные лиганды связаны с комплексообразователем тремя и более атомами (например, ЭДТА занимает 6 мест во внутренней сфере).
6. Заряд комплексного иона численно равен алгебраической сумме зарядов всех составляющих его ионов. С другой стороны, заряд внутренней сферы равен по абсолютному значению и противоположен по знаку заряду внешней сферы.
В целом, комплексные соединения – электронейтральны.
Строение комплексных соединений
При взаимодействии частиц наблюдается взаимная координация частиц, которую можно определить как процесс комплексообразова-ния. Например, процесс гидратации ионов заканчивается образованием аквакомплексов. Реакции комплексообразования сопровождаются переносом электронных пар и приводят к образованию или разрушению соединений высшего порядка, так называемых комплексных (координационных) соединений. Особенностью комплексных соединений является наличие в них координационной связи, возникшей по донорно-акцепторному механизму:
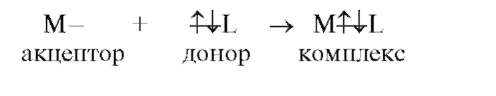
Комплексными соединениями называются соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома, окруженного лигандами. Комплексные соединения можно рассматривать как сложные соединения высшего порядка, состоящие из простых молекул, способных к самостоятельному существованию в растворе.
36. Устойчивость комплексных соединений. Понятие о двойных солях. Биологическая роль комплексных соединений.
Устойчивость комплексных соединений
Прочность комплексного соединения характеризуется константой нестойкости (константой равновесия диссоциации комплексного иона) или обратной ей константой устойчивости. Чем больше величина константы нестойкости, тем сильнее комплексный ион диссоциирует в растворе и тем менее он устойчив.
Устойчивость комплексных соединений определяется как внешними условиями (температура, природа растворителя, ионная сила, состав раствора), которые учитываются при расчёте условной константы устойчивости, так и фундаментальными факторами. Такими факторами являются: природа центрального атома и донорных атомов лигандов, структура лигандов и стерические факторы.
Двойные соли
Двойные соли – это кристаллические комплексные соединения, образованные из простых солей и имеющие малоустойчивую внутреннюю сферу. Часто формулу двойной соли обозначают перечислением формул простых солей, разделяя их точкой. Например, соль К2[CuCl4] представляют формулой CuCl2•2KCl. Такая формула не означает смеси двух солей! Двойные соли образуют отдельную область среди комплексных соединений.
Получают двойные соли кристаллизацией из раствора (например, KCl•MgCl2, 2NaCl•CoCl2, CaCl2•BaCl2) или твердофазным синтезом.
К двойным солям относят также комплексные соли, малорастворимые в воде, например, известные вам криолит или малахит.
Комплексные соединения активно образуются в биологических системах с участием лигандов –аминокислот, пептидов, белков, нуклеиновых кислот и других веществ; комплексы белков с катионами металлов играют роль металлоферментов, катализирующих большинство химических превращений. В качестве центрального иона металлофермента выступают катионы Mn2+,Cr2+,Fe3+, Zn2+ и др. К комплексным соединениям относятся витамины, гормоны, металлоферменты (инсулин - комплекс ионов цинка с белками: витамин В12 - комплекс кобальта с порфирином: гемоглобин крови - комплекс порфирина с железом (II)). В легких, где парциальное давление кислорода велико, гемоглобин связывается с кислородом как с лигандом, а в тканях освобождает его. В случае патологии лигандом может быть другое вещество - угарный газ (СО). С ним образуется комплекс в 300 раз более прочный, чем с кислородом. Этим объясняется токсичность действия угарного газа.
