
- •Оглавление
- •Авторский коллектив
- •Список сокращений
- •Предисловие
- •Введение
- •Глава 5. Болезни сердца
- •Глава 7. Болезни вен
- •Глава 8. Болезни пищевода
- •Глава 9. Болезни диафрагмы
- •Глава 10. Грыжи живота
- •Глава 12. Рак желудка
- •Глава 13. Болезни печени
- •Глава 15. Болезни селезенки
- •Глава 16. Болезни надпочечников
- •Глава 19. Болезни тонкой кишки
- •Глава 22. Болезни прямой кишки
- •Глава 24. Перитонит
- •Глава 26. Морбидное ожирение
- •Заключение

ГЛАВА 24 Перитонит
А.Ф. Черноусов, Т.В. Хоробрых
Различают полость живота и брюшную полость. Полость живота выстлана изнутри фасцией endoabdominalis. Она ограничена: сверху — диафрагмой, спереди — мышцами передней брюшной стенки, сзади — позвоночником, мышцами поясницы и подвздошными мышцами. Внизу полость живота переходит в полость таза (cavum pelvis); границу между ними проводят условно по плоскости, проведенной через верхний край лонного сочленения и мыс (promontorium). Брюшная полость ограничена париетальным листком брюшины. Пространство, расположенное позади брюшной полости, между париетальным листком брюшины и фасцией endoabdominalis, именуют забрюшинным пространством.
По отношению к брюшине органы живота расположены интраперитонеально, мезоперитонеально или экстраперитонеально. Интра- и мезоперитонеально расположенные органы относят к органам брюшной полости; органы, лежащие полностью экстраперитонеально, — к органам забрюшинного пространства.
Интраперитонеально расположены желудок, селезенка, тонкая кишка, сигмовидная кишка, червеобразный отросток, они покрыты висцеральной брюшиной со всех сторон. Интраперитонеально расположенные органы имеют значительную подвижность. Степень их смещаемости зависит от длины и расположения брыжейки или связок.
Мезоперитонеально находятся печень, желчный пузырь, слепая, восходящая и нисходящая ободочная кишка, они покрыты брюшиной не полностью. Внебрюшинные поля на их задней стороне достаточно широкие, они непосредственно фиксированы к брюшной стенке. Смещаемость их очень мала. Относительно
больше смещаются те части органа, которые покрыты брюшиной.
Экстраперитонеально расположены почки, надпочечники, мочеточники, поджелудочная железа, бóльшая часть двенадцатиперстной кишки, они не покрыты висцеральной брюшиной. Париетальная брюшина, ограничивающая брюшную полость сзади, в некоторых местах лежит близко к их передним поверхностям.
Пространство между соприкасающимися поверхностями брюшины (полость брюшины) представляет капиллярную щель, в нормальных условиях в ней имеется очень небольшое количество жидкости (около 30 мл).
Брюшина представляет собой тонкую серозную оболочку, выстилающую внутреннюю поверхность брюшной стенки (париетальная брюшина) и расположенные в брюшной полости органы (висцеральная брюшина). Гладкая поверхность брюшины и наличие тонкого слоя жидкости обеспечивают возможность легкого смещения органов при дыхании, перистальтике и при перемене положения туловища. Давление
вполости брюшины близко к атмосферному (0–0,25 мм рт. ст.) и испытывает небольшие колебания при дыхании, изменении объема полых органов, перемене положения туловища. Площадь поверхности брюшины в среднем составляет около 20 400 см2. Брюшина представляет собой полунепроницаемую активно функционирующую мембрану, через которую диффундируют низкомолекулярные субстанции в двух направлениях — в брюшную полость и из нее
вобщий кровоток. Брюшина выполняет следующие функции: резорбтивную (всасывание из брюшной полости через лимфатические и кровеносные сосуды жидкости, экссудата, продуктов распада и лизиса белков, некротических
460
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
461 |
тканей, бактерий); экссудативную (выделение жидкости и фибрина); барьерную (механическая защита органов брюшной полости, защита организма от инфекции при помощи гуморальных и клеточных механизмов). Барьерная функция брюшины обеспечивается находящимися в ней клетками мононуклеарно-фагоцитарной системы, которые наряду с гранулоцитами, Т- и В-лимфоцитами фагоцитируют и переваривают проникшие бактерии и инородные частицы. В течение суток брюшина может сецернировать и резорбировать около 5–6 л жидкости.
Брюшина обладает выраженными пластическими свойствами. В ближайшие часы после механической или химической травмы на поверхности брюшины выпадает фибрин, что приводит к склеиванию соприкасающихся серозных поверхностей и отграничению воспалительного процесса. Брюшина и продуцируемая ею жидкость обладают и антимикробными свойствами.
Париетальная брюшина имеет соматическую иннервацию (ветви межреберных нервов). Этим объясняется ее чувствительность к любому виду воздействия, а возникающие при этом воздействии боли (соматические) четко локализованы. Висцеральная брюшина иннервируется вегетативными нервами (парасимпатическими и симпатическими) и не имеет соматической иннервации. Поэтому боли, возникающие при ее раздражении, не имеют четкой локализации и носят разлитой характер (висцеральные боли). Соматической иннервации лишена и тазовая брюшина. Этим объясняется отсутствие защитного напряжения мышц передней брюшной стенки (висцеромоторного рефлекса) при воспалительных изменениях тазовой брюшины.
В брюшной полости выделяют следующие
анатомические отделы: правое поддиафрагмальное пространство, левое поддиафрагмальное пространство, подпеченочное пространство, сальниковая сумка, правый латеральный канал, левый латеральный канал, правый брыжеечный синус, левый брыжеечный синус, правая подвздошная ямка, левая подвздошная ямка и полость малого таза.
Перитонит — это воспаление брюшины, которое представляет собой комплекс тяжелых патофизиологических реакций с нарушением
функций всех систем организма. Несмотря на современные достижения клинической медицины, использование новых переспективных технологий, совершенствование интенсивной терапии, антибиотиков, препаратов парентерального питания и иммуномодуляторов, средние показатели летальности в Российской Федерации сохраняются на уровне 20–30 %, а при послеоперационном перитоните достигают 40–50 %.
Причиной возникновения перитонита является попадание в свободную брюшную полость микрофлоры. Пути инфицирования брюшины следующие:
воспалительно измененные органы брюшной полости и забрюшинного пространства, просвет кишечника вследствие резкого повышения проницаемости стенок;
перфорация полых органов, проникающие ранения живота, осложнения операций на органах брюшной полости и малого таза;
гематогенный и лимфогенный пути при септических состояниях;
половые пути у женщин.
Классификация
Современная классификация перитонита сформулирована в рамках классифи-
кационно-диагностической схемы перитонита (В.С. Савельев, М.И. Филимонов, Б.Р. Гельфанд, 2000).
Этиологическая характеристика:
–первичный;
–вторичный;
–третичный.
Основное заболевание (нозологическая причина перитонита).
Распространенность:
–местный (отграниченный, неотграниченный);
–распространенный (разлитой).
Характер экссудата:
–серозно-фибринозный;
–фибринозно-гнойный;
–гнойный;
–каловый;
–желчный;
–геморрагический;
–химический.
462 |
ГЛАВА 24. Перитонит |
Фаза течения процесса:
–отсутствие сепсиса;
–сепсис;
–тяжелый сепсис;
–септический (инфекционно-токсиче- ский) шок.
Осложнения:
–внутрибрюшные;
–раневая инфекция;
–инфекция верхних и нижних дыхательных путей (трахеобронхит, нозокомиальная пневмония);
–ангиогенная инфекция;
–уроинфекция.
Основу классификации составляет выделение трех этиологических категорий: первичного, вторичного и третичного перитонита.
Первичный перитонит подразумевает, что источник инфицирования находится вне брюшной полости и инфекция распространяется гематогенным, лимфогенным путями либо через маточные трубы. Первичные перитониты встречаются достаточно редко, составляя приблизительно 1 % всех наблюдений. У детей он обычно вызывается гемолитическим стрептококком или пневмококком, чаще встречается у новорожденных, а затем — в возрасте 4–5 лет. Первичным очагом инфекции в этих случаях чаще бывает нефротический синдром при системной красной волчанке, гнойные заболевания уха или респираторного тракта. Первичный перитонит среди взрослых наиболее часто возникает при асците на фоне цирроза печени, у пациентов, находящихся на перитонеальном диализе по поводу хронической почечной недостаточности, у больных с диссеминацией туберкулезного процесса.
Вторичные перитониты обусловлены проникновением микрофлоры из воспалительно измененных органов или при перфорации полых органов брюшной полости (деструктивный аппендицит, деструктивные формы острого холецистита, прободная язва, острый деструктивный панкреатит, острая кишечная непроходимость, острый сальпингоофорит перфорация дивертикулов и опухолей ободочной кишки, мезентериальные тромбозы), при проникающих ранениях живота, в случаях несостоятельности швов анастомозов, наложен-
ных во время операций на органах брюшной полости.
Третичный перитонит объединяет те формы гнойного перитонита, которые развиваются и протекают без выраженных клинических проявлений на фоне продолжающегося лечения ослабленных больных с вторичным перитонитом и нередко с нарушениями иммуногенеза различной природы. Ранее такой перитонит обычно обозначался как вялотекущий или персистирующий.
По этиологическому фактору выделяют перитониты, вызванные различной микрофлорой пищеварительного тракта (кишечная палочка, стафилококки, стрептококки, энтерококки, протей, неклостридиальные анаэробы) и микрофлорой, не имеющей отношения к пищеварительному тракту (гонококки, микобактерии туберкулеза, пневмококки и т. п.). Кроме микробных перитонитов, выделяют перитониты, вызванные попаданием в брюшную полость агентов, обладающих агрессивным действием на брюшину (кровь, моча, желчь, панкреатический сок).
В момент инфицирования брюшной полости основную роль в развитии распространенного перитонита играет источник, из которого происходит контаминация брюшной полости. Перфорация желудка или двенадцатиперстной кишки при прободной язве в первый момент практически не контаминирует брюшную полость, а вызывает лишь химический ожог брюшины. Перфорация дивертикула ободочной кишки сразу же вызывает массивное обсеменение брюшной полости смешанной толстокишечной микрофлорой. Наличие воспалительного инфильтрата (например, периаппендикулярного) способствует отграничению источника инфицирования, а перфорация кишки на фоне кишечной непроходимости, напротив, сразу же вызывает обсеменение всей брюшной полости.
Но при дальнейшем развитии патологического процесса независимо от источника первичного инфицирования основную этиологическую роль в прогрессировании перитонита играет полимикробная аэробно-анаэробная эндогенная микрофлора, которая поступает в брюшную полость не только и не столько из пер-
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
463 |
вичного очага, а из ободочной кишки, потерявшей свой биологический герметизм в условиях перитонита. При паралитической кишечной непроходимости стенка кишки становится проницаемой для бактериальной флоры кишечника, а сама кишка — дополнительным источником и причиной прогрессирования перитонита.
Наиболее часто из брюшной полости высеивают микробные ассоциации с преобладанием анаэробной неклостридиальной инфекции. Наиболее частыми возбудителями перитонита являются: аэробы (кишечная палочка, стафилококк, стрептококк, клебсиелла, протей и синегнойная палочка), анаэробы (бактероиды, анаэробные кокки, клостридии и фузобактерии), грибковые возбудители (кандида).
По распространенности процесса различают следующие перитониты.
1.Местный перитонит:
отграниченный (абсцесс, инфильтрат);
неотграниченный.
2.Распространенный перитонит ранее разделяли на диффузный (выходит за пределы зоны воспаления и охватывает рядом расположенные зоны) и разлитой (охватывает значительную или всю зону брюшной полости), в настоящее время это разделение считают нецелесообразным с точки зрения
лечебной тактики и прогноза.
Если воспалительный процесс не имеет тенденции к распространению на другие отделы брюшной полости, от которых очаг воспаления отграничивается спайками, фиброзной капсулой, петлями кишечника или большим сальником, то формируется абсцесс. Наиболее часто встречаются аппендикулярные, поддиафрагмальные, подпеченочные, тазовые абсцессы, абсцессы сальниковой сумки.
По стадии течения процесса до последнего времени выделяли реактивную, токсическую и терминальную стадии перитонита.
Реактивная стадия (первые 6–8 ч) характеризуется выраженным болевым синдромом, слабовыраженным парезом кишечника, температурной реакцией соответственно объему деструкции в брюшной полости, высоким лейкоцитозом (в среднем 12 × 109 в 1 л).
Токсическая стадия (8–24 ч) — это период, который можно охарактеризовать как ста-
дию мнимого благополучия, когда несколько стихают острота и интенсивность болевого синдрома; нарастают признаки интоксикации, проявляющиеся бледностью кожных покровов, эйфорией, тахикардией свыше 100 ударов
вминуту, стабильно высокой температурой, нарастающим парезом кишечника (перистальтические волны характеризуются резким резонансом); остается высокий лейкоцитоз (в среднем 15,6 × 109 в 1 л).
Терминальная стадия (24–96 ч) — это стадия прогрессирующей полиорганной недостаточности, которая проявляется нестабильностью гемодинамики, появлением дыхательной недостаточности, олигурией, стойким парезом кишечника, элементами нарушения сознания. Ее условно делят на стадии компенсации (48– 72 ч) и декомпенсации (72–96 ч), когда клинические проявления прогрессируют до острой сердечно-сосудистой и дыхательной недостаточности, анурии, комы.
Естественно, что выделение этих стадий несколько условно в тех случаях, когда они рассматриваются изолированно от других критериев классификации гнойного перитонита. Клиническая практика убеждает, что даже при ограниченном перитоните могут развиться поздние стадии токсикоза и органной недостаточности.
Новая классификация была сформулирована после введения в клиническую практику обновленного понятия об абдоминальном сепсисе, клиническая классификация которого была принята на согласительной конференции
вЧикаго в 1991 г.
Конференция утвердила четыре согласованных признака синдрома системной воспалительной реакции (ССВР): температура тела (более 38 или менее 36 С; частота сердечных сокращений более 90 ударов в минуту; частота дыхания более 20 в минуту; число лейкоцитов более 12 тыс. кл/мм3 илименее 4000 кл/мм3).
Наличие более двух из четырех признаков ССВР при установленном диагнозе инфекци- онно-деструктивного процесса предлагалось расценивать как комплексный признак сепсиса. Дополнение этого комплекса синдромом полиорганной недостаточности (ПОН) определялось как тяжелый сепсис, а проявление неуправляемой артериальной гипотонии ниже
464 |
ГЛАВА 24. Перитонит |
90 мм рт. ст. оценивалось как признак терминальной фазы сепсиса, выражающейся в ин- фекционно-токсическом шоке.
Поскольку распространенный гнойный перитонит служит несомненным свидетельством прогрессирующего инфекционно-деструк- тивного процесса, распознавание трех или четырех признаков ССВР и проявление ПОН должно расцениваться как тяжелый перитонеальный сепсис (разновидность абдоминального сепсиса) со всеми вытекающими из такого суждения обстоятельствами, а развитие ин- фекционно-токсического шока характеризует переход процесса в терминальную фазу.
Таким образом, взамен градации распространенного перитонита по тяжести в зависимости от фазы его патогенеза (реактивной, токсической или терминальной) в последние годы утверждается иная градация по фазам:
перитонит с отсутствием признаков сепсиса;
перитонеальный сепсис;
тяжелый перитонеальный сепсис;
инфекционно-токсический шок. Выделение абдоминального сепсиса отра-
жает отличительные особенности его развития, диагностики и лечения. Эти особенности определяются несколькими обстоятельствами:
наличием, как правило, многофокусных и недостаточно отграниченных очагов воспалительной деструкции, которые создают трудности одномоментной санации;
длительным существованием синхронных и метахронных инфекционно-воспалитель- ных очагов, средства для дренирования или искусственного отграничения которых (катетеры, дренажи, тампоны) служат источниками потенциального эндогенного и экзогенного реинфицирования;
сложностью дифференциальной диагностики абактериальных (реактивных) форм воспаления (стерильного панкреатогенного перитонита,дисбактериоза, системныхзаболеваний, лекарственной болезни) и прогрессированием инфекционно-воспалительной деструкции по мере развертывания клинической картины абдоминального сепсиса;
быстрым развитием фатальных проявлений сепсиса: системной полиорганной дисфункции и септического шока.
Патогенез перитонита
Рассматривая распространенный перитонит как абдоминальный сепсис, следует вначале коснуться современных представлений о воспалении как о ключевом общепатологическом и одновременно адаптационно-при- способительном процессе, обусловленном реакцией защитных механизмов организма на местное повреждение. Именно на местном уровне, т. е. в очаге воспаления, проявляются его атрибуты: гиперемия, локальное повышение температуры, отек, боль, нарушение функции поврежденного органа. Все эти реакции являются иммуноопосредованными. Цитокиновая регуляторная сеть и иммунокомпетентные клетки создают каскады про- и противовоспалительных реакций, стимулируют и тормозят приток в очаг воспаления фагоцитов, усиливают или, наоборот, угнетают проницаемость капиллярного русла — все это позволяет в условиях адекватного ответа устранить источник воспаления, а затем за счет активации противовоспалительных механизмов заместить утраченные структуры элементами соединительной ткани.
Если воспалительный процесс приводит к системным адаптационным изменениям (накоплению провоспалительных цитокинов в крови и реализации их биологических эффектов в системном кровотоке), то появляется ССВР, в результате возникает целый ряд патологических изменений:
нарастающая цитокинемия на фоне неуправляемой активации тромбоцитов и сосудистых макрофагов;
внутрисосудистая активация системы комплемента и нейтрофилов с последующим развитием патологического аутофагоцитоза;
коагулопатия по типу ДВС-синдрома;
оксидантный взрыв (активация микросомального окисления в эндотелиоцитах, сосудистых макрофагах, внутрисосудистых лейкоцитах);
генерализованная активация и дегрануляция тучных клеток.
Эти процессы взаимосвязаны, они вызыва-
ют вторичную системную альтерацию, возникают:
ацидоз и гиповолемия;
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
465 |
вторичный эндотоксикоз из-за поступления липополисахаридов из кишечника (транслокация условно-патогенной анаэробной микрофлоры);
аутотоксикоз: отравление регуляторными факторами, краш-подобный синдром (отравление продуктами тканевой дегидратации);
метаболический стресс-синдром. Усугубление этих процессов приводит к
полной разбалансировке регуляторных механизмов на клеточном и системном уровнях, прогрессируют процессы клеточного некроза, истощаются резервы системы комплемента и гемостаза. На фоне неуправляемого «оксидантного взрыва» сосудистый тонус уменьшается, а сосудистая проницаемость усиливается вплоть до развития сосудистого шока. Финалом является развитие полиорганной недостаточности.
Прогрессирующий паралич иммунокомпетентной системы при сепсисе развивается на фоне генерализованной диссеминации условно-патогенной микрофлоры, реализуется «бунт» ничем не сдерживаемых ми- кробов-комменсалов, которые становятся агрессивными и способными вызывать генерализованную форму инфекции. При абдоминальном сепсисе особое значение приобретает уже упоминавшаяся транслокация анаэробной микрофлоры из толстой кишки.
Первоначальная реакция при развитии перитонита связана с возникновением очага инфекции в брюшной полости, раздражением огромного рецепторного поля брюшины агрессивным содержимым желудка и кишечника, желчью, бактериальными экзо- и эндотоксинами, распространением воспалительного процесса с пораженных органов по брюшине. Она наиболее четко выражена при внезапном инфицировании брюшной полости (перфорация полого органа, проникающее ранение и т. п.). Эта реакция организма складывается из преимущественно рефлекторного неспецифического ответа организма на указанные стрессорные воздействия, активации системы «гипофиз — кора надпочечников», мобилизации местных и общих механизмов защиты.
Попадание на брюшину микроорганизмов вызывает воспалительную реакцию с типичны-
ми признаками: отек, гиперемия, повышенная проницаемость капилляров, экссудация. Вначале экссудат имеет серозный характер, но по мере накопления в нем бактерий, лейкоцитов и фибрина становится гнойным.
К местным проявлениям защитной реакции организма относят отек и инфильтрацию близлежащих тканей (большого сальника, кишки и ее брыжейки). Выпадение фибрина способствует склеиванию тканей вокруг очага инфекции и его отграничению. К общим проявлениям относят неспецифическую реакцию гипоталамо-гипофизарно-адреналовой системы в ответ на воздействие факторов, вызвавших перитонит.
Часть микробов, попавших в брюшную полость, быстро абсорбируется через лимфатические пути, особенно через лимфатические пути брюшины, покрывающей диафрагму и полость малого таза. Дыхательные движения диафрагмы способствуют удалению микробов по лимфатическим путям. Значительная часть микробов фагоцитируется макрофагами, находящимися в свободной жидкости брюшной полости. Хотя количество этой жидкости в норме невелико, но в каждом ее миллилитре содержится до 3000 клеток лимфоцитов (50 %) и макрофагов (40 %). В процессе фагоцитоза участвуют макрофаги брюшины и сальника. Вслед за этим включаются механизмы естественной иммунологической защиты организма. Ключевую роль играют активация макрофагов и комплемента бактериальными эндотоксинами, секреция макрофагами интерлейкинов и фактора некроза опухоли α.
Важную роль в защите брюшной полости от вторжения инфекции имеет появление фибрина. Он способен захватывать бактерии, вызывать слипание сальника и окружающих источник инфекции органов и таким образом локализовать инфекционный очаг. Вместе с тем имеются сведения, что фибрин снижает фагоцитарную активность лейкоцитов, препятствует их проникновению в сгусток фибрина, содержащий бактерии. Следовательно, первая линия защиты брюшины от инфекции включает элиминацию бактерий через лимфатические пути, фагоцитоз и уничтожение их клетками ретикулоэндотелиальной системы, клеточные
466 |
ГЛАВА 24. Перитонит |
механизмы брюшины и перитонеальной жидкости (макрофаги), гуморальные естественные антитела стенки кишки.
Если местные и системные механизмы защиты организма не были в состоянии локализовать воспалительный процесс, то микробная агрессия нарастает, воспаление прогрессирует, распространяется по брюшине, развивается диффузный, распространенный перитонит. Благоприятные условия для возникновения распространенного гнойного перитонита создаются при высокой вирулентности инфекционного начала, неадекватной защитной реакции организма или неадекватном лечении на ранней стадии болезни. Вирулентность микробов резко усиливается при наличии в брюшной полости слизи, гемоглобина, инородных частиц.
Абсолютное большинство патофизиологических механизмов развития диффузного перитонита связано с липополисахаридными эндотоксинами, оказывающими свое действие посредством медиаторов клеточного и гуморального происхождения. Активация комплемента эндотоксином приводит к образованию анафилотоксина (С-3 и С-5), который вызывает вазодилатацию, сокращение гладкой мускулатуры, усиливает хемотаксис мононуклеаров и полиморфноядерных лейкоцитов, оказывает модулирующее влияние на иммунную систему и иммунный ответ. Эндотоксины активируют метаболизм арахидоновой кислоты посредством циклооксигеназы, что приводит к образованию простагландинов и лейкотринов. Макрофаги являются первичным звеном образования простагландинов и лейкотринов. Продукты метаболизма арахидоновой кислоты необходимы для синтеза макрофагами интерлейкинов и эффективного функционирования самих макрофагов, их фагоцитарной активности.
Другим медиатором эндотоксемии является фактор активации тромбоцитов, вырабатываемый нейтрофилами, макрофагами, тромбоцитами и клетками эндотелия. Этот фактор вызывает агрегацию тромбоцитов, дегрануляцию нейтрофилов, усиление проницаемости стенок сосудов, гипотензию и смерть. Внутрисосудистое свертывание крови и другие
нарушения гемокоагуляции, наблюдаемые при эндотоксемии, реализуются через фактор XII и тканевой фактор.
Макрофаги при воздействии на них эндотоксинов вырабатывают интерлейкин-1, играющий важную роль в естественных механизмах защиты организма от инфекции. Интерлей- кин-1 активирует лимфоциты, усиливает адгезивные свойства клеток эндотелия и диссеминированное внутрисосудистое свертывание крови, способствует выработке простагландинов, лейкотринов и фактора активации тромбоцитов. В классическом варианте эта реакция начинается с повышения температуры тела. Другой интерлейкин, вырабатываемый макрофагами в ответ на воздействие эндотоксинов, — фактор некроза опухоли α (ФНО-α), представляющий собой пептидный гормон, являющийся основным медиатором эндотоксинового шока, сопровождающегося выраженной гипотензией и полиорганной недостаточностью (нарушением функции почек и легких). Биологический эффект ФНО-α похож на эффект интерлейкина-1. Он также является медиатором процесса воспаления и катаболизма белков, стимулирует секрецию лимфокинов и коллагеназы, активирует фагоциты и эндотелиальные клетки, уничтожает клетки опухоли. В зависимости от его генетической разновидности можно выделить пациентов, предрасположенных к развитию гиперэргической воспалительной реакции, а значит, к развитию тяжелого сепсиса.
Макрофаги и В-лимфоциты под влиянием эндотоксинов грамотрицательных микроорганизмов продуцируют ростовые факторы, регулирующие пролиферацию и дифференциацию клеток костного мозга, усиливающие лейкоцитоз, фагоцитарную активность лейкоцитов, секрецию простагландинов, протеаз, осуществляют цитолиз.
Интерферон является лимфокином, усиливающим окислительные процессы в макрофагах и их фагоцитарную активность. Его синтез не связан непосредственно с действием эндотоксина, а с каскадом процессов, в который вовлечены интерлейкин-1 и макрофаги.
Эндорфины также вовлечены в процесс развития гипотензии и патогенез септического
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
467 |
шока. Вероятно, их активность также модулируется эндотоксинами.
Таким образом, лихорадка, лейкоцитоз, нарушение кровообращения, внутрисосудистое свертывание крови и грубые нарушения микроциркуляции, сопровождающиеся гипоксией, ацидозом, полиорганной недостаточностью, дегидратацией организма, и другие патофизиологические механизмы, участвующие в процессе развития перитонита, так или иначе связаны с действием медиаторов эндотоксикоза на различные системы организма.
Изменения гемодинамики в самом начале развития перитонита характерны для реакции организма на стрессорное воздействие: наблюдаются учащение пульса, повышение артериального давления, увеличение ударного и минутного объемов сердечного выброса. В терминальной стадии перитонита на первый план выдвигаются снижение объема циркулирующей крови. Вследствие потерь жидкости со рвотой, отеком брюшины, экссудацией в брюшную полость, депонированием в просвет кишечника за счет паралитической кишечной непроходимости возникает гиповолемия, и гипертензия сменяется гипотензией, снижением венозного возврата, нарастанием тахикардии и глубокими изменениями в сердечно-сосу- дистой системе. Имеет значение снижение сократительной активности миокарда под воздействием токсического специфического белкового вещества, известного как фактор угнетения миокарда и интерлейкинов.
Важное значение в механизме нарушения кровообращения имеют липополисахариды, высвобождающиеся в процессе гибели грамотрицательных микробов, превалирующих среди возбудителей перитонита. Они способствуют синтезу серотонина, гистамина, простангландинов, превращению кининогенов в кинины. Эти вещества обладают высокой вазоактивностью. Они вызывают дилатацию сосудов микроциркуляторного русла, повышение проницаемости их стенок, перемещение жидкости в интерстициальное пространство (отек), уменьшение объема циркулирующей крови, гипотензию, тканевую гипоксию, дистрофические изменения в клетках внутренних органов. Вследствие спазма печеночных вен возникает депонирова-
ние крови в сосудах кишечника, печени, селезенки. Это уменьшает венозный возврат к правым отделам сердца, что приводит к снижению сердечного выброса и объема циркулирующей крови, падению артериального давления, нарушению кровоснабжения внутренних органов и гипоксии. В терминальной стадии перитонита нередко развивается эндотоксиновый (септический) шок, который сопровождается открытием артериовенозных шунтов, уменьшением периферического сопротивления, снижением потребления кислорода тканями, расширением капилляров, повышением их проницаемости, переполнением кровью сосудов кишечника, депонированием ее в системе воротной вены. Нарушения микроциркуляции обусловлены также развитием ДВС-синдрома.
Изменения в системе органов дыхания развиваются в основном на поздних стадиях перитонита и связаны с изменением гемодинамики (гиповолемией, нарушением перфузии легких и микроциркуляции в легочной ткани), выраженными метаболическими расстройствами, тканевой гипоксией, открытием артериовенозных шунтов, развитием интерстициального отека легких (шоковое легкое, или респираторный дистресс-синдром взрослых).
Нарушения функции печени можно выявить уже на ранних стадиях перитонита. Они развиваются в результате гиповолемии и гипоксии ее паренхимы. Усугубление микроциркуляторных нарушений приводит к усилению гипоксии, дистрофическим изменениям и в финале — к печеночной недостаточности.
Нарушения функции почек развиваются вследствие спазма сосудов и ишемии коркового слоя, возникающих в реактивной стадии перитонита как следствие общей реакции организма на стрессорные воздействия. Дальнейшее ухудшение происходит за счет гиповолемии, эндотоксемии, гипотонии, нарушения микроциркуляции, шунтирования крови через артериовенозные анастомозы, внутрисосудистого свертывания крови. В результате снижается диурез, нарастает азотемия, развивается острая почечная или почечно-печеночная недостаточность.
Этот процесс усугубляется под влиянием катехоламинов, усиливающих катаболические
468 |
ГЛАВА 24. Перитонит |
процессы в клетках этих органов, что сопровождается гликогенолизом жирных кислот, истощением энергопродукции, снижением уровня аденозинтрифосфата. Жирные кислоты активируют свертывающую систему крови, углубляют свойственную всякому воспалению гиперкоагуляцию, способствуют развитию ДВС-синдрома, внутриклеточного ацидоза и полиорганной недостаточности.
Нарушение моторной активности пищеварительного тракта происходит уже в самом начале развития перитонита. Атония кишечника, возникающая как реакция на воспалительный процесс в брюшной полости, носит рефлекторный характер, развивается вследствие симпатикотонического угнетения моторики кишечника посредством коротких спинномозговых и сложных кортиковисцеральных рефлексов. В связи с этим блокируются двигательные импульсы к мышечной оболочке кишки. Атония создает предпосылки для растяжения кишки газом и жидким содержимым, повышения давления в ней. Сдавливаются тонкостенные вены в стенке кишки, затрудняется отток венозной крови, усиливается отек кишечной стенки, ухудшается микроциркуляция в ней, что углубляет атонию, потерю воды, электролитов и белка. В результате воздействия токсинов на нервно-мышечный аппарат кишки, нарушения кровообращения в ее стенке, расстройств метаболизма в мышечных волокнах и нервных клетках кишки наступает стойкий парез пищеварительного тракта — паралитическая кишечная непроходимость. Следствием этого является депонирование большого объема жидкости в просвете кишки и в ее отечных стенках. Развиваются выраженные нарушения водно-электролитного обмена и кислотно-ос- новного состояния. Стенка кишки становится проницаемой для микробов, которые в большом количестве попадают в кровоток по лимфатическим путям и в свободную брюшную полость.
Таким образом, атония кишечника обусловлена симпатикотоническим угнетением мышечного тонуса и перистальтики кишки, токсическим воздействием на нервно-мышечный аппарат кишечника медиаторов воспаления, нарушением кровообращения в стенке кишки,
дезорганизацией метаболических процессов в мышечных волокнах. При выраженной паралитической непроходимости в связи с транслокацией микробов и токсинов кишка становится источником инфекции и интоксикации.
Распространенный гнойный перитонит в такой же мере, как тяжелая гнойная интоксикация другого происхождения, сопровождается выраженным иммунодефицитом, затрагивающим преимущественно естественный, неспецифический иммунитет.
С точки зрения клинической картины заслуживают большого внимания нарушения белкового, водно-электролитного баланса и кислотно-основного состояния. Как всякое тяжелое нагноительное заболевание, перитонит сопровождается резким усилением катаболизма белков, повышением энергетической потребности организма. Содержание белка резко снижается вследствие потери его с экссудатом, мочой, рвотными массами, а также
снедостаточным поступлением в организм. Потери белка могут достигать 50–200 г/сут. Гипопротеинемия более выражена при тяжелом распространенном перитоните. Наряду с гипопротеинемией у пациентов наблюдается диспротеинемия — уменьшение альбуминов и увеличение глобулинов преимущественно за счет γ- и α-глобулинов. Нарушения белкового обмена сопровождаются дефицитом азотистого баланса, достигающим 10,2–13,5 г/сут.
Электролитные нарушения при перитоните вытекают из механизма общей реакции организма на стрессорные воздействия. В связи
сусилением выделения калия с мочой, пóтом и рвотными массами и выходом его из внутриклеточного пространства у ряда больных может наблюдаться гипокалиемия, требующая коррекции. По мере прогрессирования перитонита, угнетения выделительной функции почек, дезорганизации метаболизма клеток и их гибели содержание калия в плазме возрастает, гипокалиемия может смениться гиперкалиемией. Несмотря на резорбцию калия в канальцах почек, свойственную всякой хирургической агрессии, в том числе перитониту, выраженной гипернатриемии не наблюдается, т. к. значительная часть натрия перемещается внутрь клеток, вытесняя оттуда калий. Неко-
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
469 |
торая его часть депонируется вместе с отечной жидкостью в интерстициальном пространстве.
Кислотно-основное состояние у больных перитонитом подвержено значительным колебаниям. В тканях, как правило, наблюдается ацидоз, обусловленный нарушением кровообращения, гипоксией и дезорганизацией метаболизма клеток. В ответ организм включает компенсаторные буферные системы и механизмы, призванные нейтрализовать возможный сдвиг крови в сторону ацидоза. Одной из первых включается дыхательная система. В ответ на гипоксию в интересах поддержания насыщения крови кислородом возникают тахипноэ, гипервентиляция, снижение рO2, дыхательный алкалоз.
В токсической стадии перитонита, пока выделительная функция почек не нарушена, в крови может быть сдвиг кислотно-основного состояния как в сторону алкалоза (у 2/3 больных), так и в сторону ацидоза. В терминальной стадии перитонита по мере развития олигурии или даже анурии, когда функция почек резко нарушается, в крови начинают накапливаться кислые продукты обмена, K+, Р+, Mg+, азотистые шлаки. Это сопровождается гиперкалиемией и сдвигом кислотно-основного состояния в сторону метаболического и дыхательного ацидоза. Таким образом, ацидоз внутриклеточный дополняется ацидозом внеклеточным. В связи с проводимыми лечебными мероприятиями и мобилизацией компенсаторных механизмов в терминальной стадии перитонита может наблюдаться как ацидоз, так и алкалоз. Когда предпринимаются активные лечебные воздействия, колебания кислотно-основного состояния менее значительны. Однако надо помнить, что нормальное кислотно-основное состояние быстро может смещаться как в сторону ацидоза, так и в сторону алкалоза.
Сепсис и септический шок, развивающиеся в терминальной стадии, приводят, как было показано выше, к сложной, системной реакции организма, координируемой нейроэндокринной системой. Фактор некроза опухоли α и интерлейкины участвуют в активации гипота- ламо-гипофизарной системы, в ответ на боль, гипоксию, гипотензию возрастает активность симпатоадреналовой системы. Содержание адреналина, норадреналина, антидиуретиче-
ского гормона, альдостерона в плазме крови быстро нарастает. Активация гипоталамо-ги- пофизарной системы сопровождается повышением содержания в крови гормона роста и пролактина. Одновременно с этим увеличивается содержание эндорфинов и энкефалинов. В ответ на гиповолемию и гипотензию усиливается секреция антидиуретического гормона и альдостерона, активизируется ренин-анги- отензиновая система, возрастает содержание глюкагона. При септическом процессе у пациентов отмечается как понижение, так и повышение уровня инсулина. Гипергликемия, нередко наблюдаемая у больных, может быть связана с повышением резистентности к нему.
Таким образом, начавшись как локальное поражение, перитонит довольно быстро вызывает опасные для жизни изменения, постепенно становящиеся необратимыми. Указанные в классификации осложнения перитонита, в первую очередь экстраабдоминальные [инфекция верхних и нижних дыхательных путей (трахеобронхит, нозокомиальная пневмония), ангиогенная инфекция, уроинфекция], непосредственно связаны с развитием септического состояния.
Клиническая картина
и диагностика перитонита
Объективизировать и унифицировать оценку общего состояния больного перитонитом — чрезвычайно важная задача. Определение состояния больного как «средней тяжести», «тяжелое», «крайне тяжелое» страдает
взначительной степени субъективизмом. Балльные оценки, основанные на объективных данных клинического, лабораторного, функционального обследования больного, лишены субъективного подхода. Клинико-лаборатор- ные параметры оценивают балльные системы APACHE II, APACHE III, APS, SAPS и др.
Для оценки тяжести состояния больного перитонитом в наибольшей степени удовлетворяет система SAPS (Simplifi ed Acute Physiology Score). Она учитывает балльную оценку отклонений каждого из параметров от нормальных величин как в сторону увеличения, так и в сторону уменьшения. Применяют 14 показателей,
втом числе шкалу Глазго — баллы оценки со-
470 |
ГЛАВА 24. Перитонит |
стояния ЦНС при различных вариантах нарушения мозгового кровообращения, отравлениях, эндогенных интоксикациях. Пациенты, у которых показатель выше 9 баллов, имеют больше шансов на выздоровление.
По общей сумме баллов по таблице SAPS определяют прогноз вероятности летального исхода. Ее можно использовать не только для оценки исходного состояния больного, но и для динамического наблюдения за эффективностью проводимого лечения.
Мангеймский индекс перитонита (МИП) был разработан специально для прогнозирования и исхода гнойного перитонита. Он состоит из 8 факторов риска и предусматривает три степени тяжести перитонита. При индексе менее 20 баллов (первая степень тяжести) летальность составляет 0 %, от 20 до 30 баллов (вторая степень тяжести) — 29 %, более 30 баллов (третья степень тяжести) — 100 %. По прошествии значительного времени МИП получил международное признание как надежная шкала при перитоните. Однако высказываются пожелания дальнейшего повышения его
прогностического эффекта.
Клиническая картина. Клинические проявления перитонита многообразны и изменяются в зависимости от стадии, причины его развития, распространенности, реактивности больного и т. д., но имеют много общих черт.
На реактивной стадии перитонита больные жалуются на интенсивную боль в животе постоянного характера, усиливающуюся при перемене положения тела. Локализация боли зависит от расположения первичного воспалительного очага и связана с раздражением огромного рецепторного поля брюшины. Для уменьшения болей пациенты стараются лежать, избегая лишних движений. Рвота большим количеством застойного желудочного содержимого не приносит облегчения и обусловлена переполнением желудка вследствие угнетения моторной активности пищеварительного тракта (динамическая кишечная непроходимость). Наблюдается задержка стула и
отхождения газов.
Диагностика. При осмотре отмечают сухость слизистых оболочек, что связано с нарастающей дегидратацией. Определяют та-
хикардию до 100–120 ударов в минуту, при этом артериальное давление может быть нормальным, а при перфорации полого органа или мезентериальном тромбозе — пониженным. При исследовании живота выявляется ограничение подвижности брюшной стенки при дыхании, более выраженное в зоне проекции воспалительного очага. При перкуссии там же определяются зона болезненности, высокий тимпанит за счет пареза кишечника, а при скоплении значительного количества экссудата — притупление в отлогих местах живота.
При поверхностной пальпации живота выявляется защитное напряжение мышц передней брюшной стенки соответственно зоне воспалительно измененной париетальной брюшины. Мышечная защита наиболее выражена при перфорации полого органа («доскообразный живот»). Напряжение мышц может отсутствовать при локализации воспалительного процесса в малом тазу, при воспалении задней париетальной брюшины и у пациентов с резко сниженным тонусом мускулатуры, например у недавно родивших женщин, стариков, а также у лиц, находящихся в состоянии алкогольного опьянения. В диагностике перитонита ценным оказывается пальцевое исследование прямой кишки, при котором удается определить болезненность и нависание ее передней стенки за счет скопления экссудата. У женщин при вагинальном исследовании можно обнаружить нависание сводов влагалища, болезненность при смещении шейки матки. Для выявления признаков воспаления задней париетальной брюшины необходимо определить тонус мышц задней брюшной стенки. Для этого врач помещает ладони в поясничной области больного в положении его на спине и легким давлением сравнивает тонус мышц справа и слева.
При глубокой пальпации передней брюшной стенки можно определить воспалительный инфильтрат, опухоль, увеличенный орган (желчный пузырь), инвагинат и т. д. Характерным симптомом перитонита является симптом Щеткина—Блюмберга, механизм которого связан с висцеромоторным рефлексом в момент сотрясения стенки живота.
При аускультации живота определяют ослабление перистальтических шумов, на поздних
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
471 |
стадиях перитонита кишечные шумы не выслушиваются (симптом «мертвой тишины»).
При прогрессировании перитонита интенсивность болей в животе несколько уменьшается, но утяжеляется интоксикация. Пульс учащается (свыше 120 ударов в минуту), снижается артериальное давление. Нередко сохраняется высокая гипертермия (свыше 38 С), нарастает одышка; черты лица заострены, язык и внутренние поверхности слизистой оболочки сухие (как щетка). Живот резко вздут вследствие пареза кишечника. Из-за истощения висцеромоторных рефлексов защитное напряжение мышц ослабевает, кишечные шумы не выслушиваются. Становится менее выраженным симптом Щеткина—Блюмберга.
В терминальной стадии перитонита развиваются симптомы поражения ЦНС — адинамия,сменяющаясяэйфориейипсихомоторным возбуждением, спутанность сознания и бред. Бледность кожных покровов сопровождается акроцианозом, черты лица заостряются, западают глазные яблоки (facies hippocratica), развиваются резкая тахикардия и гипотензия. Вследствие дыхательной недостаточности дыхание становится частым и поверхностным. Отмечается рвота большим количеством содержимого с каловым запахом. Живот резко вздут, перистальтика отсутствует. Появляется разлитая болезненность по всему животу.
Лабораторные методы диагностики. В общем анализе крови выявляют лейкоцитоз свыше 16–18 × 109 в 1 л, нейтрофилез, сдвиг лейкоцитарной формулы влево, увеличение СОЭ. В терминальной стадии высокий лейкоцитоз может сменяться лейкопенией вследствие истощения защитных сил организма, наблюдается возрастание мочевины, креатинина. При специальных исследованиях выявляется снижение ОЦК, белка, нарушения водно-электролитного баланса и кис- лотно-основного состояния — гипокалиемия и алкалоз, а при снижении диуреза — гиперкалиемия и ацидоз. Нарушения водно-электролитного баланса и кислотно-основного состояния достигают максимума в терминальной стадии. На ЭКГ выявляются признаки, характерные для токсического поражения миокарда и электролитных расстройств. При исследовании коагулограммы отмечают признаки ДВС-синдрома.
Основные трудности лабороторной диагности абдоминального сепсиса связаны с неспецифичностью критериев системной воспалительной реакции. Сходная клиническая картина нередко наблюдается у пациентов с деструктивным панкреатитом, тяжелой травмой, ожогами, лекарственной реакцией, после обширных операций, при тяжелой сердечной недостаточности. Для дифференциальной диагностики применяют прокальцитониновый тест. У здоровых людей гормон кальцитонин секретируется С-клетками щитовидной железы после внутриклеточного расщепления прогормона. Концентрация прокальцитонина в крови ничтожно мала (менее 0,1 нг/мл). Однако при системном воспалении, индуцированном бактериями, она повышается до 1000 нг/мл без увеличения уровня кальцитонина. При тяжелых инфекциях с системным воспалительным ответом прокальцитонин начинают секретировать иммунокомпетентные мононуклеары (макрофаги, гранулоциты, Т- и В-лимфоциты, моноциты) легких, печени, кишечника под влиянием провоспалительных цитокинов (ИЛ-1, ИЛ-2, ИЛ-6, ФНО-α) и липополисахиридов клеточной стенки грамотрицательных бактерий. При вирусных инфекциях, неопластических и аутоимунных процессах, хронических воспалительных процессах, «медленных» инфекциях (туберкулез), аллергических реакциях этого не происходит. Тяжелая механическая, в том числе операционная, травма, обширный асептический тканевой некроз, сопровождающиеся увеличением уровня провоспалительных цитокинов и формированием синдрома системного воспаления, приводят к умеренному повышению уровня прокальцитонина на непродолжительное время, в этом случае прогрессивное увеличение его концентрации будет свидетельствовать о присоединении бактериального сепсиса.
Рентгенологическое исследование при подозрении на перитонит является обязательным. При обзорной рентгенографии выявляют скопление газа под правым куполом диафрагмы (при перфорации полого органа), ограничение ее подвижности (при локализации патологического процесса в верхнем этаже брюшной полости) и высокое стояние купола диафрагмы на стороне поражения, сочувственный плеврит в
472 |
ГЛАВА 24. Перитонит |
виде скопления жидкости в костодиафрагмальном синусе, дисковидные ателектазы в нижней доле легкого. Можно увидеть паретичную, раздутую газом петлю кишки, прилежащую к очагу воспаления, а в поздних стадиях перитонита — уровни жидкости с газом в петлях как тонкой, так и толстой кишки (чаши Клойбера), характерные для паралитической непроходимости кишечника. При невозможности выполнения рентгенологических снимков стоя пациента обследуют в латеропозиции (лежа на левом боку). При этом свободный газ ищут между печенью и передней брюшной стенкой, также оценивают наличие тонко- и толстокишечных уровней жидкости.
Ультразвуковое исследование также позволяет определить скопление экссудата в том или ином отделе брюшной полости, увидеть раздутые петли кишок, иногда — определить источник перитонита (конкременты в желчном пузыре, деструктивный панкреатит и др.). При распространенных перитонитах жидкость определяется во всех отделах брюшной полости: латеральных каналах, полости малого таза, между петлями кишок, иногда — в поддиафрагмальном пространстве. В случае выраженного пневматоза кишечника, затрудняющего исследование, диагностическим признаком может являться скопление жидкости между нижней поверхностью правой доли печени и верхним полюсом почки (в так называемой сумке Моррисона) или за мочевым пузырем.
Другим методом обнаружения свободной жидкости и газа в брюшной полости может являться компьютерная томография. Она позволяет выявить воспалительный инфильтрат и вероятный источник перитонита, несмотря на парез петель кишечника, который существенно затрудняет УЗ-диагностику.
Лечение перитонита
Распространенный гнойный перитонит является абсолютным показанием к экстренному оперативному вмешательству. Своевременная диагностика ранних форм перитонита и адекватная операция определяют успех лечения. Основные принципы лечения перитонита заключаются в следующем:
предоперационное устранение грубых нарушений функций жизненно важных органов и систем. Характер предоперационной подготовки больных в значительной степени зависит от распространенности, стадии перитонита и степени интоксикационного синдрома. Задачи предоперационной подготовки могут быть охарактеризованы как период интенсивной борьбы с интоксикационным синдромом, шоком, выведение больных из критического состояния. В процессе этого необходимо целенаправленно ликвидировать или уменьшить гиповолемию, нарушение вязкости крови, а соответственно,
инарушение микроциркуляции в органах
итканях за короткий период (2–3 ч). Минимальными критериями, позволяющими приступить к оперативному вмешательству у больных с распространенным гнойным перитонитом, считаются следующие: АД не ниже 100 мм рт. ст., пульс менее 120 ударов в минуту, диурез не менее 30 мл/ч;
оперативное вмешательство с удалением источника перитонита и тщательной санацией и дренированием брюшной полости;
массивная общая и местная антибактериальная терапия;
ликвидация паралитической кишечной непроходимости (аспирация желудочного и кишечного содержимого, стимуляция деятельности кишечника);
поддержание на оптимальном уровне функционального состояния жизненно важных органов и систем организма (сердечно-со- судистой системы, легких, печени, почек);
проведение послеоперационной интенсивной терапии для предотвращения возможных расстройств и восстановления наруше-
ний гомеостаза.
Хирургическое лечение перитонита предусматривает:
1)ликвидацию источника перитонита;
2)уменьшение степени бактериальной обсемененности брюшной полости путем удаления экссудата и промывания;
3)лечение резидуальной инфекции и профилактику повторного заражения.
Вкачестве операционного доступа используют срединную лапаротомию независимо от
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
473 |
источника перитонита. Срединная лапаротомия позволяет тщательно осмотреть все отделы брюшной полости осуществить вмешательство на органе, изменения в котором вызвали развитие перитонита, надежно аспирировать экссудат из всех карманов и щелей, осуществить корректное промывание и дренирование. При санации брюшной полости последовательно выполняют следующие этапы.
1.Ревизия и интраоперационная оценка патологических изменений органов брюшной полости.
2.Устранение источника перитонита с учетом конкретных условий. Если источником перитонита служит орган, который может быть удален (аппендикс, желчный пузырь и т. д.), то его удаляют. Если причиной перитонита послужила перфорация полого органа (желудка, двенадцатиперстной кишки) — ушивают перфоративное отверстие или делают операцию на желудке. При послеоперационном перитоните, вызванном недостаточностью швов анастомоза, возможно подкрепление анастомоза дополнительными швами при небольшом дефекте или отграничение дефекта от свободной брюшной полости подведением дренажей, аспирацией экссудата и кишечного содержимого. Иногда прибегают к разобщению анастомоза и выведению кишки на переднюю брюшную стенку.
3.Промывание брюшной полости. Эта процедура, так же как и первичная хирургическая обработка инфицированной раны, позволяет удалить продукты распада клеток, пленки и нити фибрина, содержащие большое количество микробов, снизить бактериальную обсемененность брюшины, создать более благоприятные условия для устранения воспалительного процесса. Брюшную полость тщательно промывают изотоническим раствором и антисептиками. Обильное пенообразование, возникающее при этом, позволяет жидкости проникнуть во все щели между органами. Последовательно и осторожно, без грубых манипуляций отмывают все петли кишок, удаляют рыхлые налеты фибрина, все карманы брюшной полости освобождаются
от экссудата. Особое внимание уделяют обработке поддиафрагмального, подпеченочного пространства, карманов брюшины вокруг селезенки, полости малого таза.
Для декомпрессии кишечника в тонкую кишку устанавливают назоинтестинальный двухпросветный зонд с множественными отверстиями. Раздутая тонкая кишка при этом быстро спадается, уменьшается давление внутри ее просвета, улучшается микроциркуляция в ее стенке. Назоинтестинальное дренирование продолжают и в послеоперационном периоде до восстановления тонуса кишечной стенки и уменьшения энтеральных потерь.
4.Дренирование брюшной полости и закрытие раны передней брюшной стенки.
После неоднократного даже очень тщательного промывания брюшной полости и удаления источника перитонита воспалительный процесс полностью не ликвидируется, продолжается экссудация. Целью дренирования брюшной полости по завершении ее санации является обеспечение адекватного оттока экссудата из отлогих мест брюшной полости
исоздание условий для введения антибактериальных препаратов. Виды дренирования строго индивидуальны и зависят от причины
иособенностей перитонита, личного опыта хирурга, его приверженности тому или иному способу.
При распространенном перитоните необходимо дренировать и верхний, и нижний этажи брюшной полости. При классическом способе в верхнем этаже брюшной полости помещают три дренажа: в правое и левое поддиафрагмальные пространства и в подпеченочное пространство. В нижнем этаже брюшной полости один дренаж устанавливают в полость малого таза и левый латеральный канал, второй — в правый латеральный канал. Такое расположение дренажей обеспечивает отток экссудата из всех отделов брюшной полости.
Для дренирования лучше использовать двух- и трехпросветные силиконовые дренажи. Они удобны для пассивного и активного дренирования, для постоянного и фракционного промывания. При этом канал наибольшего диаметра служит для адекватной аспирации

474 |
ГЛАВА 24. Перитонит |
патологического отделяемого, а более тонкие каналы служат для постоянной подачи антисептического раствора и препятствуют присасыванию тканей к аспирационным отверстиям. После окончания операции применяются различные способы последующей санации брюшной полости:
закрытое дренирование;
проточный и фракционный перитонеальный диализ (промывание брюшной полости);
многократное программированное этапное промывание брюшной полости. Выбор способа санации брюшной полости
определяется степенью распространенности и тяжести перитонита, характером экссудата, состоянием больного.
Закрытое дренирование применяется по строгим показаниям, как правило, при серозном или серозно-фибринозном отграниченном или диффузном местном перитоните. Дренирование сочетается с установкой микроирригаторов для введения антибиотиков и антисептиков в зону воспаления.
В последние годы для борьбы с распространенным гнойным перитонитом с успехом применяются этапные программированные промывания брюшной полости. При этом края раны передней брюшной стенки после операции не ушивают, а лишь сближают провизорными швами, вентрофилами, застежкой типа молния или синтетической сеткой (формируют лапаростому). Неполное сведение краев раны препятствует резкому повышению внутрибрюшного давления — развитию так называемого компартмент-синдрома, в результате которого резко ухудшается абдоминальная перфузия и создаются условия для вторичного ишемического повреждения всех органов брюшной полости. Программой лечения заранее предусматривается необходимость повторных ревизий и санаций брюшной полости. В зависимости от распространенности перитонита, агрессивности его течения, общего состояния пациента через 24–48 ч делают повторную ревизию брюшной полости, разделяют формирующиеся спайки, очищают петли кишечника и другие органы от фибринозных наложений. Брюшную полость промыва-
ют антисептиком, после чего вновь сближают края раны. У больных с запущенными формами гнойного перитонита требуется 3–5 сеансов программированного промывания.
Этапные программированные промывания показаны при запущенных формах гнойного и фибринозно-гнойного перитонита, грубых воспалительных изменениях париетальной и висцеральной брюшины, тенденции петель кишечника к слипанию, возможности формирования абсцессов и развития механической спаечной кишечной непроходимости. Данная методика позволяет существенно улучшить результаты лечения больных перитонитом и снизить послеоперационную летальность.
При обширных флегмонах передней брюшной стенки, невозможности сблизить края раны, наличии множественных абсцессов и кишечных свищей лапаростому не закрывают, а применяют открытый способ дренирования.
KНаиболее сложную проблему современной хирургии представляет лечение вторичного перитонита, непосредственно связанного с инфицированием брюшной полости из-за воспалительного процесса или деструкции стенки органа брюшной полости или забрюшинного пространства.
KРаспространенный перитонит следует расценивать как абдоминальный сепсис, его лечение неэффективно без учета и коррекции патологического каскада цитокиновых реакций иммуной защиты, возникающего в рамках синдрома системного воспалительного ответа.
KНезависимо от первичного инфекционного агента продолжение перитонита связано с транслокацией условно-патогенной микрофлоры из потерявшей в условиях пареза биологический герметизм толстой кишки.
KЛечение перитонита предусматривает ликвидацию его источника, санацию брюшной полости и декомпрессию пищеварительной трубки, лечение резидуальной инфекции.
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
475 |
Послеоперационное лечение перитонита
Интенсивная терапия в послеоперационном периоде осуществляется в соответствии с принципами лечения тяжелого сепсиса. Она сочетает рациональную комплексную индивидуальную программу инфузионной терапии, парентеральной нутриционной поддержки в режиме гипералиментации, рациональной респираторной терапии, этиотропной антибактериальной терапии до устранения признаков системной воспалительной реакции и подавления инфекционного процесса; лечение внебрюшинных осложнений.
Антибактериальная терапия должна включать антибиотики широкого спектра действия, по возможности максимально охватить аэробную и анаэробную микрофлору. В последующем проводят направленную антибактериальную терапию на основании бактериологического исследования.
Проводят иммунозаместительную (препараты иммуноглобулинов человека) и иммуномодулирующую терапию, направленную на нормализацию фагоцитарной активности и коррекцию неуправляемого провоспалительного цитокинового шока (ИЛ-2, галавит и т. д.).
Важным компонентом лечения перитонита является коррекция нарушений гомеостаза. Парентеральное введение жидкости назначают с учетом массы тела больного, количества потерь с мочой, рвотой, отделяемым из желу- дочно-кишечного тракта, дыханием, потоотделением. Инфузионную терапию проводят под контролем диуреза, гематокрита, электролитов плазмы, кислотно-основного состояния, объема циркулирующей крови.
Для устранения ДВС-синдрома применяют переливание свежезамороженной плазмы, криопреципитата, синтетических препаратов VII фактора свертывания крови, ингибиторы протеолитических ферментов (гордокс, контрикал, трасилол), антикоагулянтов (гепарин), дезагрегантов (курантил),
С целью дезинтоксикации применяются экстракорпоральные методы — плазмаферез, плазмо- и гемосорбция. При возникновении
острой почечной недостаточности осуществляют гемодиализ.
Прогноз при перитоните
Прогноз при перитоните зависит от характера основного заболевания, вызвавшего перитонит, и вирулентности микрофлоры, своевременности оперативного пособия, адекватности проводимого лечения, состояния компенсаторных возможностей организма. Летальность при распространенном гнойном перитоните по-прежнему остается высокой, составляя в среднем 25–30 %, а при сочетании с полиорганной недостаточностью достигает 85–90 %.
В последние годы проявились определенные перспективы совершенствования подходов к лечению тяжелых форм распространенного перитонита. Они могут быть реализованы в результате разработки нескольких основных направлений. Прежде всего это внедрение новых малоинвазивных эндовидеохирургических методов повторной санации брюшной полости, в частности труднодоступных ее отделов. Другое важное направление состоит в разработке новых методов экспресс-диагностики микробиологической этиологии перитонита с определением доминирующих возбудителей и прогнозированием их вероятной динамической смены. Реализация этого направления позволит значительно ускорить переход к избирательной этиотропной антибактериальной терапии и избежать, таким образом, неблагоприятных последствий длительного необоснованного применения антибиотиков широкого спектра.
Самостоятельного изучения требуют возможность предотвращения несостоятельности кишечных анастомозов в условиях распространенного перитонита посредством прецизионной техники соединения тканей с использованием оснащения и приемов микрохирургии, разработка и совершенствование имеющихся шовных материалов. Имеются перспективы ускоренной целенаправленной коррекции несостоятельности иммуногенеза и нарушений системного метаболизма с помощью заместительной терапии полииммуноглобулинами и иммунонутриционной поддержки.
476 |
ГЛАВА 24. Перитонит |
Перспективными представляются дальнейшие исследования по разработке энтеральных питательных смесей, способных усваиваться в ранние сроки после операций по поводу распространенного перитонита. Поступление щадящих и сбалансированных питательных субстратов служит адекватным раздражителем пищеварительной системы, содействующим ускоренному восстановлению ее функциональных возможностей.
Не исчерпаны возможности экстракорпоральной детоксикации и гемокоррекции. Здесь наиболее перспективной представляется разработка методов, сочетающих операции плазмафереза с целенаправленной доставкой в очаг инфекции антибиотиков, фиксированных на полиморфноядерных лейкоцитах.
Таким образом, решение проблем хирургии тяжелых форм перитонита в значительной мере сопряжено с внедрением новых медицинских технологий и разработкой конкретных, дифференцированных клинических показаний к их использованию.
Отграниченные перитониты —
абсцессы
В соответствии с источником инфекции и топографо-анатомическими особенностями брюшной полости абсцессы возникают в типичных местах: поддиафрагмальном пространстве, подпеченочном пространстве, между петлями кишок, вокруг слепой кишки, в маточ- но-прямокишечном углублении. Клинические проявления абсцессов весьма разнообразны. При отграниченных абсцессах симптомы менее драматичны, чем при распространенном перитоните, и зависят от локализации, причин возникновения, вирулентности микрофлоры и природы возбудителя.
Абсцессы возникают, как правило, в раннем (через 6–7 дней), либо в позднем (через несколько недель) послеоперационном периоде.
Поддиафрагмальные и подпеченочные абсцессы локализуются в правом и левом поддиафрагмальных пространствах между диафрагмой, печенью и поперечно-ободочной кишкой и являются осложнением острых хирургических заболеваний органов брюшной
полости (острого холецистита, перфоративной язвы, панкреатита), а также различных хирургических вмешательств на органах брюшной полости. Больных беспокоят постоянные боли, усиливающиеся при глубоком вдохе, локализующиеся в правом или левом подреберье (в ряде случаев боли иррадиируют в спину, лопатку, плечо), тошнота, икота. Температура тела повышается до фебрильных цифр, носит интермиттирующий характер. Появляется тахикардия до 100–110 ударов в минуту. При осмотре можно выявить вынужденное положение больного на спине или на боку, иногда — полусидя. Язык сухой, обложен грязно-серым налетом. Живот несколько вздут, болезненный при пальпации в подреберьях, иногда — в межреберных промежутках в соответствии с локализацией абсцесса. Иногда в этих областях выявляется некоторая пастозность кожи. Симптомы раздражения брюшины определяются нечасто. В общем анализе крови выявляют лейкоцитоз, нейтрофилез, сдвиг лейкоцитарной формулы крови влево, увеличение СОЭ, т. е. признаки, характерные для гнойной интоксикации. При подозрении на поддиафрагмальный абсцесс обязательно проводят рентгенологическое исследование. В случае поддиафрагмального абсцесса отмечается более высокое стояние купола диафрагмы на стороне поражения, ограничение ее подвижности, сочувственный выпот в плевральной полости. Прямым рентгенологическим симптомом поддиафрагмального абсцесса является наличие уровня жидкости с газовым пузырем над ним.
При УЗИ и КТ поддиафрагмальный (подпеченочный) абсцесс выявляется в виде ограниченного скопления жидкости с неровными контурами, умеренно неоднородной структурой. Метод также позволяет произвести тонкоигольную лечебно-диагностическую пункцию выявленного скопления жидкости. Получение при пункции гнойного содержимого является бесспорным критерием абсцесса.
Наличие абсцесса брюшной полости является абсолютным показанием к хирургическому лечению. Традиционные хирургические вмешательства заключаются во вскрытии и дренировании абсцесса. В настоящее время для лечения абсцессов широко применяются

ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
477 |
малоинвазивные технологии: пункции и дренирования под контролем УЗИ, РТВ или КТ. Перед дренированием необходимо контрастирование полости для исключения распространенности гнойного процесса. Для дренирования предпочтительнее использовать двухпросветный дренаж, а при больших размерах полости — устанавливать два дренажа для проточного промывания. Данная процедура малотравматична и по сравнению с традиционными вмешательствами гораздо легче переносится больными. В процессе лечения необходим рентгенологический контроль положения дренажа в полости абсцесса.
Абсцесс маточно-прямокишечного (пу- зырно-прямокишечного) углубления локализуется в наиболее низком отделе брюшной полости. Основными причинами его развития являются острый деструктивный аппендицит, гнойные воспалительные процессы при гинекологических заболеваниях. Реже абсцесс ма- точно-прямокишечного углубления является следствием перенесенного распространенного гнойного перитонита. Клиническую картину при данной локализации абсцесса отличают боли в нижних отделах живота, тенезмы, жидкий стул со слизью. При выраженной воспалительной инфильтрации стенки прямой кишки и мочевого пузыря можно наблюдать зияние ануса, недержание кала и газов, дизурию. Колебания температуры тела могут достигать 2–3 С в сутки с подъемами ее до 39 С и выше. При пальпации живота защитное напряжение мышц и симптомы раздражения брюшины, как правило, не определяются. Лишь при большом скоплении гноя (1 л и более) и распространении воспаления по брюшине в проксимальном направлении появляется мышечная защита. При пальцевом исследовании прямой кишки определяют нависание ее передней стенки, резкую болезненность этой области, иногда пальпируется уплотнение тестоватой консистенции. У женщин с абсцессом дугласова пространства при влагалищном исследовании
выявляются нависание заднего свода, резкая болезненность при смещении шейки матки. В анализах крови выявляются признаки, характерные для гнойного процесса. В качестве диагностической процедуры используют УЗИ
ипункцию заднего свода влагалища у женщин или передней стенки прямой кишки у мужчин в месте наибольшего размягчения инфильтрата. Вскрытие абсцесса осуществляется под наркозом через переднюю стенку прямой кишки по игле, введенной в полость. В образовавшееся отверстие устанавливают дренажную трубку.
Межкишечные абсцессы развиваются вследствие деструктивного аппендицита, прободной язвы желудка или двенадцатиперстной кишки, после перенесенного распространенного гнойного перитонита. Больных, как правило, беспокоят тупые боли умеренной интенсивность без четкой локализации, периодическое вздутие живота.
По вечерам отмечают подъемы температуры тела до 38 С и выше. Живот остается мягким, признаков раздражения брюшины нет, и лишь при локализации гнойника близко к передней брюшной стенке и больших его размерах определяется защитное напряжение мышц. В анализах крови выявляются умеренный лейкоцитоз и ускоренная СОЭ. При достаточно больших размерах абсцесса выявляют очаг затемнения при рентгенологическом исследовании, редко — с уровнем жидкости
игаза. Основными способами диагностики являются УЗИ и КТ. Полость абсцесса требует вскрытия и дренирования. Возможны пункция и дренирование абсцесса под контролем УЗИ или КТ.
Абсцессы брюшной полости являются вариантом отграниченного перитонита, основную роль в их лечении должны играть малоинвазивные способы дренирования, позволяющие предупредить инфицирование свободной брюшной полости и уменьшить уровень хирургической агрессии.

ГЛАВА 25 |
Эндоскопическая |
хирургия |
П.А. Ярцев
История развития |
разработаны осветительные «зеркала», к ра- |
эндоскопической хирургии |
бочему концу которых крепилась маленькая |
|
электрическая лампочка. Для выполнения этих |
Технические и медицинские основы совре- |
вмешательств автор использовал специальные, |
менной эндоскопии были заложены в XVIII в. |
похожие на общехирургические, инструмен- |
Первой из них стало изобретение в 1806 г. |
ты длиной 35 см и более. 26 апреля 1906 г. на |
Филиппом Боззини эндоскопа, названного |
заседании Акушерско-гинекологического об- |
им световодом (lichtleiter, нем.). В его кон- |
щества в Санкт-Петербурге было сообщено |
струкции была использована система линз для |
об аппендэктомии, выполненной Д.О. Оттом |
проведения света и получения изображения. |
у больной после гистеровариоэктомии через |
В основе этого прибора лежали принципы, ко- |
верхнюю кольпотомию. |
торые продолжали использоваться много лет |
В том же году немецкий ученый Георг Кел- |
в совершенствующихся эндоскопах, — аль- |
линг из Дрездена в Обществе немецких ученых |
тернативный (искусственный) источник све- |
и врачей в Гамбурге продемонстрировал ис- |
та, направление света в сторону исследуемого |
следование брюшной полости собаки при по- |
объекта, осмотр через другой канал. Антуан |
мощи цистоскопа Nitze с применением инсуф- |
Жан Десормо стал первым врачом, применив- |
фляции воздуха. Он назвал свое исследование |
шим lichtleiter у человека. В 1853 г. он усовер- |
«kolioskopie». Его нововведением являлось |
шенствовал изобретение Ф. Боззини и назвал |
не только использование пневмоперитонеума |
его эндоскопом (endoscope, фр.). Немецкий |
для проведения процедуры, но и использова- |
терапевт Адольф Куссмауль выполнил эзофа- |
ние иглы для инсуффляции воздуха в брюшную |
госкопию, используя две 47-сантиметровые |
полость. |
металлические трубки. Его первым пациентом |
Термины «лапароскопия» и «торакоско- |
стал шпагоглотатель. |
пия» принадлежат шведскому врачу Гансу |
Начало и середина XX в. ознаменованы |
Христиану Якобеусу (1879–1937). В 1910 г. в |
попытками хирургов осмотреть брюшную по- |
«Мюнхенском медицинском еженедельнике» |
лость и даже выполнить ряд манипуляций, не |
он опубликовал отчет о 17 лапароскопиях и |
делая при этом большой разрез. В 1901 г. рус- |
двух торакоскопиях с использованием троака- |
ский акушер-гинеколог из Санкт-Петербурга |
ра. Уже на следующий год им было сообщено о |
Дмитрий Оскарович Отт через кольпотоми- |
115 исследованиях. |
ческое отверстие осматривал органы малого |
Разработка специализированного обору- |
таза при помощи лобного рефлектора, лампы |
дования для эндоскопической хирургии нача- |
и зеркала. Он назвал эту процедуру «вентро- |
лась в 1928 г., когда по заказу Хайнца Калька |
скопией». Разработка влагалищного досту- |
фирма Heynemann разработала оптический |
па к органам малого таза привела Д.О. Отта в |
прибор с увеличенным углом обзора. Кроме |
1890 г. к идее освещения операционного поля |
того, им был сконструирован дополнительный |
электрической лампой накаливания, снабжен- |
6 мм троакар для выполнения манипуляций |
ной рефлектором. Несколько позже им были |
при лапароскопии. К 1942 г. им было выпол- |
478
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
479 |
нено 720 лапароскопий, а в 1943 г. доложено |
роскопический шов. Учитывая негативное от- |
о 123 лапароскопических биопсиях печени с |
ношение к лапароскопии, K. Semm применял |
использованием этого инструментария. Его |
термин «пельвиоскопия». В 1976 г. выходит |
метод двойной пункции (с использованием |
учебник «Пельвиоскопия и гистероскопия», |
двух троакаров) брюшной стенки можно рас- |
предисловие к которому написал Raoul Palmer. |
сматривать как начало использования лапаро- |
Его дискуссии с хирургами о возможности вы- |
скопии в качестве оперативного пособия. |
полнения лапароскопической холецистэкто- |
В 1954 г. произошло событие, которое |
мии в период с 1975 по 1980 г. вызывали лишь |
впоследствии значительно расширило воз- |
непонимание и усмешку. В 1977 г. в журнале |
можности эндоскопических исследований. Ан- |
«Archivum chirurgicum Neerlandicum» появи- |
глийский физик Harold Horace Hopkins (1918– |
лась публикация о новой технике выполнения |
1994) вместе со своим студентом Narinder |
аппендэктомии. А в мае 1980 г. Kurt Semm стал |
Singh Kapany в журнале «Nature» описали |
первым, кто выполнил эту операцию полно- |
фиброскоп (fi berscope, англ.) — устройство, |
стью лапароскопическим способом. Его отчет |
способное передавать изображение по гибко- |
был опубликован в США в 1982 г., а в Герма- |
му стекловолокну. В 1959 г. H. Hopkins получил |
нии — только в 1983 г. |
патент на это устройство. Изобретение было |
В Советском Союзе первое сообщение о |
довольно прохладно встречено английским на- |
24 лапароскопических исследованиях брюшной |
учным сообществом. Однако спустя некоторое |
полости принадлежит Александру Михайлови- |
время начинающий немецкий производитель |
чу Аминеву, о чем было доложено на заседании |
медицинского оборудования Karl Storz (1911– |
Хирургического общества Москвы в 1938 г. |
1996) предложил H. Hopkins сотрудничество. |
Первую торакоскопию при хронической эм- |
Как следствие этого, в 1965 г. был сделан пер- |
пиеме выполнил П.А. Герцен в 1925 г. В 1944 г. |
вый эндоскоп Storz—Hopkins, значительно |
впервые в нашей стране торакоскопия была |
превосходящий по качеству изображения все |
применена при ранении груди Ф.В. Шебановым |
другие устройства. |
(цит. по: Авилова О.М. и др., 1986). Торакоско- |
До 1960 г. многие врачи еще продолжали |
пию при гнойных осложнениях огнестрельных |
использовать для создания пневмоперитоне- |
ранений груди в период Великой Отечествен- |
ума ручные инсуффляторы. Немецкий гине- |
ной войны применяли Ф.А. Эфендиев, Б.Е. Пан- |
колог Kurt Karl Stephan Semm, занимавшийся |
кратьев, Г.И. Пинчук, И.С. Колесников. |
созданием инсуффлятора для фаллопиевых |
|
труб, который он представил в 1955 г., предпо- |
Основы техники |
ложил, что аналогичный прибор может быть |
эндоскопических операций |
использован для пневмоперитонеума. В 1960 г. |
|
K. Semm сконструировал первый автомати- |
Для выполнения любой лапароскопической |
ческий инсуффлятор, позволявший не только |
операции необходимы операционная стойка и |
задавать определенное значение в брюшной |
набор инструментов. Стойка комплектуется |
полости, но и поддерживать его в течение опе- |
из видеомонитора, основным отличием кото- |
рации. Во второй половине 1960-х гг. изобрете- |
рого от бытового телевизора является каче- |
ние было представлено в США. Показательно, |
ственная электромагнитная защита, наличие |
что в течение нескольких месяцев поступили |
видеокамеры, источника света, инсуффлятора, |
заказы на более 400 инсуффляторов. |
аспиратора с функцией ирригации, электрохи- |
В 1970 г. K. Semm возглавил университет- |
рургического блока (рис. 25.1). Желательной |
скую женскую клинику города Киля, которой |
составляющей является устройство для видео- |
руководил до 1995 г. Работая здесь, он стал |
записи, которое позволяет не только докумен- |
внедрять термокоагуляцию для эндоскопиче- |
тировать, но и анализировать в последующем |
ского гемостаза, доказывая эффективность и |
ход операции. |
безопасность этого метода. Кроме того, им ши- |
Первое, с чем сталкивается хирург, ока- |
роко применялись петлевые лигатуры и лапа- |
зываясь один на один с предстоящей эндо- |
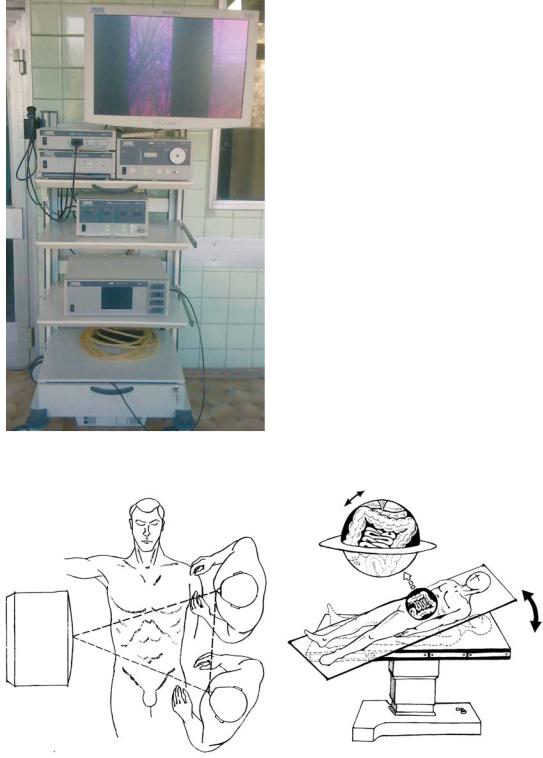
480 |
|
ГЛАВА 25. Эндоскопическая хирургия |
|
скопической операцией, — это расстановка |
|
|
операционной бригады, расположение эндо- |
|
|
скопической стойки, положение операционно- |
|
|
го стола. |
|
|
Предполагая зону и объем операции, хи- |
|
|
рург должен соответствующим образом рас- |
|
|
положить |
операционную стойку. Наиболее |
|
физиологичным и эргономичным является |
|
|
расположение операционной стойки таким |
|
|
образом, чтобы между оперирующим хи- |
|
|
рургом, зоной операции и видеомонитором |
|
|
можно было провести прямую линию. Пер- |
|
|
вый ассистент также должен располагаться в |
|
|
прямой проекции к видеомонитору, это по- |
|
|
зволяет обеспечить наиболее адекватное вза- |
|
|
имодействие его с оперирующим хирургом |
|
|
(рис. 25.2). |
|
|
Условие визуализации зоны вмешательства |
|
|
посредством ретракции органов, осуществляе- |
|
|
мое в открытой хирургии при помощи отгра- |
|
|
ничивания пеленками и салфетками, фиксиро- |
|
|
ванными |
руками ассистентов, невыполнимо |
|
в необходимой мере в лапароскопической хи- |
|
|
рургии. Помочь в этом может расположение |
|
|
операционного стола. Изменение его положе- |
|
|
ния позволяет отвести тонкую кишку вверх |
|
|
или вниз, вправо или влево, осуществить услов- |
|
|
ную тракцию желудка или ободочной кишки, |
|
Рис. 25.1. Операционная стойка |
осмотреть органы малого таза (рис. 25.3). |
|
|
Рис. 25.3. Изменение положения операционного |
Рис. 25.2. Расположение операционной бригады |
стола |

ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
481 |
Пневмоперитонеум является необходимым условием выполнения лапароскопической операции. На сегодня это единственный способ обеспечить объем в брюшной полости, позволяющий свободно осматривать органы брюшной полости и выполнять манипуляции инструментами.
Формирование пневмоперитонеума принципиально возможно четырьмя способами: иглой Вереша, первичным вхождением троакаром с защищенным стилетом, методом Хассона, троакарами для вхождения в брюшную полость под контролем лапароскопа, например «Visiport». Доступ троакаром с незащищенным стилетом несет в себе неоправданную опасность.
Рабочие троакары устанавливают так, чтобы образовать треугольник по отношению к области операции, это обеспечивает возможность оптимальных движений и визуализации. Расстояние между троакарами составляет примерно 10–15 см. При этом идеальным является расположение троакара, при котором половина длины инструмента в момент работы находится внутри, половина — снаружи (рис. 25.4).
Существует два вида используемых в эндоскопической хирургии узлов: экстракорпоральные и интракорпоральные. Оба вида требуют определенного навыка, т. к. должны формироваться без больших временных затрат, а также быть достаточно надежными, чтобы обеспечивать герметичность перевязываемой или прошиваемой ткани.
Наиболее известным и применяемым из экстракорпоральных узлов является узел Редера и его модификации (рис. 25.5).
Этот узел и его варианты при правильном формировании обеспечивают достаточную герметичность при сопоставлении и надежность при перевязывании тканей.
Существуют также приспособления, несколько облегчающие ушивание и формирование узлов. Например, иглодержатель с центрующейся иглой или приспособление «Endo Stitch», которое благодаря Т-образному соединению нити с иглой, а также возможности
Рис. 25.4. Идеальное расположение троакаров |
Рис. 25.5. Петля Редера |
482 |
ГЛАВА 25. Эндоскопическая хирургия |
фиксации иглы в любой из двух браншей позволяет быстро и надежно формировать не только отдельные, но и непрерывные швы.
Современные сшивающие аппараты, адаптированные для эндоскопических операций, такие как «Endo GIA», позволяют быстро и надежно пересекать ткани и формировать анастомозы, что также значительно расширяет спектр выполняемых операций.
Электрохирургические средства, используемые в эндоскопической хирургии, аналогичны таковым в открытой хирургии. Различие заключается только в используемой рукоятке.
Экстракция органов и тканей из брюшной полости должна осуществляться без контакта последних с передней брюшной стенкой, что может привести к ее инфицированию (как правило, извлекаются воспаленные органы или препараты с опухолью). Если препарат невозможно удалить через троакар, его необходимо поместить в контейнер. Удаляемые органы и ткани часто превышают размеры лапароскопических разрезов на животе. В случае, когда удаляется доброкачественное образование, можно воспользоваться морцеллятором — механическим измельчителем тканей.
В целом все вышесказанное указывает на некоторые специфические отличия эндоскопической хирургии, требующие базовых знаний, заблаговременного осмысления и тренировки задолго до операции, а также постоянного ознакомления с новыми технологиями, позволяющими расширять возможности современной хирургии.
Острый аппендицит т Показания
Деструктивные изменения червеобразного отростка при исключении их вторичного характера.
Противопоказания
Распространенный разлитой перитонит (здесь и далее — классификация В.С. Савельева, 2006).
Аппендикулярный инфильтрат.
Общие противопоказания к лапароскопи-
ческой операции.
Лапароскопическими признаками разлитого перитонита являются: мутный фибриноз- но-гнойный выпот во всех отделах брюшной полости, выраженные гиперемия и отечность париетальной и висцеральной брюшины, наложения фибрина, расширенные свыше 3 см петли тонкой кишки. При данной ситуации для выполнения адекватного лечебного пособия и полноценной назоинтестинальной интубации необходима операция открытым методом.
Под аппендикулярным инфильтратом следует понимать плотный воспалительный конгломерат, состоящий из червеобразного отростка и петель кишечника, который невозможно разделить без использования диссекционного (острого) или коагуляционного метода. Наличие же воспалительного комплекса тканей, состоящих из аппендикса и окружающих его структур, разделение которого возможно тупым путем, по сути, не является аппендикулярным инфильтратом и в данном случае подлежит оперативному лечению лапароскопическим или открытым методом.
Возможность выполнения лапароскопических операций при наличии периаппендикулярного абсцесса остается дискутабельным вопросом. Опасность заключается в возможном вскрытии и прорыве содержимого абсцесса в брюшную полость при создании пневмоперитонеума. Однако, по нашему мнению, вскрытие периаппендикулярного абсцесса не является показанием к конверсии доступа — необходимо вскрыть полость, аспирировать гнойное содержимое и продолжить выделение червеобразного отростка эндохирургическим методом.
Показания к конверсии
Гангренозный аппендицит с перфорацией и фрагментацией отростка, что делает невозможным его тракцию и мобилизацию.
Выраженный спаечный процесс в брюшной полости, препятствующий манипуляциям на слепой кишке и червеобразном отростке.
Лапароскопическую аппендэктомию начинают с захвата аппендикса эндоскопическим зажимом в области дистального конца или за край брыжеечки (рис. 25.6). После этого отросток приподнимают по направлению к передней брюшной стенке. При фиксации отростка
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
483 |
Рис. 25.6. Захват червеобразного отростка
спайками их рассекают эндоскопическими ножницами или при помощи монолибо биполярной электрокоагуляции при помощи элек- трода-крючка. Рыхлый инфильтрат разделяют наконечником аспиратора-ирригатора для быстрой аспирации гноя в случае опорожнения периаппендикулярного абсцесса.
В зависимости от технической оснащенности операционной применяют следующие способы обработки брыжеечки червеобразного отростка: биполярная электрокоагуляция (в том числе с использованием эффекта «LigaSure»), рассечение тканей ультразвуковыми ножницами «Ultracision», лигирование, клипирование, аппаратный способ пересечения.
Возможны следующие способы обработки культи червеобразного отростка: лигатурный, погружной, аппаратный. Лигатурный способ применяется наиболее часто в эндоскопической хирургии, т. к. является наиболее простым, легковыполнимым и достаточно надежным (рис. 25.7). При этом оптимальной является обработка основания червеобразного отростка при помощи эндопетель с узлом по Редеру.
При наличии воспалительных изменений купола слепой кишки в области основания червеобразного отростка показано выполнение погружного способа обработки культи. Этот метод предусматривает погружение обработанной лигатурным способом культи червеобразного отростка в купол слепой кишки кисетным швом или отдельными узловыми швами.
Аппендикс извлекают через 10 мм троакар. Отросток захватывают за проксимальный конец на участке до лигатуры и осторожно втягивают в троакар. Если диаметр отростка более 10 мм, а также при его выраженных деструктивных изменениях (перфорация, фрагментация), червеобразный отросток извлекают в фабричном или самостоятельно изготовленном (из перчатки) контейнере. В случаях, когда извлечению аппендикса препятствует оставшаяся на отростке часть брыжейки, последнюю срезают ножницами и извлекают отдельно.
а |
б |
Рис. 25.7. Лигатурный способ обработки культи червеобразного отростка:
а — петля накинута на основание отростка; б — петля затянута
484 |
ГЛАВА 25. Эндоскопическая хирургия |
При попадании содержимого отростка в брюшную полость, а также при отграниченном перитоните показана санация брюшной полости. Для промывания используют 0,05% раствор мирамистина. В конце операции при наличии воспалительного выпота в брюшной полости или при возникновении технических трудностей в ходе операции дренируют полость малого таза через зону расположения культи отростка двухпросветной силиконовой трубкой. При местном перитоните или периаппендикулярном абсцессе дренажи устанавливают дополнительно к ложу червеобразного отростка или в полость абсцесса.
Осложнения, связанные с диагностической и лечебной лапароскопией у больных с острым аппендицитом, следует разделять на две группы. Первая группа осложнений связана с самим операционным доступом, а вторая — это осложнения острого аппендицита после лапароскопической аппендэктомии.
Интраоперационные осложнения
Кровотечение из брыжейки червеобразного отростка развивается в 0,1–2,3 % наблюдений. Это осложнение значительно усложняет операцию и является одной из основных причин конверсий. Кровоточащий сосуд необходимо захватить и временно пережать эндоскопическим зажимом или диссектором. Затем после удаления аспиратором-ирригато- ром крови и сгустков под визуальным контролем сосуд клипируют или коагулируют. Недопустимо коагулировать или клипировать сосуд вслепую в луже крови, поскольку это может привести к еще более тяжелым осложнениям. В случаях профузного кровотечения с большой кровопотерей (более 200 мл) или неясной анатомии показан переход к открытой операции.
Соскальзывание лигатуры с культи аппендикса. Это осложнение встречается редко на этапе освоения методики и происходит по следующим причинам: узел неправильно сформирован или плохо затянут; узел развязался (как правило, при неправильном выборе шовного материала); оставлена короткая культя червеобразного отростка; произведена электрокоагуляция культи отростка после наложения лигатуры. В данной ситуации необходимо
вновь захватить культю аппендикса эндоскопическим зажимом и наложить эндопетлю. Если это не удается, следует ушить культю непрерывным или узловыми швами с последующей перитонизацией культи кисетным или узловыми серо-серозными швами.
Пересечение червеобразного отростка лигатурой. Происходит это, как правило, при выраженных воспалительных изменениях основания аппендикса либо при использовании для лигирования шовного материала с условным диаметром нити менее 0. Дефект в куполе слепой кишки должен быть немедленно ушит двухрядным швом либо сшивающим аппаратом. При отсутствии у хирурга мануальных навыков наложения лапароскопического шва показан переход к открытой операции.
Ожог тканей — наиболее распространенное электрохирургическое осложнение при лапароскопической аппендэктомии. Ожоги купола слепой кишки и брыжейки червеобразного отростка являются наиболее частой причиной возникновения инфильтратов, абсцессов, перитонита в ближайшем послеоперационном периоде (обычно на 5-е сутки после операции). Наиболее опасными при лапароскопической аппендэктомии являются электрохирургические повреждения, возникающие вне зоны эндоскопического обзора. Такие повреждения, как правило, не распознаются во время операции. Осложнения, возникающие из-за случайного нераспознанного термического повреждения, могут иметь серьезные последствия, включая кровоизлияние, некроз тканей с формированием абсцесса, перфорацию полого органа с развитием перитонита.
Повреждение кишечника — наиболее тяжелое осложнение эндохирургии. Коварство этого осложнения состоит в том, что клинические проявления повреждения возникают лишь через несколько дней после операции при развитии перитонита, с которым не всегда удается справиться. Летальность после таких повреждений, по данным мировой статистики, составляет 25 %, что даже превосходит смертность от троакарных повреждений аорты и нижней полой вены. Основными причинами электрохирургических повреждений вне зоны эндоскопического обзора являются дефекты

ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
485 |
изоляции электрохирургических инструментов, емкостный «пробой» электроэнергии и прямой «пробой» электроэнергии.
Послеоперационные осложнения
Внутрибрюшное кровотечение. Возникает это осложнение, как правило, в период освоения методики. Источником кровотечения наиболее часто являются сосуды брыжейки червеобразного отростка либо проколы передней брюшной стенки. Диагностика не представляет сложности, особенно при наличии дренажа в брюшной полости. Если показатели гемодинамики существенно не нарушены, допустимо выполнение релапароскопии. В случаях профузного кровотечения с критическими показателями гемодинамики показана экстренная лапаротомия. Во время операции кровоточащий сосуд временно пережимают зажимом, удаляют аспиратором-ирригатором из зоны операционного воздействия кровь со сгустками и производят окончательную остановку кровотечения одним из описанных выше способов. Если источник кровотечения в ходе лапароскопии не обнаружен, а кровотечение продолжается, показан переход на лапаротомию. После окончательной остановки кровотечения необходимо выполнить тщательную санацию брюшной полости с удалением всей крови и сгустков.
Интраабдоминальные инфекционные осложнения (инфильтраты, абсцессы, перитонит). Эта группа осложнений после лапароскопической аппендэктомии регистрируется чаще в сравнении с традиционной аппендэктомией. Причинами интраабдоминальных инфекционных осложнений являются: электрохирургический ожог купола слепой кишки и брыжейки червеобразного отростка (подавляющее большинство случаев); недостаточная антибактериальная обработка культи червеобразного отростка; несостоятельность культи червеобразного отростка вследствие неоправданного расширения показаний к лигатурному способу обработки культи; неадекватные санация или дренирование брюшной полости.
Раневые инфекционные осложнения после лапароскопической аппендэктомии.
Эти осложнения наблюдаются в 4 раза реже в
сравнении с открытой аппендэктомией. Инфекционные осложнения чаще возникают в ране, через которую извлекался препарат, и связаны, как правило, с грубыми нарушениями техники извлечения препарата.
Послеоперационные грыжи — редкое осложнение лапароскопической аппендэктомии. Грыжа появляется, как правило, через 1−4 нед. после операции, когда пациент возвращается к обычному образу жизни. Причины осложнения — гематомы, нагноение ран, дефекты хирургической техники при ушивании послеоперационных ран.
Перфоративные гастродуоденальные язвы
Показания. Показанием к лапароскопическому способу ушивания является перфорация желудка или двенадцатиперстной кишки в случаях, когда ее диаметр не превышает 5 мм, а инфильтративный вал менее 10 мм (рис. 25.8).
Противопоказания
Распространенный разлитой перитонит. Лапароскопические признаки разлитого перитонита: расширенные во всех отделах брюшной полости петли тонкой кишки без перистальтики (более 3,0 см), гиперемированная и тусклая серозная оболочка, наложения фибрина на серозной оболочке тонкой кишки и других органах брюшной полости, наличие мутного выпота во всех
Рис. 25.8. Интраоперационная картина перфоративной язвы

486 |
|
ГЛАВА 25. Эндоскопическая хирургия |
|
|
Диаметр перфоративного отверстия две- |
|
|
надцатиперстной кишки более 5 мм при |
|
|
наличии перифокального воспалительного |
|
|
инфильтрата более 10 мм или диаметр пер- |
|
|
форации двенадцатиперстной кишки более |
|
|
10 мм даже при отсутствии воспалительно- |
|
|
го инфильтрата. |
|
|
Сопутствующие осложнения язвенной бо- |
|
|
лезни: кровотечение, стеноз, пенетрация. |
|
|
Противопоказания, общие для всех лапаро- |
|
|
скопических вмешательств. |
|
|
Техника операции. Используется следующая |
|
схема расположения операционной бригады |
|
|
(рис. 25.10): операционная стойка с монитором |
|
|
располагается справа и максимально близко к го- |
|
|
ловному концу операционного стола, оперирую- |
|
Рис. 25.9. Интраоперационная картина разлитого |
щий хирург — между ног пациента (либо слева |
|
перитонита |
от него), ассистент стоит слева или справа в зави- |
|
|
симости от положения оперирующего хирурга. |
|
|
|
Троакары с инструментами устанавлива- |
|
ют в зависимости от конституции больного и |
|
|
локализации перфоративного отверстия, как |
|
|
правило, в следующих областях: параумбили- |
|
|
кально (оптический троакар) — 11 мм, правая |
|
|
мезогастральная область — 6 мм, левая мезо- |
|
|
гастральная область — 11 мм, дополнительно |
|
|
может быть установлен троакар в правом под- |
|
|
реберье или в эпигастрии по срединной линии |
|
|
для ретрактора. Для инструментов оперирую- |
|
|
щего хирурга используются троакары в мезо- |
|
|
гастральных областях. Через троакар в правом |
|
|
подреберье или эпигастрии вводится инстру- |
|
|
мент ассистента, используемый для ретракции. |
|
|
|
Для выбора методики лапароскопического |
|
ушивания перфорации предложена класси- |
|
|
фикация перфоративных гастродуоденальных |
|
|
язв, учитывающая диаметр перфорации и вы- |
|
|
раженность воспалительного инфильтрата |
|
Рис. 25.10. Расположение хирургической бригады: |
(табл. 25.1, 25.2). |
|
1 — оперирующий хирург; 2 — ассистент |
|
В соответствии с классификацией опреде- |
|
ляется методика ушивания. |
|
отделах брюшной полости (рис. 25.9). |
1. |
При перфоративной язве желудка и две- |
В настоящее время это противопоказание |
|
надцатиперстной кишки класса IА, IB или |
можно рассматривать как относительное. |
|
IIA показано ушивание одним Z-образным |
При соответствующей подготовке хирурга, |
|
швом (рис. 25.11). |
а также возможности эндоскопического за- |
2. |
При перфоративной язве желудка и две- |
ведения зонда за связку Трейца может быть |
|
надцатиперстной кишки класса IC или IIB |
выполнено адекватное ушивание с санаци- |
|
ушивание следует выполнять отдельными |
ей брюшной полости. |
|
однорядными швами (рис. 25.12). |
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
487 |
Таблица 25.1. Классификация перфоративных гастродуоденальных язв, учитывающая диаметр перфорации
Таблица 25.2. Классификация перфоративных гастродуоденальных язв, учитывающая выраженность воспалительного инфильтрата
Диаметр перфоративного отверстия |
Степень |
|
|
|
|
≤ 2 |
мм |
I |
> 2 |
мм и ≤ 5 мм |
II |
> 5 |
мм и ≤ 10 мм |
III |
> 10 мм |
IV |
|
Протяженность воспалительного инфиль- Степень трата от краев перфоративного отверстия
≤ 5 |
мм |
A |
> 5 |
мм и ≤ 10 мм |
B |
> 10 мм |
C |
|
|
|
|
3.При перфоративной язве желудка и двенадцатиперстной кишки класса IIIА или IIIВ ушивание следует выполнять отдельными двухрядными швами (рис. 25.13).
4.При перфоративной язве желудка класса IIC, IIIC, IVA, IVB или IVC ушивание перфоративного отверстия следует выполнять отдельными двухрядными швами.
5.При перфоративной язве двенадцатиперстной кишки класса IIC, IIIC, IVA, IVB, IVC лапароскопическое ушивание перфоративного отверстия не показано. В данном случае оперативное пособие выполняют открытым способом в объеме, решаемом в
индивидуальном порядке (резекция желудка, пилоропластика с ваготомией).
Во всех случаях ушивания для формирования первого ряда используют рассасывающуюся крученую нить условным диаметром 2/0 на атравматичной игле 20–25 мм, второго ряда — нерассасывающуюся крученую нить условным диаметром 2/0 на атравматичной игле 20–25 мм. Иглу изгибают в виде лыжи, для удобства введения в брюшную полость через 10 мм троакар.
В завершение операции необходима тщательная санация брюшной полости: аспирация патологического содержимого из всех отделов брюшной полости с последующим промыванием физиологическим раствором. Как правило, дренируют правое подпеченочное пространство и полость малого таза двухпросветными силиконовыми трубками. При наличии большого количества патологического выпота в левых отделах брюшной полости дополнительно дренируют левое поддиафрагмальное пространство и латеральный канал.
Считаем перспективным дополнить лапароскопическое ушивание перфоративной
Рис. 25.11. Ушивание перфоративного отверстия Z-образным швом
Рис. 25.12. Ушивание перфоративного отверстия однорядным швом
Рис. 25.13. Ушивание перфоративного отверстия отдельными двухрядными швами
488 |
ГЛАВА 25. Эндоскопическая хирургия |
язвы селективной проксимальной ваготомией (рис. 25.14). Положение больного и точки введения троакаров остаются прежними. Показаниями к этому вмешательству служат длительно существующий язвенный анамнез и неэффективность противоязвенной терапии. Частично мобилизуют левую долю печени и отводят ее вправо ретрактором, введенным через троакар в правом подреберье. Желудок захватывают в средней трети зажимом Babcock через троакар в левом подреберье и делают тракцию желудка влево и вниз, при этом можно обнаружить передний нерв Латарже в виде тонкого белого тяжа, идущего вдоль малой кривизны желудка. После визуализации двух последних ветвей гусиной лапки проксимальнее на 4–7 см от привратника рассекают висцеральную брюшину вдоль малой кривизны ультразвуковыми ножницами.
Далее продолжают мобилизацию желудка, для чего пересекают малый сальник вдоль желудочной стенки. При этом пересекают ветви n. vagus вначале переднего ствола, а затем заднего. После мобилизации желудка открывается окно в сальниковую сумку. Мобилизацию малой кривизны производят до пищеводно-же- лудочного перехода и далее мобилизуют пищевод на протяжении 4–5 см, пересекая криминальную ветвь Грасси. Следует обратить внимание на опасность повреждения ветвей
нерва Латарже. Это чревато нарушением эвакуации из желудка, и тогда операцию следует дополнять пилоропластикой. При повреждении левой желудочной артерии может потре-
боваться лапаротомия.
Послеоперационный период. Важнейшей мерой профилактики несостоятельности швов в области перфорации является аспирация желудочного содержимого через зонд. Необходимо создать разрежение до 50 см вод. ст., что исключает присасывание стенки желудка. Зонд удаляют после разрешения послеоперационного пареза кишечника.
Следует учитывать, что операция ушивания перфоративной язвы не приводит к излечению язвенной болезни, а направлена лишь на устранение ее осложнения — прободения. В связи с этим пациенты нуждаются в комплексной терапии с первого дня операции и в последующем периоде. Блокаторы протоновой помпы начинают вводить интраоперационно. После разрешения пареза кишечника больных пере-
водят на таблетированные формы препарата. Осложнения. В послеоперационном пери-
оде возможны следующие осложнения: несостоятельность швов в области ушитой перфоративной язвы, внутрибрюшное кровотечение, ранняя спаечная тонкокишечная непроходимость, легочные осложнения (пневмония, ателектазы, гидроторакс). Как правило, общее количество осложнений не превышает 1–1,5 %. Причиной несостоятельности швов чаще всего являются несоблюдение методики ушивания, нефункционирующий назогастральный зонд, а также превышение показаний к лапароскопической операции. Наиболее частой причиной внутрибрюшного кровотечения является прорезывание швов в области язвенного дефекта. Для профилактики этого осложнения необходимо использовать нить размером не менее 2/0 и соблюдать описанную выше технику.
Спаечная тонкокишечная непроходимость
Показания
|
Картина острой кишечной непроходимо- |
Рис. 25.14. Выполнение селективной проксималь- |
сти без ранее перенесенных операций на |
ной ваготомии |
органах брюшной полости. |
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
489 |
Клиническая картина странгуляционной кишечной непроходимости и малые лапаротомии (аппендэктомия, гинекологические вмешательства) в анамнезе.
Состояние после разрешения частичной спаечной тонкокишечной непроходимости на фоне ее рецидивирующего течения и малые лапаротомии (аппендэктомия, гинекологические вмешательства) в анамнезе.
Противопоказания
Большое количество рубцов на передней брюшной стенке, что свидетельствует о распространенном спаечном процессе, а также отсутствие УЗ-окна для введения первого троакара.
Поздние сроки заболевания с резким взду-
тием петель тонкой кишки (до 5–6 см).
Техника операции. При установлении
показаний к лапароскопии у больных с явлениями спаечной непроходимости наиболее опасно введение первого троакара, что может привести к повреждению внутренних органов в самом начале операции. В связи с этим точки введения троакаров определяют до операции с помощью ультразвукового исследования брюшной полости поверхностным датчиком. Ограничение подвижности полых органов по отношению к париетальной брюшине служит основным признаком спаек с передней брюшной стенкой. При отсутствии полной уверенности в наличии свободной от спаек зоны брюшной полости введение первого троакара осуществляется либо открытым способом по Хассону, либо с использованием аппарата «Visiport».
Во время операции необходимо обеспечить хорошую релаксацию, достаточный пневмоперитонеум и, соответственно, адекватное операционное пространство. Рабочие троакары вводят под контролем лапароскопа в местах, выбираемых индивидуально в каждом конкретном случае. Предпочтительно располагать троакары для оптики и инструментов в виде треугольника, чтобы оси их действия не были перпендикулярны оси лапароскопа.
После обзорной лапароскопии показаниями к конверсии являются:
1) распространенный разлитой перитонит;
2)некроз или сомнения в жизнеспособности кишки;
3)перфорация стенки кишки;
4)выраженный спаечный процесс в брюшной полости.
При наличии перерастянутых петель тон-
кой кишки (более 4 см) необходима интраоперационная назоинтестинальная интубация с помощью интестиноскопа. Осмотр тонкой кишки начинают от илеоцекального угла, от спавшейся части тонкой кишки, что позволяет избежать травматизации перерастянутой стенки кишки зажимами. Во время вмешательства применяют только атравматический инструмент, обеспечивающий захват кишки на большой площади. Разделение спаек и устранение деформации кишечных петель выполняют острым путем — ножницами. Для снижения риска повреждения стенки кишки при разделении спаек избегают применения электрокоагуляции, в случае необходимости применяют биполярную коагуляцию или ультразвуковые ножницы как более безопасные. Минимальное расстояние от стенки кишки, на котором возможно использование монокоагуляции, — 5–8 мм, а при биполярной — 3 мм. При кровотечении с целью гемостаза предпочтительнее применение клипсаппликаторов и эндопетель. Интимно спаянные с передней брюшной стенкой участки кишки выделяют с париетальной брюшиной. Для рассечения штрангов целесообразно использовать инструмент с внутренним расположением ножа (электролигирующий инструмент «Atlas LigaSure»), что позволяет гарантированно избежать травмирования стенки кишечника (рис. 25.15).
После устранения причины непроходимости спавшийся отдел кишки заполняется газом и кишечным содержимым, что является при-
знаком адекватности проведенного лечения. Осложнения. Одним из наиболее вероят-
ных осложнений при экстренной лапароскопической операции по поводу спаечной тонкокишечной непроходимости является ятрогенное повреждение органов брюшной полости. Это связано с двумя факторами: наличием спаек между передней брюшной стенкой и подлежащими органами и перерастянутыми петлями кишечника. В таких обстоятельствах
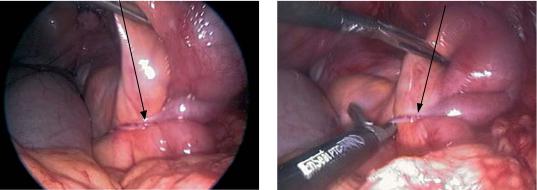
490 |
ГЛАВА 25. Эндоскопическая хирургия |
а |
|
б |
|
|
|
Рис. 25.15. Адгезиолизис:
а — единичный штранг (стрелка); б — рассечение штранга (стрелка)
первичное вхождение в брюшную полость |
Технические аспекты лечения. Первым |
||
(формирование пневмоперитонеума) уже не- |
этапом выполняют фиброколоноскопию для |
||
сет в себе опасность. В связи с этим выявление |
реканализации ее просвета и декомпрессии |
||
области брюшной полости, свободной от спа- |
толстой кишки. Методика заключается в сле- |
||
ек, и использование метода Хассона являются |
дующем: если по результатам фиброколоно- |
||
обязательными условиями при спаечной тон- |
скопии просвет кишки в области опухоле- |
||
кокишечной непроходимости. Во время разде- |
вой стриктуры достигает 3 мм и более, это с |
||
ления спаек следует остерегаться повреждения |
большой долей вероятности свидетельствует |
||
дилятированного кишечника. Возможна как |
о непротяженном опухолевом стенозе с не- |
||
механическая травма, так и термическое по- |
извитым опухолевым каналом. В таком случае |
||
вреждение при коагуляции. Наиболее опасно |
проводят однопросветную рентгеноконтраст- |
||
частичное повреждение стенки кишки при ко- |
ную трубку с шинирующим устройством |
||
агуляции, т. к. эта травма может быть сразу не |
(«Willson-Cook») проксимальнее уровня |
||
распознана. Следует помнить, что риск ослож- |
обтурации. Для подтверждения локализации |
||
нений при лапароскопии в условиях тонкоки- |
проксимального конца трубки выше стрикту- |
||
шечной непроходимости чрезвычайно высок, |
ры через ее просвет вводят водорастворимое |
||
а летальность при повреждении кишечника |
контрастное вещество (омнипак) с последу- |
||
достигает 15–20 %. |
ющим рентгенологическим контролем. После |
||
|
|
|
реканализации просвета кишки ее многократ- |
Минимально инвазивные |
но отмывают. При наличии просвета кишки |
||
в области опухолевой стриктуры диаметром |
|||
методыи |
лечения обтурационной |
менее 3 мм бужируют опухолевый канал с по- |
|
толстокишечной непроходимости |
мощью биопсийного форцепта («Olympus»). |
||
|
Показания: рак ободочной или прямой |
Это возможно при введении инструмента в |
|
|
сомкнутом виде проксимальнее уровня стрик- |
||
кишки, осложненный кишечной непроходимо- |
туры и его извлечение с приоткрытыми бран- |
||
стью. |
|
шами. Отсутствие угрозы перфорации стенки |
|
Противопоказания |
кишки при выполнении данной манипуляции |
||
определяется эндоскопическим и рентгеноло- |
|||
|
Перфорация опухоли. |
гическим контролем, а также гибкостью само- |
|
|
Продолжающееся кишечное кровотечение. |
го форцепта. После создания минимального |
|
|
Распространенный разлитой перитонит. |
просвета в области опухолевой стриктуры |
|
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
491 |
проводят струну-проводник выше зоны обтурации (под рентгенологическим контролем) и по ней устанавливают трубку с шинирующим устройством. Представленная методика позволяет выполнить декомпрессию толстой кишки за счет осуществления постоянного лаважа каловых масс из просвета кишки проксимальнее уровня обструкции и подготовить больного к радикальной лапароскопической операции.
В зависимости от локализации онкологического процесса используются стандартные варианты хирургических вмешательств из лапароскопического доступа.
1. При раке слепой и восходящей ободочной кишки, а также при опухоли правого изгиба ободочной кишки показана лапароскопическая правосторонняя гемиколэктомия с удалением регионарных лимфатических узлов и большого сальника. После мобилизации удаляемой части кишечника формируют анастомоз «бок в бок» линейным сшивающе-режущим аппаратом. Резецированный участок кишки удаляют из брюшной полости через мини-доступ в правой подвздошной области.
2.При раке поперечно-ободочной кишки делают резекцию поперечно-ободочной кишки с удалением большого сальника. После мобилизации кишки по срединной линии выполняют мини-лапаротомный доступ длиной 4–5 см, края раны изолируют резиновым рукавом, после чего на брюшную стенку выводят мобилизованный участок поперечно-ободочной кишки с опухолью. При этой операции наиболее целесообразно формирование ручного анастомоза «конец в конец».
3.При локализации онкологического процесса в нисходящей ободочной кишке показана левосторонняя гемиколэктомия с удалением большого сальника и лимфатических узлов по ходу нижней брыжеечной артерии. После пересечения кишки в левой мезогастральной области делают мини-лапаротомный доступ длиной 4–5 см, изолируют края раны от местного обсеменения резиновым рукавом, который помещают в рану, после чего на брюшную стенку выводят мобилизованный участок нисходящей и сигмовидной кишки с
опухолью. Анастомоз формируют открытым способом «конец в конец».
4.У пациентов с локализацией опухоли в сигмовидной кишке необходима резекция сигмовидной кишки с удалением регионарных лимфатических узлов у корня брыжейки в месте отхождения нижней брыжеечной артерии от аорты. После пересечения кишки в левой паховой области выполняют мини-лапаротомный доступ длиной 4–5 см, изолируют края раны от местного обсеменения резиновым рукавом, который помещают в рану, после чего на брюшную стенку выводят мобилизованный участок нисходящей и сигмовидной кишки с опухолью. После пересечения кишки в проксимальную часть нисходящей кишки вводят «грибок» сшивающего аппарата и фиксируют кисетным швом. Рану брюшной полости ушивают. Через анус вводят циркулярный сшивающий аппарат и под контролем лапароскопа проводятся до дистальной линии резекции. Формируют аппаратный колоректоанастамоз «конец в конец».
5.При раке ректосигмоидного отдела выполняют переднюю резекцию прямой кишки с удалением регионарных лимфатических коллекторов. Формирование анастомоза такое же, как при резекции сигмовидной кишки. При низкой передней резекции можно сформировать превентивную раз-
грузочную трансверзостому. Осложнения. Интаоперационные ослож-
нения при лапароскопической резекции ободочной кишки встречаются нечасто и связаны с техническими трудностями во время вмешательства или анатомическими особенностями организма пациента. Наиболее часто встречающимися осложнениями являются: внутрибрюшное кровотечение при мобилизации кишки или при повреждении магистральных сосудов; повреждение мочеточника; повреждение мочевого пузыря (чаще при передней резекции); повреждение двенадцатиперстной кишки в ходе мобилизации печеночного угла ободочной кишки; повреждение нижнего полюса селезенки при мобилизации левого угла ободочной кишки. Очень редко происходит повреждение n. cremaster.
492 |
ГЛАВА 25. Эндоскопическая хирургия |
Послеоперационные осложнения встречаются значительно реже по сравнению с открытой операцией. К ним относятся: несостоятельность межкишечного анастомоза с развитием перитонита; стеноз в области анастомоза; раневая инфекция в области мини-доступа, через который извлекается удаляемый препарат.
Ущемленные грыжи передней брюшной стенки
Показания
Ущемленная грыжа передней брюшной стенки.
Состояние после ущемления (при длительности ущемлении более 2 ч).
Подозрение на пристеночное (рихтеровское) ущемление (локальные боли в животе, неясная клиническая картина, отсутствие грыжевого выпячивания на брюшной стенке).
Противопоказания
Наличие ущемленной грыжи с явлениями кишечной непроходимости или перитонита.
Флегмона грыжевого мешка.
Грыжа передней брюшной стенки (> 40 % объема брюшной полости по данным гер-
ниоабдоминометрии)
Техника операции. Релаксация мышц передней брюшной стенки при комбинированном наркозе, а также создание пневмоперитонеума приводят к растяжению ущемляющего кольца в среднем у 70 % пациентов, что, в свою очередь, ведет к самостоятельному вправлению грыжевого выпячивания в брюшную полость. Если этого не происходит, то рассекают ущемляющее кольцо либо инструментом с внутренним расположением ножа («EnSeal» или «Atlas LigaSure»), либо ультразвуковыми ножницами. После вправления грыжевого содержимого в брюшную полость оценивают жизнеспособность органов, находящихся в грыжевом мешке. Далее после обзорной лапароскопии принимают решение о целесообразности продолжения эндохирургического вмешательства. Некроз большого сальника или сомнения в его жизнеспособности являются показанием к лапароскопической резекции в пределах здоровых тканей
Рис. 25.16. Диагностическая лапароскопия, ущемленная паховая грыжа с некрозом пряди большого сальника
Рис. 25.17. Вскрытие париетальной брюшины
(рис. 25.16). Признаки нежизнеспособности кишки: темная окраска, тусклая серозная оболочка, дряблая стенка, отсутствие перистальтики кишки и отсутствие пульсации сосудов ее брыжейки. При наличии этих признаков показаны конверсия и резекция участка кишки.
Если показаний к лапаротомии нет, принимаетсярешениеометодезакрытиягрыжевыхворот.
Для выполнения эндоскопической тран-
сабдоминальной предбрюшинной герниопластики (transabdominal preperitoneal — TAPP) при паховой грыже над грыжевыми воротами в поперечном направлении с помощью монополярной электрокоагуляции вскрывают париетальную брюшину на протяжении 10–15 см (рис. 25.17).
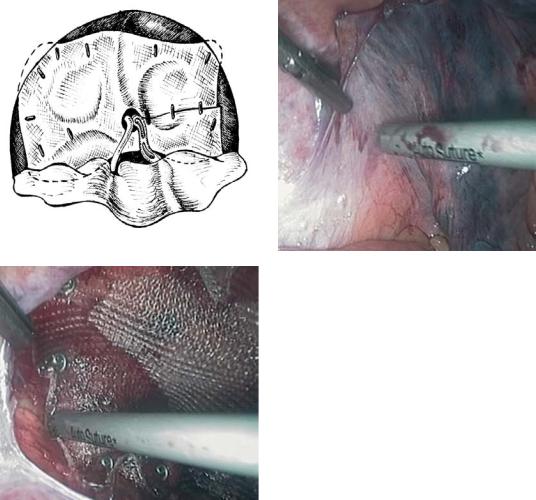
ХИРУРГИЧЕСКИЕ БОЛЕЗНИ |
493 |
а
б
Рис. 25.18. Фиксация синтетического имплантата:
а — схема; б — этап операции.
Осуществляют диссекцию предбрюшинного пространства, в ходе которой отслаивают брюшину, освобождают связочные структуры, выделяют грыжевой мешок, мобилизуют семенной канатик. Через 11 мм троакар в брюшную полость вводят синтетический имплантат, предварительно свернутый трубочкой, расправляют и при помощи эндогерниостеплера его фиксируют к предбрюшинной клетчатке (рис. 25.18).
После фиксации имплантат отграничивают от органов брюшной полости париетальной брюшиной (рис. 25.19).
Рис. 25.19. Перитонизация синтетического имплантата
Адекватной альтернативой является использование самоклеящейся сетки («Parieten Progrip»), что не требует эндогерниостеплера, а также позволяет сократить время операции и снизить ее стоимость.
При больших невправимых пахово-мошо- ночных грыжах методику TAPP дополняют отдельным доступом на мошонке с целью выделения грыжевого мешка. Этим снижаются травматичность и длительность операции.
Лапароскопическая пластика при срединных грыжах имеет следующие особенности: после того, как грыжевое содержимое вправляют в брюшную полость (рис. 25.20), грыжевые ворота ушивают при помощи «скорняжной» иглы через переднюю брюшную стенку, грыжевой мешок дренируют по Редону.
Через 11 мм троакар в брюшную полость вводят синтетический имплантат с антиадгезивным покрытием и при помощи эндогерниостеплера фиксируют к передней брюшной стенке вокруг грыжевых ворот в 8 точках по периметру (выходя за периметр грыжевых во-
рот на 3–4 см) (рис. 25.21).
Осложнения. После лапароскопической герниопластики в 2–3 % наблюдений в послеоперационном периоде отмечается скопление жидкости в над- и подсеточном пространстве. Серомы объемом более 30 см3 подлежат пункции под УЗ-наведением. Ввиду высокого риска

494 |
ГЛАВА 25. Эндоскопическая хирургия |
Рис. 25.21. Внутрибрюшинная пластика импланта-
том «Parietex Composite»
|
инфицирования имплантата дренировать се- |
|
рому не рекомендуется. |
|
Использование спиральных титановых |
|
скрепок при внутрибрюшинной фиксации им- |
|
плантата нецелесообразно ввиду возможности |
|
их контакта со стенкой кишки, что может вы- |
|
звать кишечную непроходимость или перфора- |
Рис. 25.20. Адгезиолизис и вид грыжевых ворот |
цию стенки кишки. |
