
2 курс / Нормальная физиология / Основы_физиологии_гемостаза_Струкова_С_М_
.pdfбыстрое включение петли RCL в середину складчатой структуры молекулы АТIII (β-sheet) и конформационные изменения серпина в более стабильное состояние.
Далее протеиназа, привязанная к петле реактивного центра серпина,
передвигается к противоположному концу молекулы ингибитора, теряет упорядоченную структуру и активность. Таким образом, конформационные сдвиги в молекуле серпина напоминают работу мышеловки, которая физически захлопывает протеиназу. Изменение от стрессированной (метастабильной)
формы серпина в релаксированное состояние сопровождается переходом в гиперстабильную форму молекулы, неактивную, латентную форму. При этом происходит необратимое ингибирование протеиназы.
Реакция инактивации протеазы АТIII происходит медленно, но прогрессивно ускоряется гликозаминогликанами (ГАГ) эндотелия и гепарином.
Поэтому АТIII носит название прогрессивного ингибитора.
Гепарин – гликозаминогликан (ГАГ) с мол. массой 5-20кДа, синтезируется в тучных клетках, часто локализованных вдоль сосудов, как сополимер гексозамина и глюкуроновой кислоты. На последней стадии синтеза остатки глюкозамина деацетилируются и N-сульфатируются, а остатки глюкуроновой кислоты эпимеризуются в стериоизомер – идуроновую кислоту, имеющую ассимметричный атом углерода. Кроме того, идуроновая кислота сульфатируется.
При активации тучных клеток гепарин освобождается из гранул клеток и может участвовать в регуляции гемостаза.
Гепарин катализирует инактивацию протеиназ, повышая скорость реакции более чем в 1000 раз. Драматическое повышение скорости ингибирования тромбина АТIII в присутствии каталитических количеств гепарина обусловлено связыванием этого полианиона с определенными остатками лизина (Лиз 114,
Лиз125, Лиз287), а также Арг 47, Про41, Трп49 N(амино)-конца АТIII,
формирующего гепаринсвязывающий домен (рис. 3-31).
111

Рис. 3-31
Схема инактивации тромбина антитромбином III (АТIII) в
комплексе с гепарином(H) – катализатором процесса.
Молекулярной основой высокого сродства гепарина к АТIII служит уникальный пентасахарид с 3-О-сульфатированным гликозамином в третьем остатке, который вызывает конформационную перестройку молекулы ингибитора, изменение в положении реактивного аргинина АТIII, благоприятствующее взаимодействию с тромбином и фактором Xa (рис. 3-32). Около 1/3 молекул гепарина содержат эту структуру и с высоким сродством связывают АТIII.
112

Рис. 3- 32
Уникальный пентасахарид гепарина с 3-О-сульфатированным гликозамином в третьем остатке.
Изолированный пентасахарид малоэффективен в катализе ингибирования свертывания. Для связывания АТIII и протеиназы требуется фрагмент гепарина из 18 моносахаридов. Это так называемый низкомолекулярный гепарин (НМГ),
который ингибирует преимущественно фактор Xa свертывания крови и тем самым останавливает процесс образования тромбина. При этом, чем короче цепочки молекулы гепарина, тем меньше ее способность образовывать комплексы с серпином, инактивирующие тромбин, и выше способность к избирательному блокированию активности только фактора Xa. Поэтому гепарины с низкой молекулярной массой (НМГ) ингибируют преимущественно фактор Xа, не вызывая при этом существенной нейтрализации тромбина. Один из них – Надропарин кальция (Фраксипарин) ( Мол. вес 4,3 кДа), у которого соотношение анти-Xa и антитромбиновой активности составляет 3,3:1, в то время как у гепарина – 1:1. Это позволяет добиться избирательного торможения свертывания на более ранней стадии процесса. Надропарин кальция получают с помощью контролируемой деполимеризации гепарина натрия из слизистой оболочки тонкой кишки свиней и последующей хроматографической очистки.
Надропарин кальция состоит из сульфатированных олигосахаридов, содержащих остатки 2,5-ангидро-D-маннитола в качестве концевых групп.
Нефракционированный гепарин (НФГ) долгое время оставался золотым
113
стандартом среди лекарственных средств с доказанной эффективностью в предупреждении и лечении как венозных, так и артериальных тромбозов и эмболий, в частности, при лечении острого коронарного синдрома.
Однако целый ряд ограничений и побочных эффектов, свойственных этому препарату, и, в первую очередь, короткий период полувыведения и необходимость постоянной внутривенной инфузии с лабораторным контролем,
низкая биодоступность, относительно высокая частота геморрагических осложнений, зависимость эффекта от уровня АТIII плазмы, синдром "рикошета"
при отмене, аллергенность и вызываемая им тромбоцитопения способствовали появлению нового класса антикоагулянтов с меньшей молекулярной массой.
Применение НМГ имеет ряд преимуществ перед НФГ: высокая антитромботическая активность при меньшем риске развития кровотечений;
высокая биодоступность и предсказуемость действия; отсутствие необходимости частого лабораторного контроля; относительно пролонгированное действие; менее выраженное влияние на функцию тромбоцитов и повышение высвобождения ингибитора пути тканевого фактора
(TFPI) эндотелием сосудов.
В настоящее время НМГ применяют при лечении тромбоза глубоких вен,
тромбоэмболии легочной артерии (ТЭЛА), острого коронарного синдрома,
нестабильной стенокардии, инфаркта миокарда и для профилактики тромбообразования у больных при операциях, а также для профилактики тромбоза в системе экстракорпорального кровообращения при гемодиализе и гемофильтрации.
Итак, при связывании АТIII с гепарином изменяется конформация молекулы АТ, повышается сродство к протеиназам. Существование в структуре АТIII двух участков связывания: реактивного, ответственного за связывание фермента, и домена, связывающего гепарин, подтверждено анализом заболеваний, вызванных врожденными дефектами молекулы АТIII. Замена Арг393 реактивного участка АТ III на Цис в АТ Норсвик Парк или на Гис в АТ Глазго приводила к блокированию способности ингибитора взаимодействовать с тромбином, что проявлялось в семейных тромбозах. Нарушения структуры домена, связывающего гепарин, вследствие замены Арг47 на Цис в АТ Тойома или на Гис в АТ Руан-1 также приводили к рецидивирующим тромбозам. Кроме того, с серьезными эпизодами тромбоза связаны конформационная
114
нестабильность (аномалии) в молекуле АТIII, когда реактивная петля ингибитора в интактной (нерасщепленной форме) включается в складчатую структуру молекулы (как это происходит при физиологической реакции включения расщепленной петли при связывании антитромбина с протеиназой).
Конформационная стабильность АТ возрастает при образовании комплекса с низкомолекулярным гепарином (НМГ), что делает НМГ антикоагулянтом первого выбора при лечении «конформационных» тромбозов.
3.2.1.2. Инактивация тромбина кофактором II гепарина (HCII)
Кофактор II гепарина (HCII) – эндогенный ингибитор тромбина. HCII,
также как и АТIII – ингибитор сериновых протеиназ (серпин). HCII
синтезируется гепатоцитами, секретируется в циркуляцию (в концентрации
1.0мкМ), обнаружен в интиме и медии артерий в норме и при повреждении их атеросклерозом. В отличие от АТIII, который инактивирует тромбин, ФXa, а
также IXa, HCII инактивирует только тромбин.
Уникальная особенность HCII ингибировать только тромбин обусловлена особенностями структуры серпина, а именно, наличием положительно заряженного участка молекулы молекулы. Этот участок образует бимолекулярный комплекс с ГАГ (гликозаминогликаном) – дерматан сульфатом или гепаран сульфатом эндотелия, изменяет конформацию молекулы и открывает отрицательно заряженный N- концевой домен (рис. 3-33).
115
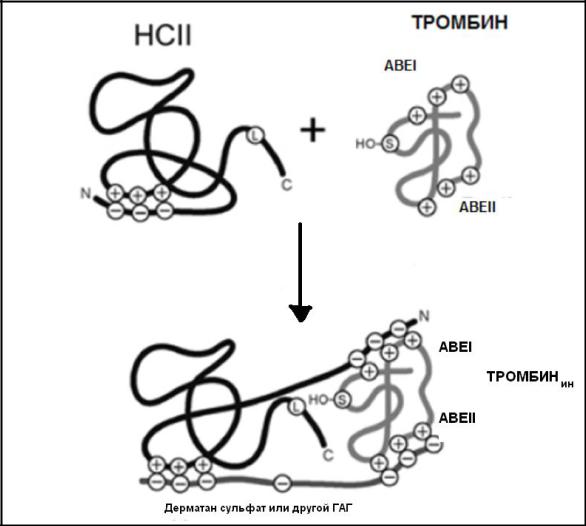
Рис. 3- 33.
Схема инактивации тромбина кофактором II гепарина (HCII).
Связывание HCII с гликозаминогликаном (ГАГ) – дерматан сульфатом или другим гликозаминогликаном (ГАГ ) сосудистой стенки приводит к структурным изменениям молекулы ингибитора , взаимодействию N-концевого домена HCII с анионсвязывающим экзосайтом I (АВЕI )тромбина и ускорению реакции ингибирования тромбина почти на 5 порядков. ГАГ связывает АВЕII
тромбина и формирует мостик между ферментом-тромбином и его ингибитором. S – Ser 195, активного центра тромбина; L – L444, реактивной петли , содержащей расщепляемую тромбином связь – Leu444-Ser.
116
Структура этого домена комплементарна анионсвязывающему экзосайту I (АВЕ1) тромбина. Связывание АВЕ1 тромбина с иммобилизованным на ГАГ
(дерматан сульфате) HCII приводит к эффективному расщеплению тромбином участка Leu 444-S в реактивной петле ингибитора HCII. Далее происходят конформационные изменения молекулы тромбина и его инактивация.
Связывание HCII с ГАГ клеток стенки сосуда приводит к ускорению реакции инактивации тромбина в 70000 раз. ГАГ -дерматан сульфат,
синтезируется и секретируется ГМК и фибробластами и откладывается в матриксе интимы и медии сосудов. Дерматан сульфат, связываясь с АВЕII
тромбина, образует мостик между ингибитором (HCII) и тромбином (рис. 3-33).
Локализация дерматан сульфата в интиме и медии и его способность связывать
HCII и тромбин позволяет ингибитору (HCII) защищать сосудистую стенку от действия тромбина при сосудистом ремоделировании.
3.2.2. Инактивация факторов Xa и VIIa ингибитором пути
тканевого фактора (TFPI).
Ингибитор пути тканевого фактора (TFPI) (син. ингибитор свертывания,
ассоциированный с липопротеином) впервые клонирован и охарактеризован по первичной аминокислотной последовательности молекулы в лаборатории Broze
(1988). Он блокирует самые первые реакции системы свертывания крови. TFPI
принадлежит к семейству трехглавых ингибиторов Кунитца (кунинов) и состоит из тандема трех доменов Кунитца (KU1, КU2 и КU3), из которых первый (КU1)
ингибирует фактор VIIa, связанный с тканевым фактором, а второй (КU2) –
фактор Xa. Третий домен TFPI не имеет ингибиторной активности к протеазам,
но в его структуре и в положительно заряженной С (СООН) – концевой последовательности молекулы локализован участок связывания гепарина и гепаран сульфата протеогликанов эндотелия, таких как синдеканы и глипиканы.
В основном, TFPI синтезируется клетками эндотелия сосудов и экспонируется на клеточную поверхность. Кофактор TFPI – протеин S системы протеина С,
синтезируется как и TFPI в эндотелии сосудов. Когда тканевой фактор
117
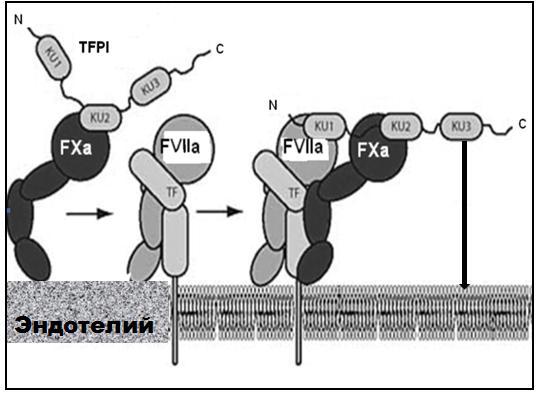
экспонируется на поверхности поврежденной стенки сосуда, TFPI ингибирует инициирование каскада свертывания следующим механизмом. Сначала TFPI
образует комплекс с фактором Xa (рис. 3-34).
Рис.3-34
Схема инактивации факторов Xa и VIIa ингибитором пути тканевого фактора (TFPI)
1. TFPI образует комплекс с фактором Xa (FXa). 2.Комплекс TFPI-FXa
связывает фактор VIIa и инактивирует комплекс тканевой фактор-фактор VIIa (TF-FVIIa). TFPI блокирует способность комплекса (TF-FVIIa) активировать фактор X, а также связываться и активировать клетки.
118
Этот комплекс связывается с отрицательно заряженными протеогликанами мембраны клеток и повышается локальная концентрация ингибитора, который связывает фактор VIIa и инактивирует комплекс тканевой фактор – фактор VIIa. TFPI блокирует способность комплекса тканевой фактор – фактор VIIa
активировать фактор X, а также связываться и активировать клетки через рецептор, активируемый протеиназами –2 (PAR-2).
3.2.3. Инактивация фактора Xa серпином, зависимым от
протеина Z (ZPI).
Впервые протеин Z был получен в 1977 году Plowse и Esnouf из плазмы быка и назван протеином Z, поскольку был последним белком, элюируемым с колонки при ионнообменной хроматографии факторов протромбинового комплекса. В 1984 году белок получен из плазмы крови человека. Структура молекулы протеина Z весьма подобна структуре факторов VII, IX, X и протеина С. Но в отличие от указанных факторов протромбинового комплекса в структуре, соответствующей типичному активному центру сериновых протеиназ,
отсутствуют гистидин и серин каталитической триады (Ser, His, Asp). Именно эта особенность явилась причиной того, что протеин Z, подобно протеину S, не имеет протеолитической активности. Основная функция протеина Z – служить кофактором серпина, ингибитора, зависимого от протеина Z (ZPI).
Ингибитор, зависимый от протеина Z (ZPI), является членом семейства серпинов и содержит тирозин (Tyr) в своем реактивном центре (в P1). В плазме
ZPI циркулирует в комплексе с протеином Z. ZPI ингибирует фактор Xa в
присутствии фосфолипидов и ионов Са, и скорость ингибирования возрастает в
1000 раз при наличии в системе протеина Z. Создана модель ингибирования фактора Xa ZPI. Согласно этой модели циркулирующий в плазме комплекс протеина Z – ZPI взаимодействует с фосфолипидной поверхностью активированных клеток через протеин Z, имеющий, как все белки протромбинового комплекса, Гла-домен. ZPI, связанный с поверхностью,
взаимодействует с фактором Xa и ингибирует его активность( Рис.3-35).
119

Рис 3-35
Схема инактивации фактора Xa, серпином, зависимым
от протеина Z
Ингибитор, зависимый от протеина Z( ZPI) –серпин, содержит тирозин в реактивном центре. ZPI образует комплекс с протеином Z(PZ) , на N-конце которого находится Гла-домен, связывающий комплекс с фосфолипидами эндотелия через Са мостик. ZPI-PZ комплекс инактивирует фактор Xa
свертывания крови.
Гепарин не оказывает влияния на ингибирование фактора Xa ZPI в
присутствии протеина Z. ZPI не ингибирует активности тромбина, факторов IXa, XIIa, каллекреина, протеина С, но способен ингибировать фактор XIa, причем для осуществления этой реакции не требуется протеин Z, фосфолипиды и ионы Са.
120
