
2 курс / Нормальная физиология / Основы_физиологии_гемостаза_Струкова_С_М_
.pdf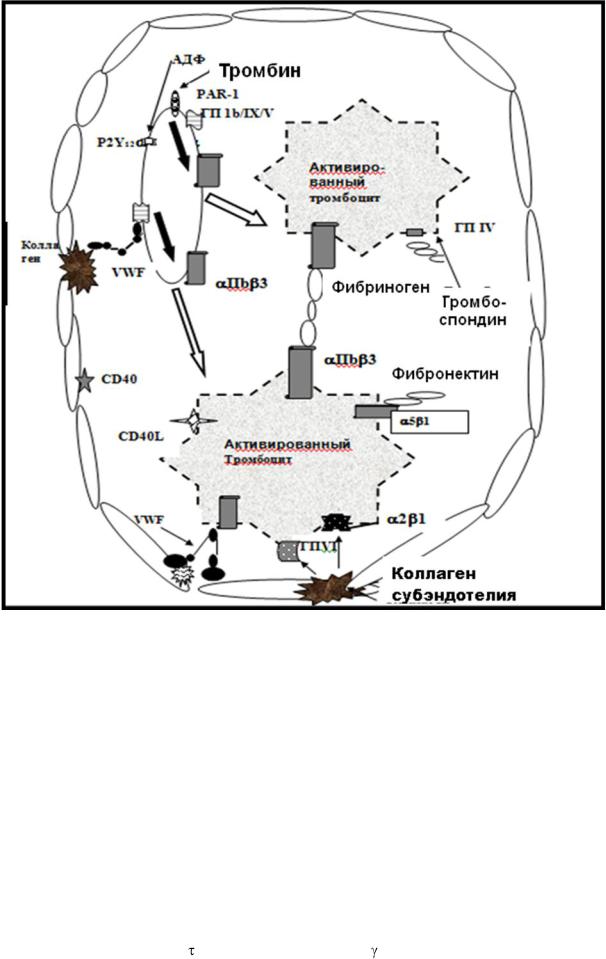
РИС. 1-5.
Модель лиганд-рецепторного взаимодействия при повреждении эндотелия сосуда и экспонировании фактора фон Виллебранда
Иммобилизованный фон Виллебранда фактор отвечает за адгезию тромбоцитов и их агрегацию в участке повреждения сосудов с высоким напряжением сдвига ( ) и скоростью сдвига ( ). Последняя отражает
31

различие в скоростях между слоями потока крови и выражается в единицах s-1 (обратных секундах). В нормальной циркуляции наибольшие величины скоростей сдвига в артериях и артериоллах находятся между 472
и 4712 s-1 (со средней величиной 1700 s-1). Однако скорости сдвига сильно возрастают (более чем на порядок) в стенозированных атеросклеротическими бляшками участках артерий. При существенной (до
90%) окклюзии коронарной артерии скорости сдвига могут возрасти до
20000-40000 s-1. Фактор фон Виллебранда обеспечивает адгезию и агрегацию тромбоцитов – начальные стадии формирования гемостатического тромба (пробки), в участках повреждения нормальных сосудов и, в тоже время, служит важным фактором патогенеза острой тромботической окклюзии стенозированных артерий.
Итак, фон Виллебранда фактор, иммобилизованный на коллагене субэндотелия, связывается с  цепями ГП Ib и ―привязывает‖ клетки,
цепями ГП Ib и ―привязывает‖ клетки,
выполняя функции ―мостика‖ между коллагеном и тромбоцитами
(рис. 1-5).
1.3.4.2. ГП Ib – рецептор фон Виллебранда фактора и тромбина
ГП Ib – интегрин, существует на поверхности интактных тромбоцитов в комплексе с ГП IX и ГПV (ГП Ib/IX/V) (рис. 1-6). ГП Ib
состоит из двух субъединиц: - (130kDa) и - (25 kDa) , связанных дисульфидным мостиком, и стабилизирован на поверхности интактных тромбоцитов нековалентной связью с двумя цепями ГП IX (22 kDa) и
одной цепью ГП V (82 kDa) (в отношении 2:2:2:1). Все компоненты комплекса относятся к типу I гликопротеинов, связанных с мембраной,
имеют в структуре повторы участков, богатых лейцином, и N- и С-
концевые петлевидные фланкирующие последовательности.
32
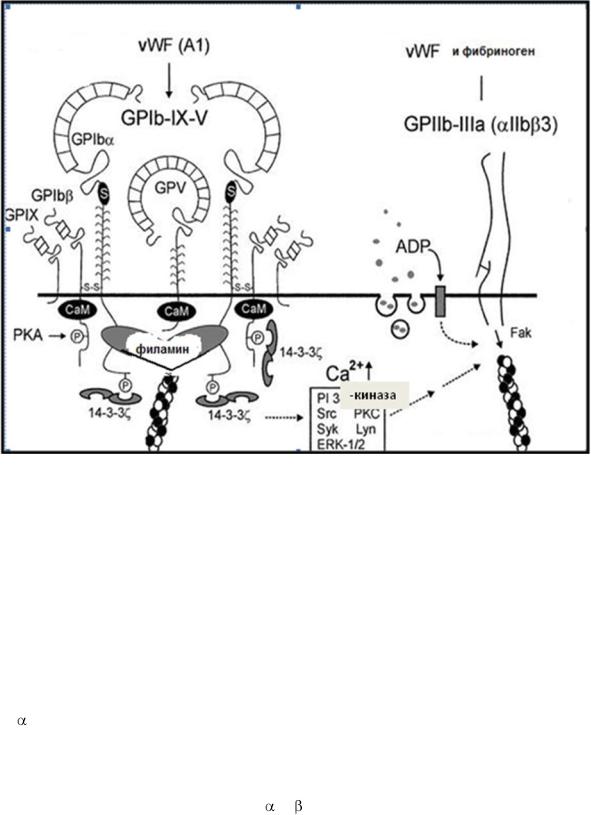
Рис 1-6
Структура комплекса ГП Ib/IX/V и схема активации рецептора ГП Ib
фактором фон Виллебранда.
ГП Ib – основная субъединица комплекса ГП Ib/IX/V, связывающая лиганды. ГП Ib содержит в N-концевой последовательности (1-282ао)
содержит в N-концевой последовательности (1-282ао)
перекрывающиеся, но разные участки связывания VWF, Р-селектина,
лейкоцитарного интегрина Мас-1 ( М/ 2, CD11b/CD18) ,
высокомолекулярного кининогена, а также протеиназ – тромбина и фактора XIa контактной фазы свертывания крови. Этот N-концевой глобулярный домен ГП Ib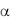 содержит тандем из семи повторяющихся участков, богатых лейцином, из которых повторы 2-4 связывают VWF, и
содержит тандем из семи повторяющихся участков, богатых лейцином, из которых повторы 2-4 связывают VWF, и
N- и С-концевые фланкирующие последовательности. Прикрепление VWF
33

к ГП Ib обеспечивается электростатическим взаимодействием отрицательно заряженного мотива, формируемого остатками 59-128
обеспечивается электростатическим взаимодействием отрицательно заряженного мотива, формируемого остатками 59-128
повторов ГП Ib , с комплементарным положительно заряженным мотивом А1 домена VWF.
Адгезия тромбоцитов, всегда экспонирующих на поверхность рецептор ГП Ib ( в комплексе ГП Ib/IX/V), к эндотелию повышена при мутациях в А1 домене молекулы VWF ( R1306Q или R1450Eзамены), характерных для болезни vWD (типа 2B).
ГП Ib имеет в структуре участки, отвечающие за его взаимодействие с тромбином.
Основной участок связывания тромбина, содержащий сульфатированные тирозины, локализован в N-концевом, связывающем лиганды домене, который следует за С-концевой фланкирующей последовательностью и предшествует центральной гликопептидной области ГП Ib .
Как показало исследование кристаллической структуры N-концевого домена ГП Ib , связанного с тромбином, две молекулы фермента взаимодействуют с рецептором: одна через анионсвязывающий экзосайт I
тромбина, а другая – через его экзосайт II (см. главу 2). Тромбин,
связываясь с ГП Ib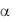 двумя участками своего центра узнавания, может служить мостиком между ГП Ib
двумя участками своего центра узнавания, может служить мостиком между ГП Ib одного и того же тромбоцита или близлежащих клеток. Кроме того, ГП Ib может связывать факторы XI, XII и высокомолекулярный кининоген (ВМК) контактной фазы свертывания крови и функционировать как корецептор факторов VIIa и XIa свертывания крови (см. главу 2).
одного и того же тромбоцита или близлежащих клеток. Кроме того, ГП Ib может связывать факторы XI, XII и высокомолекулярный кининоген (ВМК) контактной фазы свертывания крови и функционировать как корецептор факторов VIIa и XIa свертывания крови (см. главу 2).
1.3.4.3. Активация тромбоцитов фактором фон Виллебранда
Фактор фон Виллебранда, взаимодействуя с рецептором – ГП Ib (комплекса ГП Ib/IX/V), активирует клетки, стимулирует следующие
реакции: 1) экспонирование на мембране интегрина IIb/ 3,
34

2) распластывание тромбоцита, 3) секрецию агонистов агрегации – АДФ и тромбоксана А2 (ТХА2) (рис. 1-6).
Механизм передачи сигнала через ГП Ib внутрь клетки осуществляется двумя путями.
Один путь передачи сигнала через прямое взаимодействие цитоплазматического домена ГП Ib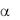 с белками цитоскелета,
с белками цитоскелета,
участвующими в передаче сигнала, такими как филамин и адапторный,
актинсвязываюший белок 14-3-3 . Цитоплазматические домены ГП Ibβ и
ГП V связывают калмодулин, ГП Ibβ-белок 14-3-3 , и все эти гликопротеины, как и ГП Ib , также ассоциированы с Src киназами и PI3-
, и все эти гликопротеины, как и ГП Ib , также ассоциированы с Src киназами и PI3-
киназами. Фосфорилирование определенных остатков серина в цитоплазматических доменах ГП Ib и ГП Ibβ регулирует связывание их с белком 14-3-3 цитоскелета, внеклеточное связывание фон Виллебранда фактора с ГП Ib , а также передачу сигнала внутрь клетки, зависимую от комплекса ГП Ib/IX/V.
цитоскелета, внеклеточное связывание фон Виллебранда фактора с ГП Ib , а также передачу сигнала внутрь клетки, зависимую от комплекса ГП Ib/IX/V.
Связывание VWF с ГП Ib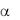 вызывает повышение концентрации внутриклеточного кальция ([Ca2+]i), изменение формы тромбоцита, его распластывание, активацию и экспонирование на поверхности клетки второго рецептора VWF – интегрина IIb/ 3 (ГП IIb/IIIа по устаревшей номенклатуре).
вызывает повышение концентрации внутриклеточного кальция ([Ca2+]i), изменение формы тромбоцита, его распластывание, активацию и экспонирование на поверхности клетки второго рецептора VWF – интегрина IIb/ 3 (ГП IIb/IIIа по устаревшей номенклатуре).
Другой путь передачи сигнала внуть клетки – через ассоциацию комплекса ГП Ib/IX/V с двумя ITAM (immunoreceptor tyrosine-based activatory motifs)-содержащими белками (Fc RIIa и FcR ). Связывание комплекса ГП Ib/IX/V с агонистом ведет к фосфорилированию ITAM
тирозина семейством syk киназ, активации фосфолипазы С (PLC),
(PLC),
протеинкиназы C (PKC) и повышению концентрации внутриклеточного кальция. Оба пути передачи сигнала через рецептор ГП Ib ведут к активации тромбоцита, освобождению агонистов агрегации тромбоцитов – АДФ, тромбоксана А2 (ТХА2), и экспонированию на поверхности клетки интегрина IIb/ 3 - рецептора фибриногена и VWF . Связывание интегрина IIb/ 3 с лигандами индуцирует активацию тромбоцита по механизму снаружи-внутрь (outside-in).
35

Итак, интегрин IIb/ 3 служит рецептором как фактора фон Виллебранда, так и фибриногена (рис. 1-5, 1-6). Большая часть интегринов
IIb/ 3 на активированных тромбоцитах оккупируется фибриногеном,
поскольку в плазме человека концентрация фибриногена на несколько порядков выше (около 9 M), чем фактора фон Виллебранда (около 1nM).
При недостаточности фибриногена или его отсутствии у пациентов с афибриногенемией фактор фон Виллебранда может поддерживать агрегацию тромбоцитов. Фактор фон Виллебранда отвечает за формирование достаточно стабильных агрегатов тромбоцитов в поврежденных сосудах с высоким напряжением сдвига и скоростью сдвига, как например в артериолах, тогда как один фибриноген не способен обеспечить в них агрегацию. О конкуренции фактора фон Виллебранда и фибриногена за связывание с экспонированным интегрином IIb/ 3 свидетельствует тот факт, что начальная скорость агрегации тромбоцитов выше в отсутствии фибриногена.
1.3.4.4. Интегрины – рецепторы адгезивных белков
Интегрин IIb/ 3 (ГП IIb/IIIа) – катионзависимый гетеродимерный комплекс, состоит из двух мембранных гликопротеинов типа I –
субединиц IIb и 3. Субединица IIb содержит тяжелую (GPIIba –125 kDa) и легкую цепи (GPIIbb-25 kDa), соединенные дисульфидной связью.
Трансмембранный домен и короткий цитоплазматический домен локализованы в легкой цепи IIb. Первичная структура IIb включает четыре внеклеточных мотива, связывающих двухвалентные катионы и цитоплазматический мотив GFFKR , которые важны для регуляции связывания лиганда. Субединица 3 (95 kDa) состоит из большого (692 ао)
внеклеточного домена, коротких трансмембранного (25ао) и
цитоплазматического (45ао) доменов. Цитоплазматический домен 3
содержит два мотива NXXY и четыре сайта расщепления кальпаином,
примыкающие к этим мотивам. Стабильная ассоциация между субединицами IIb и 3 обеспечивается взаимодействием их N- концевых участков.
36
Семейство интегринов обеспечивает связывание клеток с адгезивными белками сосудистой стенки – фактором фон Виллебранда, коллагеном,
фибронектином, ламинином, тромбоспондином и фибриногеном плазмы крови (табл. 1-3). Из всех адгезивных белков только фактор фон Виллебранда, связывая ГПIb в комплексе ГП Ib/IX/V, обеспечивает начальное прикрепление тромбоцитов к поврежденному субэндотелию в сосудах с высокой скоростью сдвига. Интегрины работают как рецепторные белки и регулируют клеточные функции.
Таблица 1- 3
Адгезивные белки, их рецепторы и лиганды в образовании
тромбоцитарных тромбов
Адгезивные белки |
Рецепторы |
Лиганды адгезивных |
||||
белков |
||||||
и субстраты |
|
|
|
|
||
|
|
|
|
|
||
|
|
|
|
|
||
Фактор фон |
ГП Ib |
|
|
фактор VIII |
||
Виллебранда |
|
|
|
|
коллаген (I-VI типы) |
|
|
IIb/ |
3 |
|
|||
|
|
|
|
|
фибрин |
|
|
|
|
|
|
гликозаминогликаны |
|
|
|
|
|
|
|
|
Коллаген |
|
|
ГП VI |
фактор фон Виллебранда |
||
|
|
|
||||
|
|
|
|
|
фибриноген |
|
|
|
|
2 |
1 |
|
|
|
|
|
|
|
фибронектин |
|
|
|
|
|
|
тромбоспондин |
|
|
|
|
|
|
||
Фибриноген/Фибрин |
IIb/ |
3 |
|
тромбин |
||
|
v |
1 |
|
|
фактор XIII |
|
|
v |
2 |
|
|
плазминоген |
|
|
|
|
|
|||
|
|
|
|
|
|
|
37

|
v |
3 |
t-PA |
|
|
|
фибронектин |
|
|
|
коллаген |
|
|
|
гепарин |
|
|
|
|
Фибронектин |
IIb/ 3 |
коллаген |
|
|
5 |
1 |
фибрин |
|
|
|
фактор XIII |
|
|
|
гепарин |
|
|
|
актин |
|
|
|
тромбоспондин |
|
|
|
|
Вслед за адгезией тромбоцитов к поврежденному сосуду с помощью мостика – фактора фон Виллебранда, происходит прямое взаимодействие тромбоцитов с коллагеном субэндотелия сначала через рецептор ГП VI, а затем через интегрин 2 1, что обеспечивает устойчивую адгезию, активацию и агрегацию клеток (рис. 1-5). Коллаген взаимодействует с рецептором ГП VI тромбоцита, который фосфорилируется src семейством тирозинкиназ. Передача сигнала внутрь клетки ведет к активации фосфолипазы С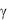 (ФЛС ), освобождению внутриклеточного посредника – внутриклеточного кальция ([Са2+]i), и
(ФЛС ), освобождению внутриклеточного посредника – внутриклеточного кальция ([Са2+]i), и
агониста агрегации – АДФ. В результате активации рецептора ГП VI
происходит конформационная перестройка второго рецептора коллагена – интегрина 2 1 (ГП Ia-IIa) в состояние высокого сродства к коллагену.
Эта реакция обеспечивает стабилизацию адгезии, распластывание тромбоцитов, их активацию и последующее экспонирование на поверхность тромбоцита интегрина IIb/ 3 (рис. 1-5). Интегрин IIb/ 3
связывает фибриноген и через этот мостик рекрутирует еще не адгезированные, но активированные тромбоциты. Фибриноген служит агонистом рецептора - интегрина IIb/ 3 и индуцирует активацию клеток
38

по механизму снаружи - внутрь.
Таким образом, на начальной стадии адгезии тромбоцитов к субэндотелию имеет место связывание фон Виллебранда фактора с ГП Ib
комплекса ГП Ib/IX/V на тромбоцитах, активация клеток. Коллаген субэндотелия предоставляет не только участок узнавания и прикрепления фон Виллебранда фактора к субэндотелию, но и активно взаимодействует со своими рецепторами на тромбоцитах – ГП VI и интегрином 2 1 , и
активирует адгезию и агрегацию клеток. На стадии распластывания происходит взаимодействие домена фон Виллебранда фактора,
содержащего пептид RGD, с интегрином IIb/ 3 . В последнюю стадию включаются только активированные тромбоциты, так как только после активации клеток происходит экспонирование интегрина IIb/ 3 на мембрану клетки и его связывание с адгезивными белками.
При адгезии тромбоцита через ГП Ib или IIb/ 3 к VWF,
иммобилизованному на коллагене субэндотелия генерируются разные кальциевые сигналы, кооперативно регулирующие поведение тромбоцита.
Одиночные кальциевые спайки, возникающие при активации ГПIb,
вызывают обратимую активацию тромбоцита, экспонирование на поверхность интегрина IIb/ 3 и непрочное прикрепление клетки к субстрату. Последующие устойчивые кальциевые осцилляции,
возникающие при активации IIb/ 3 адгезивными белками, обеспечивают прочную адгезию.
Итак, за адгезией клеток следует стадия агрегации активированных тромбоцитов. Склеивание клеток осуществляет фибриноген, рецептором которого на тромбоцитах служит интегрин IIb/ 3. Он образует мостики между клетками. На поверхности каждого активированного тромбоцита может находится от 40000 до 80000 копий рецептора – интегрина IIb/ 3,
и, поэтому, образуются очень большие агрегаты клеток в участке активации тромбоцитов. Но агрегаты недостаточно прочны.
В стабилизацию агрегатов вовлекаются другие адгезивные белки:
тромбоспондин и фибронектин (рис. 1-5). Тромбоспондин – один из основных белков внеклеточного матрикса. Существует по крайней мере 5
39

типов (TSP1-5) семейства тромбоспондинов с разными функциями в гемостазе, ангиогенезе, канцерогенезе.
Тромбоспондин-1 освобождается из гранул тромбоцитов. Подобно фактору фон Виллебранда тромбоспондин является модульным гликопротеидом. Молекула его состоит из трех мономеров. В структуре тромбоспондина идентифицированы домены, отвечающие за связывание фибриногена, коллагена, гепарина, фибронектина и клеток посредством реактивного пептида RGD. Основная функция тромбоспондина в гемостазе – стабилизировать связывание клеток с фибриногеном.
Тромбоспондин превращает обратимые комплексы в необратимые. Его рецепторы на тромбоцитах – ГП IV (СD36) и интегрин IIb/ 3 (ГП
IIb/IIIа). Тромбоспондин связывается с фибриногеном и с рецептором на тромбоцитах.
Фибронектин – основной компонент соединительнотканного матрикса,
имеет мультидоменную структуру. Его домены отвечают за связывание с коллагеном, фибрином, фактором XIII свертывания крови, гепарином,
актином, тромбоспондином и другими лигандами (табл. 3). Фибронектин относится к третьему типу белков, связывающих клетки, поскольку выполняет роль и структурного матрикса, и белка, связывающего клетки с матриксом. Молекулы фибронектина являются димерами, каждый из которых состоит из функциональных доменов. Аминоконцевой домен,
связывающий фибрин, образован из пяти блоков аминокислотной последовательности типа I. Последовательность типа III , содержащая пептид RGD, – основа домена, связывающего фибронектин с клеткой.
Синтезируются два варианта фибронектина: в мегакариоцитах,
предшественниках тромбоцитов, плазменный фибронектин, лишенный последовательности типа III и свободно циркулирующий в кровотоке; в
фибробластах синтезируется фибронектин, содержащий блок типа III,
связывающий клетки. Фибронектин легко полимеризуется и образует сеть нерастворимых фибрилл матрикса. На этом матриксе адгезируют клетки,
связываясь с реактивным доменом содержащим пептид RGD, аналогично связыванию клеток соответствующим пептидом в структуре фибриногена,
фон Виллебранда фактора, ламинина, витронектина и многих других адгезивных белков.
40
