
- •Аллергия
- •Иммунная система и аллергия
- •Классификация аллергенов
- •Принципы классификации аллергических реакций
- •Сенсибилизация. Методы и пути
- •Повышенная чувствительность (гиперчувствительность) немедленного типа (гчнт)
- •Повышенная чувствительность (гиперчувствительность) замедленного типа (гчзт)
- •Аутоаллергия
- •Аутоиммунная патология, обусловленная антигенами
- •Аутоиммунная патология, обусловленная антителами
- •I тип аутоиммунной патологии
- •II тип аутоиммунной патологии
- •III тип аутоиммунной патологии
- •Основные принципы диагностики аллергических реакций
- •Основные принципы профилактики и лечения аллергических заболеваний
Повышенная чувствительность (гиперчувствительность) немедленного типа (гчнт)
I. Иммунологическая стадия – аллергические антитела принадлежат к иммуноглобулинам Е (реагинам) и IgG. По Джеллу и Кумбсу – возможно три формы взаимодействия аллергена и антитела:
– реагиновый тип – гомоцитотропные антитела (в данном случае IgE) фиксированы на клетках-мишенях I порядка – в данном случае тучных клетках соединительной ткани (это при анафилактическом шоке). Комплемент не нужен;
– реакции цитотоксического типа – антитела циркулируют в крови, а антиген фиксирован на клетке, либо в качестве антигена выступают структуры клеточной мембраны. Реакция идет в присутствии комплемента. В первом случае патология возникает чаще при введении лекарств и лежит в основе лекарственной аллергии;
– реакции типа феномена Артюса, сывороточной болезни – антитела (в данном случае IgG) циркулируют в крови, антиген тоже циркулирует в крови, и взаимодействие между ними тоже происходит в крови. Реакция идет с присоединением комплемента. Преципитат выпадает в осадок в сосудистую стенку.
Второй вариант реакции возникает при введении антител в сыворотке. Такие сыворотки получили название цитотоксических сывороток или цитотоксинов. Основным в механизме цитотоксических реакций является цитолитическое разрушение клеток.
Первый тип аллергических реакций (реагиновый, или анафилактический тип). Особенностью этих реакций является то, что в ответ на первичное введение аллергена в организме вырабатываются антитела – реагины, которые фиксируются на клетках и тканях (прежде всего на тучных клетках и базофилах) данного вида животных, отсюда и название – гомоцитотропные антитела. При повторном попадании аллергена образуется комплекс аитиген + антитело, из клеток выделяются гистамин, гепарин, медленно реагирующая субстанция, серотонин, активируется кининовая система и др.
При характеристике реагинов можно выделить следующие их основные свойства: 1) молекулярный вес больше (8S – единиц Сведберга), чем у IgG (7S), циркулирующих в жидких средах организма; 2) фиксируются на тканях; 3) термолабильны; 4) реакция протекает без участия комплемента.
В настоящее время доказано, что реагины принадлежат к классу IgE. Систематическое иммунохимическое изучение стало возможно после открытия миеломного Е-белка. Основная биологическая функция IgE-антител заключается в таком связывании с клетками и тканями, которое обеспечивает феномен сенсибилизации. Эту функцию выполняет Fc-фрагмент молекулы IgE. Современные данные позволяют считать, что молекула IgE имеет принципиально то же строение, что другие мономерные иммуноглобулины, и состоит из двух легких и двух тяжелых цепей, соединенных друг с другом дисульфидными мостиками и ковалентными связями. Легкие цепи IgE аналогичны легким цепям других иммуноглобулинов. Тяжелые же цепи, в отличие от других иммуноглобулинов, характеризуются большей величиной (на один домен). Домен – гомологичные области или участки, представляющие компактные складчатые структуры, локализованные в тяжелых и легких цепях. В тяжелых цепях основной массы Ig содержится четыре домена, а в иммуноглобулинах Е –пять.


Рис. 51
Структура IgE
Отличает IgE и большее количество дисульфидных мостиков внутри цепи. Каждый домен включает около 100 аминокислотных остатков.
Приблизительно 60 из них входит в состав петли, которая образуется за счет –S–S – связи от полуцистеиновых остатков. По 20 аминокислот с каждой стороны оказывается вне петли и служит для соединения с аминокислотными остатками соседних доменов.
Наличие дополнительного домена и определяет способность иммуноглобулина фиксироваться на клеточной мембране.
Выработка гомоцитотропных антител при реакциях реагинового типа находится в тесной зависимости от дозы антигена (белка). Десятые доли микрограмма белка приводят к выработке Ig Е, при увеличении же дозы вырабатываются IgG.
Собственно ареной, на которой развиваются этого типа реакции, являются клетки организма. При этом выделяют клетки-мишени I и II порядка.
Клетки-мишени I порядка – это клетки, на которых фиксируются антитела. К ним относятся базофилы, тучные клетки соединительной ткани (а возможно, и гладкие мышцы). Могут они фиксироваться и на клетках кожи (в связи с чем, их называют кожносенсибилизирующими антителами).
Фиксация гомоцитотропиых антител (или IgE) осуществляется на тучных клетках и базофилах благодаря наличию на их поверхности специального рецептора (фиксирующего IgE). Рецептор – это белок с молекулярным весом 60 000 дальтон. К этому белку-рецептору удалось получить и антитела. При действии этих антител на рецептор развивается реакция, аналогичная таковой при действии аллергена. IgE же тормозит реакцию клетки на антитело к рецептору (принцип конкуренции).

Рис. 52
Взаимодействие антигена и IgE на тучной клетке
Таким образом, IgE фиксирован на мембране клетки. Антиген взаимодействует с близлежащими на мембране антителами, сближая их, вызывает аллостерическое изменение, которое способствует тесному контакту специфических аминокислотных остатков (обладающих основными свойствами) в неразвернутой полипептидной цепочке молекулы антитела с соответствующей зоной активации на клеточной мембране, отличной от зоны, фиксирующей молекулу антитела, то есть от рецептора иммуноглобулина. В зоне активации изменяются свойства мембран.
Именно этим объясняется, что из клеток выделяются не все медиаторы, а только 20–30% их, ибо выделяются-то они лишь в зонах активации мембраны – в деформированных ее участках.
Ориентация этой новой конформированной структуры на клеточной поверхности может быть облегчена в молекуле IgE нахождением в ней дополнительного домена. Активирующие группировки Fc-фрагмента содержат остатки лизина или аргинина, разделяются другими аминокислотными остатками (например, пролином), что позволяет соответствующим образом ориентировать их по отношению к зонам активации на клеточной мембране.
Изменения, происходящие на клеточной мембране вследствие соединения антигена с антителом, запускают каскад реакций, начальным этапом которых является, по-видимому, активация клеточных эстераз.
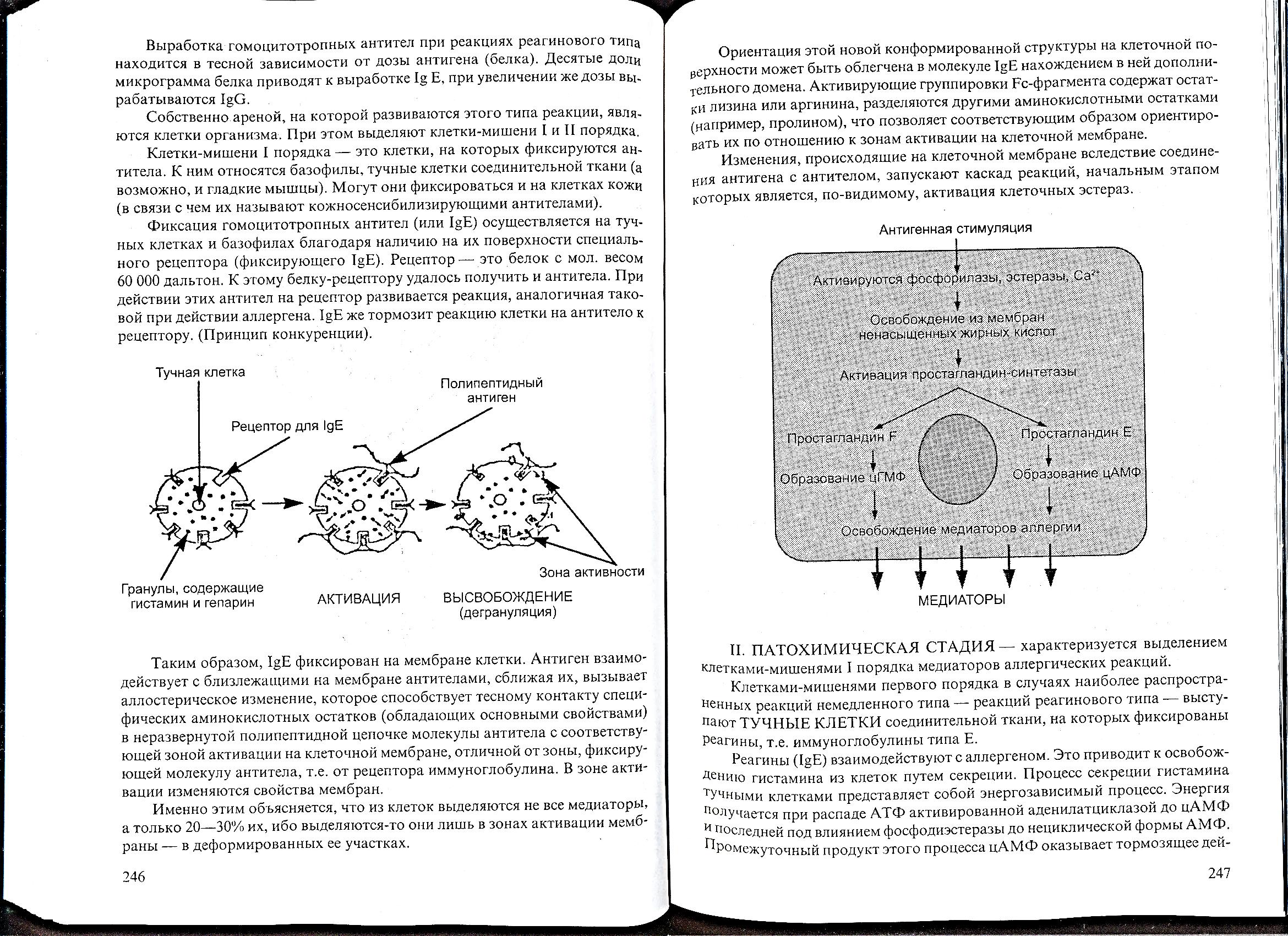
Рис. 53
Внутриклеточные механизмы секреции медиаторов аллергических реакций I типа
II. Патохимическая стадия характеризуется выделением клетками-мишенями I порядка медиаторов аллергических реакций.
Клетками-мишенями I порядка в случаях наиболее распространенных реакций немедленного типа – реакций реагинового типа – выступают тучные клетки соединительной ткани, на которых фиксированы реагины, то есть иммуноглобулины типа Е.
Реагины (IgE) взаимодействуют с аллергеном. Это приводит к освобождению гистамина из клеток путем секреции. Процесс секреции гистамина тучными клетками представляет собой энергозависимый процесс. Энергия получается при распаде АГФ активированной аденилатциклазой до цАМФ и последней под влиянием фосфодиэстеразы до нециклической формы АМФ. Промежуточный продукт этого процесса цАМФ оказывает тормозящее действие на секрецию гистамина. Пятикратное увеличение цАМФ в клетке снижает секрецию гистамина на 50%.
Гистамин вызывает спазм гладкой мускулатуры, повышает проницаемость сосудов, повышает гидрофильность соединительной ткани.
В пользу важной роли гистамина в реакциях немедленного типа можно провести сходство анафилактического шока и гистаминового шока:
1. Клиническое сходство.
2. Освобождение при анафилактическом шоке гистамина.
3. Эффективность антигистаминных препаратов.
Против гистаминной гипотезы реакций немедленного типа свидетельствуют следующие факты: 1) возбуждение нервной системы без участия гистамина как промежуточного звена при аллергии; 2) различия между эффектом действия фармакологического гистамина и гистамина, освобождающегося под влиянием его либераторов, и картиной анафилактического шока; 3) неэффективность антигистаминных препаратов при многих аллергических реакциях.
Все это позволяет считать, что в аллергических реакциях немедленного типа участвуют несколько биологически активных веществ.
Кроме гистамина в них принимает участие брадикинин (то есть кининовая система – схему ее активации мы рассматривали при воспалении). При аллергических реакциях активируется главным образом брадикинин плазмы под влиянием протеолитических ферментов калликреина плазмы. Брадикинин вызывает спазм гладкой мышцы и расширяет сосуды, вызывая падение артериального давления. Он повышает проницаемость сосудов и в этом плане в 10–15 раз активнее гистамина. Брадикинин вызывает спазм бронхов у животных и человека.
Простагландины – производные ненасыщенных жирных кислот. Синтезируются всеми клетками организма (за исключением эритроцитов). Повреждение клеток и тканей служит стимулом к синтезу простагландинов. Простагландины типа Е, присоединяясь к специальным рецепторам на тучных клетках, активируют аденилатциклазу, что приводит к возрастанию в клетке концентрации цАМФ, а она препятствует выделению гистамина. В то же время сами простагландины активируют выделение гистамина тучными клетками. Кроме того, сами простагландины влияют на гладкую мышцу бронхов: простагландин ¥2а оказывает констрикторное действие, а простагландины Е – дилятаторное.
Медленно реагирующая субстанция анафилаксии – МРС-А (SRS-A) – этим термином обозначают вещество или группу веществ, представляющих серосодержащие ненасыщенные жирные кислоты. МРС-А в основном выделяется тучными клетками. Аллерген стимулирует синтез МРС-А в тучных клетках. Освобождение МРС-А идет в присутствии ионов К+ и Са2+, без которых этот процесс значительно замедляется. Вызывает медленное сокращение гладкой мышцы, в отличие от гистамина.
Кроме перечисленных медиаторов в аллергических реакциях принимают участие и другие биологически активные вещества, которые, однако, не являются главными и обязательными.
Ацетилхолин принимает участие в реализации возбудительного процесса в холинергических иннервационных аппаратах.
Серотонин (у животных), освобождаясь из тучных клеток, играет определенную роль в аллергии. Действие – близкое к серотонину. У человека существенной роли в аллергии не играет.
Фактор хемотаксиса для эозинофилов освобождается из легких, гладких мышц, тучных клеток под влиянием Ig Е при аллергических реакциях немедленного типа. Под его влиянием в место реакции мигрируют эозинофилы, возрастает в крови количество эозинофилов. А эозинофилы могут поглощать при аллергических реакциях комплекс антиген – антитело. Кроме того, эозинофилы вырабатывают фактор, угнетающий аллергические реакции.
III. Патофизиологическая стадия аллергических реакций немедленного типа. Анализируя точки приложения в действии медиаторов аллергических реакций, можно выделить три главных патогенетических звена: 1) гладкомышечный компонент; 2) сосудистый компонент (повышение проницаемости стенки сосуда); 3) нервный компонент. Они могут быть по-разному выражены при различных аллергических реакциях немедленного типа.

Рис. 54
Общий механизм развития аллергической реакции немедленного типа, имеющий две фазы: развитие ранней фазы реакции, или классический путь (I), и развитие поздней фазы реакции (II)
В развитии ранней фазы реакции принимают участие лаброциты (тучные клетки) и базофилы, на которых фиксируются антитела-реагины (1). При присоединении к этим антителам соответствующих аллергенов (2) из тучных клеток высвобождаются медиаторы: гистамин, повышающий проницаемость сосудов и вызывающий спазм гладких мышц, эозинофильные хемотаксические факторы (ЭХФ), вызывающие хемотаксис эозинофилов, высокомолекулярный нейтрофильный хемотаксический фактор (ВНХФ), обеспечивающий хемотаксис нейтрофилов, тромбоцитактивирующий фактор (ТАФ), вызывающий агрегацию тромбоцитов и освобождение из них гистамина и серотонина. Активированные медиаторами эозинофилы выделяют вторичные медиаторы: диаминооксидазу (ДАО), арилсульфатазу (АС). Активированные нейтрофилы освобождают ТАФ и лейкотриены (ЛТ). В развитии поздней фазы реакции (II) принимают участие макрофаги, эозинофилы и тромбоциты. На них также фиксируют антитела-реагины (1). При соединении с соответствующим аллергеном (2) из клеток выделяются медиаторы, вызывающие повреждение и развитие воспаления, – катионные белки, активные формы кислорода (АФК), пероксидаза, а также тромбоцитактивирующий фактор (ТАФ), лейкотриен (ЛТВ4).
Собственно говоря, патофизиологическая стадия определяет клиническую картину аллергических реакций. Наиболее ярким проявлением ГЧНТ служит анафилактический шок, на примере которого мы и рассмотрим эту стадию.
Классическим объектом анафилактического шока является морская свинка. Анафилаксия – это повышенная чувствительность организма к повторному, парентеральному введению чужеродного белка. Свинку сенсибилизируют парентеральным введением 0,1–0,2 мл лошадиной сыворотки (доза, в 10 раз превышающая минимальную сенсибилизирующую дозу), но можно использовать и меньшую дозировку. Период сенсибилизации составляет 12–14 дней. Затем в циркуляцию вводят разрешающую дозу аллергена 1,0 мл той же сыворотки. Морской свинке ее лучше вводить внутрисердечно. Через несколько секунд после введения разрешающей дозы свинка начинает испытывать беспокойство, почесывать мордочку, на ней взъерошивается шерсть – нервный компонент. Затем появляется одышка – спазм бронхиол – непроизвольное мочеиспускание, дефекация – гладкомышечный компонент. Развиваются судороги. Свинка падает на бок. Кровяное давление сначала повышается, а затем падает – сосудистый компонент. Анафилактический шок характеризуется повышением тонуса парасимпатической нервной системы.
Животное погибает при явлениях асфиксии от паралича дыхательного центра. На вскрытии погибшей от анафилактического шока морской свинки находят очаги эмфиземы и ателектаза в легких, но, в общем, легкие эмфизематозно расширены, легкие закрывают сердце.
Таким образом, у морской свинки в клинике анафилактического шока преобладает спазм бронхиол.
В клинике анафилактического шока у различных животных преобладает поражение различных органов – причем эти органы характерны для вида животного. Это сформировало понятие о «шоковых органах» – то есть эго органы, поражение которых преобладает в клинике аллергической реакции. У кролика это расстройство кровообращения в малом круге (шоковый орган – сосуды малого круга), у собаки – жом портальной вены, у лошади – это кожа, у человека – легкие и кожа. Эти шоковые органы видоспецифичны.
По I типу протекают анафилактические реакции и атопии. Термин «атопия» происходит от греческого «атопос» – отклоняющийся от нормы, чуждый, необычный. Вначале предполагали, что подобное состояние у животных не встречается, но позднее его наблюдали у собак, у крупного рогатого скота и у других животных, в том числе у моржей.
В настоящее время под атопическими болезнями подразумеваются аллергические заболевания, обусловленные IgE В связи с общим патогенезом, их нельзя охарактеризовать специальной симптоматикой. Для атопии существует семейная предрасположенность, хотя способ наследования неясен. Причинами острого состояния являются спазм гладкой мускулатуры, гиперемия и отек. Кроме того, обнаруживаются изменения секреции желез (дискриния), моделируемые неспецифическими (вегетативными) факторами.
Наиболее распространенными атопическими болезнями являются: бронхиальная астма, аллергический ринит, конъюнктивит, целиалкия, атопический дерматит, отек Квинке, мигрени, эпилептические припадки, лихорадка (вызванная лекарствами), острая припухлость суставов, пилороспазм.
При дифференциальном диагнозе в пользу атопических болезней свидетельствуют семейная предрасположенность, повышенное содержание IgE в сыворотке крови, эозинофилия и временная связь между экспозицией (действием) аллергена и появлением реакции.
Хотя в основе атопии и анафилаксии лежит, по-видимому, один и тот же механизм, и мы их объединяем в одну группу реакций повышенной чувствительности немедленного типа (а в ряде руководств анафилаксия прямо включается в группу атопических болезней), тем не менее многие авторы считали, что между ними существуют серьезные различия. Сейчас же эти различия не кажутся столь значительными.
Однако имеет смысл все-таки сохранить оба термина: один для обозначения искусственно получаемых явлений, главным образом на животных, а другой – для естественно встречающихся проявлений, свойственных преимущественно людям, хотя последнее в значительной степени объясняется тем, что у животных мы обычно не пытаемся их обнаружить.
Таблица 11
Отличия анафилаксии от атопии
ПРИЗНАК |
АНАФИЛАКСИЯ |
АТОПИЯ |
Проявление |
Искусственно Индивидуально |
Спонтанно (то есть время сенсибилизации установить не можем) |
Роль наследственности |
Незначительная |
Выраженная |
Длительность десенсибилизации |
Недлительная |
Длительная |
Природа антигена |
Белки, углеводы |
Небелковые вещества |
Симптомы |
Сокращение гладких мышц |
Отек |
Патоморфология |
Шоковые органы видовые |
Шоковые органы индивидуальные |
Десенсибилизация |
Легкая |
Трудная |
II тип – реакции цито токсического типа. При реакциях этого типа антиген является либо частью клеточной мембраны, либо он прочно фиксирован на поверхности клеточной мембраны (например, лекарственные препараты). Антитела относятся к IgG. В реакции принимает участие комплемент. Роль комплемента сводится: 1) к цитолитическому повреждению клетки; 2) усилению фагоцитоза; 3) усилению воспаления.
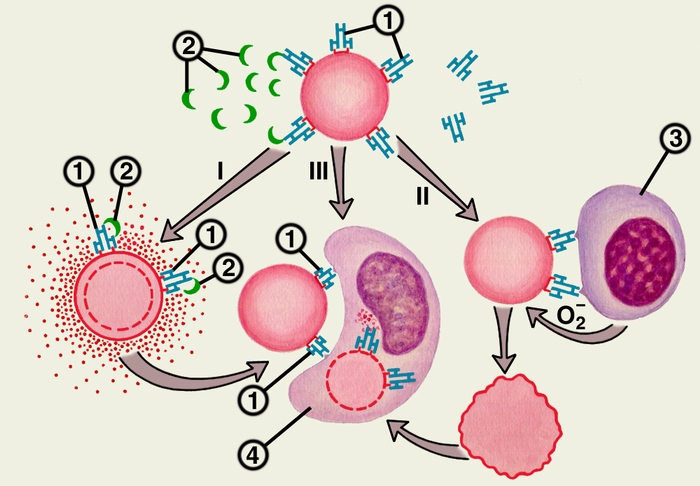
1
Рис. 55
Общий механизм развития аллергической реакции цитотоксического типа
1 – антитело, 2 – комплемент, 3 – NK-клетка, 4 – макрофаг.
В верхней части рисунка видна клетка с фиксированными на ней антителами (1), комплемент (2) изображен в виде полулуний. I – комплемент – опосредованная цитотоксичность обусловлена комплементом (2), присоединившимся к антителам (1), фиксированным на клетке-мишени. В результате активации комплемент вызывает повреждения мембраны клетки-мишени, что приводит к ее лизису. II – аитителозависимая клеточно-опосредованная цитотоксичность вызвана присоединением К-клеток (3), образующих супероксидный анион-радикал (О2-), повреждающий клетку-мишень (указано стрелкой). III – фагоцитоз опсонизированной антителами клетки-мишени происходит путем взаимодействия антител, фиксированных на клетке (1), с Fс-рецепторами фагоцита, поглощения клетки-мишени фагоцитом (4) и переваривания ее. Кроме этого, фагоциты поглощают клетки-мишени, поврежденные в результате комплемент-опосредованной (I) антителозависимой клеточно-опосредованной цитотоксичности (II).
Взаимодействие антигена с антителом и присоединение к комплексу комплемента вызывает повреждение клетки. Поврежденная клетка подвергается фагоцитозу макрофагами (но возможно участие нейтрофила, который пожирает комплекс аитиген + антитело с выделением лизосомальных ферментов). Освободившиеся при фагоцитозе лизосомальные ферменты повреждают другие клетки (они-то и выступают в качестве клеток-мишеней II порядка). Эти процессы усиливаются комплементом и кининами. В организме этот механизм включается при: 1) ликвидации изношенных клеток; 2) переливании крови; 3) беременности (IgG проходит через плаценту); 4) трансплантации органов и тканей; 5) опухолевом росте.
Возможность образования антител по отношению к клеточным элементам организма была впервые установлена Жюлем Борде́ (Bordet) в 1898 году. Он наблюдал, что кровяная сыворотка морской свинки, которой внутрибрюшинно повторно вводилась дефибринированная кровь кролика, обладает способностью гемолизировать кроличьи эритроциты, что, по его мнению, связано с выработкой в организме особых веществ гемолизинов.
Дальнейшие исследования показали, что при иммунизации организма клетками или органным или тканевым антигенным материалом возникающие антитела в организме иммунизированного животного не проявляют себя – их действие сказывается в повреждении соответствующих клеточных элементов после введения в организм животного того же вида, от которого взят материал для иммунизации. Упомянутую категорию антител принято называть цитотоксинами.
Впервые физиологический эффект цитотоксинов был продемонстрирован в лаборатории И.И. Мечникова, в которой было найдено, что малые дозы гемолитической сыворотки стимулируют эритропоэз (И. Кантакузен). (Cantacuzene), а лейкотоксина – лейкопоэз (А.М. Безредка).
Большой вклад в изучение проблемы внес А.А. Богомолец, который в своей диссертации на примере цитотоксической сыворотки к надпочечникам показал два кардинальных свойства цитотоксинов: 1) их высочайшую специфичность; 2) различный эффект малых и больших доз цитотоксинов. Малые дозы стимулируют, а большие угнетают функцию тех органов, к клеткам которых они получены. Вероятно, малые дозы прежде всего повреждают стареющие и отмирающие клетки, а при введении больших доз – уже и функционально полноценные клетки.
Казалось бы, открывалась широкая перспектива применения цитотоксинов в клинической практике в плане целенаправленного воздействия на отдельные органы и ткани. Однако в настоящее время эти сыворотки применяются только для целей экспериментального избирательного повреждения отдельных органов (почек, печени, сердца и др.). В клинической практике широко применялись лишь две сыворотки: антиретикулярная цитотоксическая сыворотка (АЦС) А.А. Богомольца, антилимфоцитарная цитотоксическая сыворотка (АЛС) или очищенный ее препарат – антилимфоцитарный глобулин (АЛГ).
АЦС получают путем иммунизации лошадей клетками селезенки и костного мозга погибших скоропостижно и не страдавших инфекционными болезнями. Ее применяли в терапии инфекционных заболеваний для стимуляции заживления ран, в психиатрии при лечении болезней, сопровождающихся понижением функции соединительной ткани (шизофрения, прогрессивный паралич), для продления жизни (А.А. Богомолец связывал старение с состоянием соединительной ткани).
АЛС или АЛГ применялись для подавления иммунной системы при трансплантации органов и тканей (применяли при пересадке сердца Кристиан Бернард – пересадка Блайбергу и Вакшанскому, академик В.И. Шумаков). Однако с появлением новых иммунодепрессантов ценность их использования значительно снизилась.
III тип – реакции типа феномена Артюса. Особенность таких реакций определяется тем, что аллерген растворим в крови, антитело циркулирует в крови.
В жидких средах организма образуется растворимый комплекс антиген + антитело, на который садится комплемент, комплекс выпадает в осадок под эндотелий сосудов, к нему мигрируют нейтрофилы, они фагоцитируют комплекс, часть клеток разрушается, в результате чего освобождаются лизосомальные ферменты.
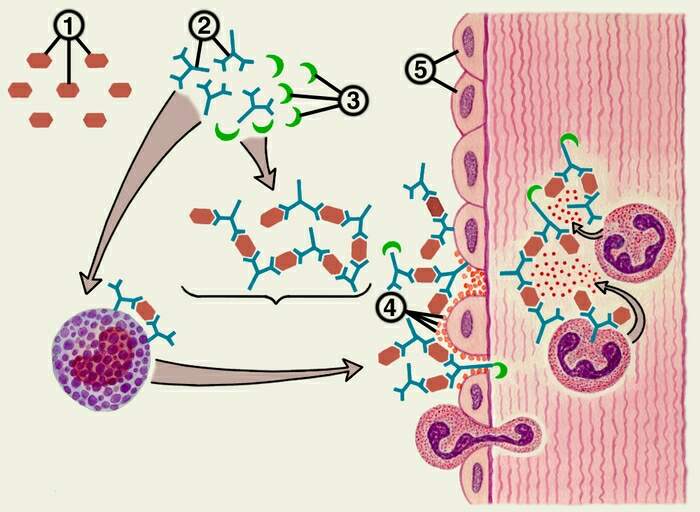
Рис. 56
Общий механизм развития аллергической реакции иммунокомплексного типа
1 – антиген, 2 – антитело, 3 – комплемент, 4 – агрегация тромбоцитов, 5 – эндотелиальные клетки.
Иммунный комплекс, образованный в результате соединения антигена (1) с антителом (2), откладывается в стенке сосуда. На нем фиксируется комплемент (3). Комплексы фагоцитируются нейтрофилами, которые выделяют лизосомальные ферменты (указано стрелками). Повышению проницаемости способствует освобождение базофилами гистамина и тромбоцитактивирующего фактора, который вызывает агрегацию тромбоцитов (4) на эндотелиальных клетках (5) и стимулирует выделение из тромбоцитов гистамина и серотонина.
Оказалось, что аллергическая реакция определяется целым рядом процессов – в том числе и видом образующегося комплекса. Для формирования подходящего комплекса необходимо проведение реакции в избытке антигена (что характерно для любой аллергической реакции), так как в избытке антител быстро образуется крупный комплекс, который быстро фагоцитируется клетками системы фагоцитирующих мононуклеаров (СФМ). Для того чтобы комплекс начал откладываться в тканях, он не должен быть меньше 19 S (единиц Сведберга по скорости седиментации), так как в последнем случае в осадок не выпадает. Второе важное условие – повышение проницаемости сосудистой стенки, в развитии которой важную роль играет не гистамин, а серотонин, освобождающийся из тромбоцитов.
В крови всегда при этой реакции есть небольшие количества IgE (реагинов), они фиксируются на базофилах и тучных клетках. При взаимодействии с ними антигена из базофилов выделяется вещество, действующее на тромбоциты, что приводит к освобождению серотонина, повышающего проницаемость сосудов, в результате создаются благоприятные условия для отложения комплекса антиген + антитело + комплемент.
К отложившемуся комплексу подходят нейтрофилы, фагоцитируют его и начинают выделять лизосомные ферменты – вещества, вызывающие хемотаксис макрофагов. К этому месту начинают двигаться макрофаги. Комплекс выпадает прежде всего в почках (больные системной красной волчанкой погибают от уремии), суставах, легких, коже.
Реакция не развивается у животных с экспериментальной нейтропенией (не развивается повреждение), при разрушении 3-го компонента комплемента ядом кобры (тоже нет повреждения ткани).
Под влиянием протеолитических ферментов (патохимическая фаза) формируется местное повреждение тканей, следствием чего будет развитие воспаления (патофизиологическая стадия).
Наиболее яркие представители реакций этого типа – феномен Артюса и сывороточная болезнь.
Феномен Артюса – подкожное введение кролику 0,5–1,0 мл лошадиной сыворотки с интервалом пять-шесть дней несколько раз. При первом введении белок быстро рассасывается, однако с каждой последующей инъекцией замедляется рассасывание введенного белка, а через четыре-пять дней введений возникает интенсивно некротическая реакция кожи.
Сывороточная болезнь – возникает как при повторном, так и при первичном введении сыворотки. В первом варианте первая доза сенсибилизирующая, а вторая – разрешающая, после которой реакция развивается уже на конце иглы. При первичном введении реакция формируется на пятый-шестой день, когда в организме еще достаточно антигена из-за медленного выведения из организма, но уже наработалось достаточно антител (рис. 57).
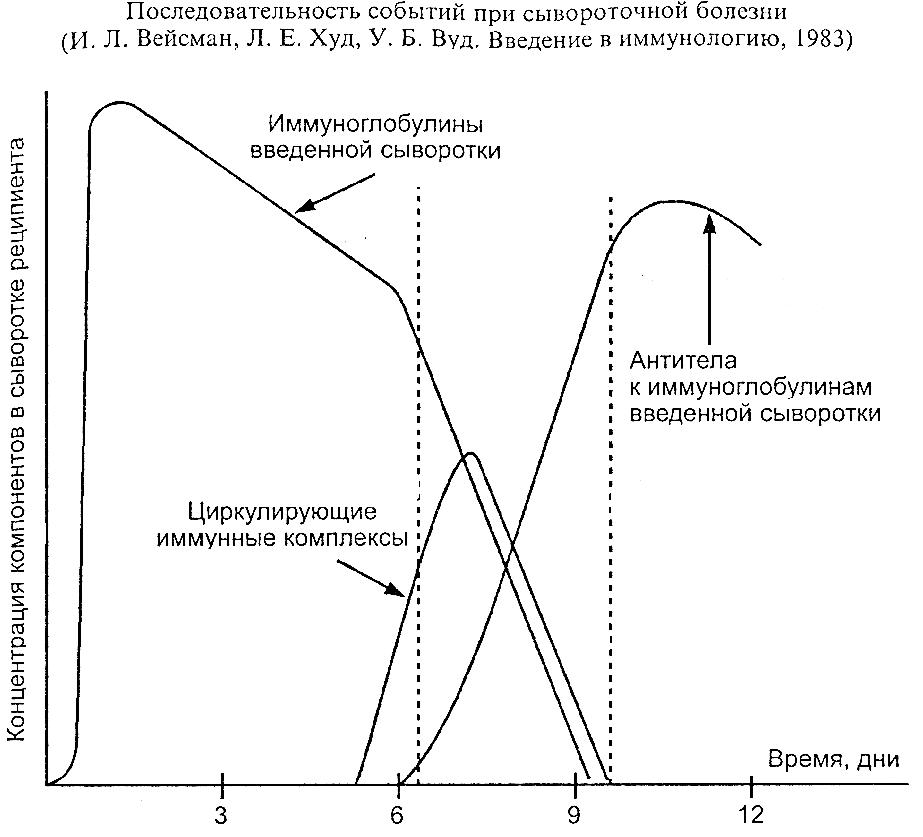
Рис. 57
Последовательность событий при сывороточной болезни (И.Л. Вейсман, Л.Е. Худ, У.Б. Вуд. Введение в иммунологию, 1983)
