
- •1. Первый закон термодинамики
- •2. Тепловые эффекты химических процессов
- •3. Закон гесса и следствия из него
- •1.Тепловой эффект обратного процесса равен по величине тепловому эффекту прямого процесса, но с противоположным знаком.
- •2. Тепловой эффект кругового процесса равен нулю.
- •4. Энтропия. Второй и третий законы термодинамики
- •5. Энергия гиббса
- •Энтальпийный и энтропийный факторы и направление процесса
- •Влияние температуры на направление реакции
- •Стандартная энергия Гиббса образования.
- •6. Константа равновесия и изобарно–изотермический потенциал реакции
- •7. Термохимические измерения и вычисления
- •8. Лабораторные работы
- •8.1. Определение энтальпии реакции нейтрализации
- •8.2. Определение энтальпии реакции присоединения кристаллизационной воды к безводной соли (энтальпия гидратации)
- •8.4. Определение энтальпии образования соли
- •9. Вычисления энергии связи по тепловому эффекту
- •10. Контрольные вопросы
- •11.Тестовые задания для самопроверки по теме:
- •12. Примеры решения задач
- •13. Рекомендации для самостоятельной работы студентов
- •14.Требования к знаниям и умению
- •Сыркин Алик Михайлович
- •Редактор л.А.Маркешина
- •Тираж 600 экз. Заказ
5. Энергия гиббса
Самостоятельно, т.е. без затрат работы извне, система может переходить только из менее устойчивого состояния в более устойчивое. В химических процессах одновременно действуют две тенденции: стремление частиц объединиться за счёт прочных связей в более сложные, что уменьшает энтальпию системы, и стремление частиц разъединиться, что увеличивает энтропию. Иными словами, проявляется действие двух прямо противоположных факторов – энтальпийного (ΔН) и энтропийного (TΔS). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса G или изобарно–изотермического потенциала.
Энергия Гиббса G – величина, названная так в честь американского учёного Дж. Уилларда Гиббса (1839–1903), одного из основоположников химической термодинамики.
Согласно ΔН = ΔG + TΔS теплота TΔS идет на создание беспорядка (бесполезно рассеивается в окружающую среду) и потому не может быть использована для совершения работы; её часто называют связанной энергией. Теплота ΔG может быть использована для совершения работы, и поэтому энергию Гиббса часто называют также свободной энергией:
ΔG = ΔН – TΔS
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса.
Условием принципиальной возможности процесса является неравенство ΔG<0.
Иными словами, самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии системы больше, чем в конечном. Увеличение энергии Гиббса
ΔG>0
свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях. Если же
ΔG=0,
система находится в состоянии химического равновесия.
Энтальпийный и энтропийный факторы и направление процесса
В соответствии с уравнением
ΔG = ΔН – TΔS
самопроизвольному протеканию процесса способствует уменьшение энтальпии и увеличение энтропии системы, т.е. когда ΔН<0 и ΔS>0.
При других сочетаниях характера изменений Н и S возможность процесса определяет либо энтальпийный, либо энтропийный фактор.
Рассмотрим две следующие реакции:
CaO (к) + СО2 (г) = CaCO3 (к)
ΔНо298 = –178,0 кДж, ΔSо298 = –160,48 Дж/К
ΔGо298 = –130,2 кДж
CaCO3 (к) = CaO (к) + СО2 (г)
ΔНо298 = 178,0 кДж, ΔSо298 = 160,48 Дж/К
ΔGо298 = –62,7 кДж
Первая реакция экзотермическая, протекает с уменьшением объёма. Возможность этой реакции (ΔG<0) определяется действием энтальпийного фактора, который перекрывает противодействие энтропийного фактора (по абсолютному значению |ΔН| >|TΔS|).
Вторая реакция эндотермическая, протекает с увеличением объёма. Возможность этой реакции (ΔG<0), наоборот, определяется энтропийным фактором. При высокой температуре энтропийный фактор перекрывает энтальпийный фактор (т.е. |ΔН| < |TΔS|) и реакция протекает самопроизвольно.
Влияние температуры на направление реакции
Согласно уравнению ΔG = ΔН – TΔS влияние температуры на ΔG определяется знаком и величиной ΔS. На рис. 2 показана зависимость ΔG ряда реакций от температуры. Если пренебречь влиянием Т на значения ΔН и ΔS, то приведённая зависимость ΔG =ƒ(T)
я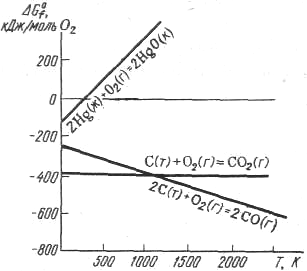 вляется
уравнением прямой, наклон которой
определяется знакомΔS.
На рис. 2 при ΔS>0
прямая идет вниз, при ΔS<0
– вверх. Для реакции
вляется
уравнением прямой, наклон которой
определяется знакомΔS.
На рис. 2 при ΔS>0
прямая идет вниз, при ΔS<0
– вверх. Для реакции
2C (графит) + O2 (г) = 2СО (г), ΔS>0,
протекающей с увеличением энтропии, повышение температуры приводит к увеличению отрицательного значения ΔG. Высокотемпературный режим благоприятствует протеканию процесса. Для реакции 2Hg (ж) + O2 (г) = 2HgO (к), ΔS<0,
Рис. 2. Зависимость ΔG ряда
оксидов от температуры
протекающей с уменьшением энтропии, с повышением температуры отрицательное значение ΔG уменьшается. Следовательно, в этом случае высокотемпературный режим препятствует протеканию процесса. При соответствующей температуре ΔG приобретает положительное значение, и тогда реакция должна протекать в обратном направлении. Как видно на рис. 2, изменение знака ΔG для этой реакции достигается при 500 К. Выше этой температуры реакция протекает в обратном направлении:
2HgO (к) = 2Hg (ж) + O2 (г), ΔS>0
Таким образом, при низкотемпературном режиме (до 500 К) ртуть окисляется кислородом, в то время как при высокотемпературном режиме (выше 500 К) оксид ртути распадается с выделением кислорода. Эти процессы можно использовать для получения кислорода в лаборатории.
Если же при протекании процесса энтропия системы не изменяется, то значение ΔG от температуры практически не зависит. Так, для реакции
C (графит) + O2 (г) = СО2 (г), ΔS≈0
зависимость ΔG =ƒ(T) на рис.2 изображена прямой, практически параллельной оси абсцисс.
Процессы, протекающие с уменьшением энтальпии (ΔН < 0) и увеличением энтропии (ΔS > 0), практически необратимы. В этом случае ΔG всегда будет иметь отрицательное значение, какую бы температуру ни приняли.
