
- •Ферменты. Строение, механизм действия, классификация.
- •3.1. Энергия активации. Катализаторы
- •3.1.1. Ферменты как биологические катализаторы
- •3.2. Отличие ферментов от неорганических катализаторов
- •3.3. Условия действия ферментов в клетке
- •3.4. Строение ферментов
- •3.5. Активный центр ферментов
- •3.5.1. Особенности функционирования активного центра
- •3.5.2. Особенности состава и структуры активного центра
- •3.6. Механизм действия ферментов
- •3.6.1. Ферменты понижают энергию активации химической реакции
- •1) Как и любые катализаторы, ферменты повышают скорость химической реакции за счёт снижения энергии активации реакции (энергетического барьера) реакции.
- •1. Первая стадия: образование фермент-субстратного комплекса, т. Е. Присоединение субстрата к макромолекуле фермента.
- •3.7. Внутриклеточное распределение ферментов
- •3.8. Классификация и номенклатура ферментов
- •2. Трансферазы - ферменты, ускоряющие реакции переноса органических радикалов или целых молекулярных остатков с одного соединения на другое.
- •3. Гидролазы - ферменты катализируют расщепление внутримолекулярных связей при помощи молекул воды:
3.3. Условия действия ферментов в клетке
В принципе клетка использует те же самые химические реакции, что и химик в своей лаборатории.
Однако на условия протекания реакций в клетке накладываются жесткие ограничения:
1) все реакции в клетке протекают в водном растворе;
2) при постоянной температуре (~37°С);
3) при постоянном давлении (~1 атм.);
4) при значениях pH, близких к нейтральным (pH 6,5 - 7,5).
Именно поэтому очень часто реакции, которые в лабораторных условиях можно провести в одну стадию, в живой клетке протекают через множество стадий.
Например, проведение в естественных условиях реакции образования воды из водорода и кислорода:
2H2 + O2 → 2H2O + взрыв (гремучий газ);
сопровождается взрывом из-за огромного количества выделившейся энергии. Избежать взрыва можно при проведении реакции в следующих условиях:
- в несколько стадий,
- в присутствии катализаторов;
- и при постоянном отведении теплоты от системы.
Это позволяет в значительной мере снизить энергию активации и провести реакцию при нормальных условиях.
Именно благодаря разделению на стадии в клетке эта же реакция протекает при постоянной температуре (~37°С). При этом выделяющаяся энергия реакции запасается в виде молекул АТФ.
3.4. Строение ферментов
Для ферментов характерны все закономерности строения, присущие белкам.
Все ферменты относятся к глобулярным белкам, причём, они могут иметь как третичную, так и четвертичную структуру.
По составу молекулы ферменты могут быть простыми и сложными.
Простые ферменты состоят только из полипептидной цепи, характеризующейся наличием третичной глобулярной структуры.
Сложные ферменты состоят из белкового и небелкового компонента.
Белковая часть сложного фермента называется апоферментом.
По характеру связи небелковой части с апоферментом небелковые компоненты сложных ферментов подразделяются на коферменты и простетические группы.
Коферментом называется небелковая часть, которая соединяется с белковой частью фермента посредством слабых нековалентных взаимодействий: гидрофобных, ионных и водородных связей.
Простетической группой называется небелковая часть, прочно связанная с белком ковалентной связью.
Коферменты и простетические группы принимают непосредственное участие в процессе ферментативного катализа.
Роль коферментов выполняют:
- большинство водорастворимых витаминов (или их химически модифицированные производные);
- соединения, построенные с участием витаминов;
- нуклеотиды и их производные;
- фосфорные эфиры некоторых моносахаридов;
- ионы металлов железа, меди, магния, марганца, кальция, цинка.
Характерной особенностью сложных ферментов является то, что ни белковая часть, ни кофермент или простетическая группа в отдельности часто не обладают заметной каталитической активностью.
!!!! Только их комплекс проявляет ферментативные свойства.
3.5. Активный центр ферментов
Ферментативный катализ идёт на поверхности фермента (Рис. 3.2):
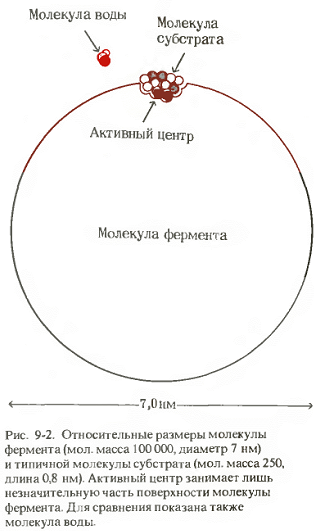
Рис. 3.2. Относительные размеры молекулы фермента (мол. масса 100 000 Da, диаметр 7 нм) и типичной молекулы субстрата (мол. масса 250 Da, диаметр 0,8 нм). Активный центр занимает лишь незначительную часть поверхности молекулы фермента. Для сравнения показана также молекула воды.
Введём понятие «субстрата» и «активного центра» фермента.
Субстратом называется вещество, которое подвергается превращению в результате ферментативной реакции.
Активным центром называется область ферментативной молекулы, в которой происходит связывание и превращение субстрата.
