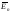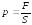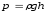- •Свириденко о.Ф Конспект лекцій з фізики
- •Основи молекулярної фізики
- •Частина і. Основи молекулярно-кінетичної теорії
- •Тема 1. Основні положення і поняття мкт будови речовини
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 2. Властивості ідеального газу
- •3. Мікропараметри газу
- •2. Наслідки ор мкт іг
- •7. Види термодинамічних процесів
- •Приклади розв’язування задач
- •8. Методика розв’язування графічних задач на ізопроцеси
- •Питання для самоперевірки
- •Тема 3. Властивості пари
- •1. Властивості випаровування
- •2. Випаровування рідини у герметично закритій посудині
- •3. Властивості насиченої пари
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 4. Властивості рідин
- •1. Характеристика рідкого стану речовини
- •2. Поверхневий шар рідини
- •3. Спостереження явища поверхневого натягу
- •3. Поняття про в’язкість середовища
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 5. Властивості Твердого стану речовини
- •2. Ізотропія та анізотропія
- •3. Механічні властивості.
- •2. Класифікація твердих тіл і їх властивості
- •4. Типи кристалів
- •Характеристика різних типів кристалів за типами їх решіток
- •1. Види деформації
- •Пружні – зникають після зняття навантаження, внаслідок чого форма і розміри тіл повністю відновлюються.
- •2. Кількісна характеристика деформації
- •3. Закон пружних деформацій (закон Гука)
- •7. Плавлення і кристалізація
- •9. Теплове розширення тіл
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 1. Внутрішня енергія і способи її зміни
- •Термодинаміка (тд) вивчає теплові явища і процеси, не враховуючи молекулярну будову речовини.
- •Приклади розв’язування задач
- •ПЩо таке внутрішня енергія?Що називають тепловим двигуном?итання для самоперевірки
- •Тема 2. Закони термодинаміки
- •1. І закон термодинаміки (і зтд) – це закон збереження і перетворення енергії при теплових процесах.
- •3. Застосування і зтд до ізопроцесів
- •Приклади розв’язування задач
- •Питання для самоперевірки
- •Тема 3. Теплові машини (двигуни)
- •3. Цикл Карно
- •4. Способи підвищення ккд тм
- •5. Застосування тм
- •6. Проблеми екології довкілля, пов’язані з використанням тм
- •7. Шляхи зниження шкідливого впливу роботи тм
- •Принцип дії холодильної машини
- •Приклади розв’язування задач
- •ПЩо таке внутрішня енергія?Що називають тепловим двигуном?итання для самоперевірки
- •Рекомендовані джерела інформації
Тема 1. Основні положення і поняття мкт будови речовини
Основна задача МКТ – встановити зв’язок між мікро- та макропараметрами речовини і, виходячи з цього, знайти рівняння стану даної речовини.
Як правило, на практиці необхідно знайти залежність тиску від мікро- і макропараметрів ТДС
|
|
|
|
|
|
|
|
Основні поняття МКТ
Структурні частинки речовини
Молекула – найменша стійка частинка речовини, яка зберігає її властивості.
Атом – найменша стійка частинка, що зберігає властивості даного хімічного елемента.
Ізотопи – атоми одного хімічного елемента, що мають різну масу внаслідок різної кількості нейтронів у їхніх ядрах.
Розміри молекул дуже малі – порядку 0,1
 10
нм (10-10
10
нм (10-10 10-8
м)
10-8
м)
Виміряти точно розміри молекул неможливо, тому вводиться фізична величина, яка дозволяє їх оцінити – ефективний діаметр молекули dеф = r0 – найменша відстань, на яку можуть наблизитись центри мас молекул даної речовини.
Сили міжмолекулярної взаємодії
Mіж
молекулами одночасно діють сили
молекулярного притягання і відштовхування,
які у сумі складають силу
міжмолекулярної взаємодії:
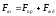 .
.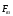 мають електричну природу, тому
мають електричну природу, тому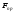 <
0,
<
0,
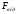 > 0
> 0 модуль рівнодійної сил взаємодії
модуль рівнодійної сил взаємодії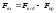
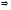 результат взаємодії залежить від
співвідношення
результат взаємодії залежить від
співвідношення і
і (рис.1).
(рис.1).

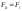

Рис.1
Маса і кількість молекул і речовини
Зв’язок між масою речовини m, масою її структурних частинок m0 і кількістю цих частинок N
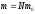

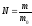 (1)
(1)
Густина речовини ρ – це маса речовини, що міститься в одиниці об’єму речовини V:
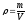 (2)
(2)
[ρ] = кг/м3.
Концентрація речовини n – це кількість структурних частинок, що міститься в одиниці об’єму речовини (1/м3)
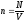 (3)
(3)
[п] = 1/м3.
Малі
розміри молекул і атомів зумовлюють їх
незначну масу (m0
~
10-27 10-25
кг)
і дуже велику кількість у макросистемі
(N
~
1020
10-25
кг)
і дуже велику кількість у макросистемі
(N
~
1020 1025)
1025)
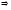 не зручні в користуванні. Тому для
описування теплових явищ вводяться
відносні величини.
не зручні в користуванні. Тому для
описування теплових явищ вводяться
відносні величини.
Відносна атомна (або молекулярна) маса – це відношення маси атома (або молекули) даної речовини
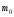 до 1/12 маси ізотопу карбону
до 1/12 маси ізотопу карбону :
:
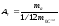 ;
;
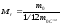 ;
(4)
;
(4)
[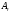 ,
,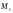 ]
= 1 а.о.м. = 1/12
]
= 1 а.о.м. = 1/12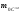 = 1,66·10-27
кг.
= 1,66·10-27
кг.
Відносна
маса молекули визначається через суму
мас її атомів:

Наприклад,
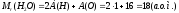 .
.
Кількість речовини ν – це відношення числа молекул N у даній речовині до їх числа у 12 г ізотопу карбону
 ,
тобто Nа
:
,
тобто Nа
:
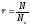 (5)
(5)
[ν] = моль.
Моль – це така кількість речовини, яка має стільки ж структурних частинок, що і 12 г ізотопу вуглецю
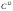 .
.
1 моль будь-якої речовини містить однакову кількість структурних частинок, яка визначає число Авогадро:
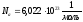 .
(6)
.
(6)
Молярна маса речовини – маса цієї речовини, взятої у кількості одного моля, тобто
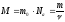 .
(7)
.
(7)
[М] = кг/моль
Молярна маса речовини пов’язана з її відносною молекулярною масою:
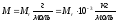 .
(8)
.
(8)
Зв’язок мас і кількості молекул і речовини зручно записати таким чином:
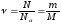 .
(9)
.
(9)
Енергетична характеристика теплового руху молекул
Оскільки молекули речовини рухаються, то кожна з них має кінетичну енергію поступального руху. Всі молекули мають різні швидкості, тому користуються поняттям середньої кінетичної енергії поступального руху молекул речовини:
 (10)
(10)
де
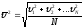 (11)
(11)
– середня квадратична швидкість молекул даної речовини.
Оскільки між молекулами речовини є сили взаємодії, то вони мають і потенціальну енергію, що визначається, як і сили взаємодії, відстанню між молекулами. Вважається, що потенціальна енергія окремої молекули, яка не взаємодіє з іншими молекулами, дорівнює нулю.
Агрегатні стани речовини (АСР) – ТД макростани речовини, які визначаються співвідношенням кінетичної і потенціальної енергій її молекул (тобто: енергетичні мікростани речовини визначають її макростан – АСР )
|
АСР |
Мікрокартина стану |
Співвід-ношення енергій |
Макрокар-тина стану |
|
Газ
|
Молекули хаотично рухаються у даному об’ємі речовини і практично не взаємодіють, бо між ними значні відстані: r
>> dеф
|
|
Не мають форми і об’єму |
|
Рідина
|
Молекули
розміщені на відстанях r
~
dеф,
займаючи певні положення протягом
нетривалого часу (час
осілого життя);
взаємодіють між собою
|
|
Не мають форми, зберігають об’єм |
|
Тверде тіло |
Молекули:
щільно упаковані у певно визначеному
порядку r << dеф
|
|
Зберігають форму і об’єм |
Макропараметри ТДС речовини
Об’єм V визначається розмірами ТДС.
[V] = м3.
1 м3 = 103 л = 103 дм3 = 106 см3 = 109 мм3;
1 л = 10-3 м3; 1 см3 = 10-6 м3; 1мм3 = 10-9 м3.
Тиск р. [р] = Па. 1 атм = 1,013∙105 Па = 760 мм.рт.ст.;
1 Па ≈ 133 мм.рт.ст.; 1ат = 9,8∙104 Па.
|
Тиск твердих тіл |
відношення сили, яка діє на поверхню площею S, перпендикулярно до цієї поверхні |
|
|
Тиск рідин (гідростатичний) |
тиск, який чинить стовп рідини висотою h на дно і стінки посудини |
|
|
Тиск газів |
сумарний імпульс, який передають молекули газу стінкам посудини за певний інтервал часу |
|
Прилади для вимірювання тиску
|
Барометр-анероїд – для вимірювання атмосферного тиску. Він складається з металевої гофрованої коробочки (1), яка стискається при збільшенні ратм і розширюється при його зменшенні. |
Рис. 2
|
|
Манометри – для вимірювання тисків, більших за атмосферний. | |
|
Рідинні манометри – являють собоюсполучені посудини, заповнені однорідною рідиною. Один кінець манометра з’єднано з посудиною, в якій вимірюється тиск газу, а інший знаходиться під атмосферним тиском. |
Рис. 3
|
|
Металеві манометри – основна частина їх – зігнута в дугу пружна металева трубка (1), один кінець якої закритий, а інший через кран (2) сполучається з посудиною, в якій вимірюється тиск. |
Рис. 4
|
Температура Т – визначає ступінь нагрітості тіла і є мірою середньої кінетичної енергії поступального руху молекул, а отже, і мірою теплового руху.
[Т] = К, [t] = 0С.
У разі теплового контакту по-різному нагріті тіла (тобто з різною температурою) обмінюються енергією завдяки хаотичному рухові їхніх частинок (внаслідок теплопередачі), в результаті чого їхня температура вирівнюється.
Стан системи тіл, які перебувають у контакті і мають однакову температуру, називають тепловою рівновагою.
Прилад для вимірювання температури – термометр.
* Зі зміною ТДСт крім температури однозначно змінюються й інші його фізичні властивості (тиск, об’єм, електричний опір, інтенсивність випромінювання тощо). За зміною будь-якої з них можна судити про зміну температури тіла, що і використовують на практиці.
Методи вимірювання температури різні для різних діапазонів температур, залежать від умов вимірювання та необхідної точності, їх поділяють на: контактні і безконтактні. Для контактних методів характерно те, що прилад, який вимірює температуру тіла, повинен знаходитися з ним у тепловій рівновазі.
Найбільш розповсюджені термометри: рідинні, манометричні, опору, термоелектричні. Для вимірювання низьких температур використовують крім того, конденсаційні, газові, акустичні, магнітні. Інколи використовують біметалеві, кварцеві, ємнісні термометри.
Шкали вимірювання температури
У побуті користуються ртутними або спиртовими термометрами, які проградуйовані за шкалою Цельсія.
У фізиці для встановлення раціональної температурної шкали використовують рівномірне розширення газів (на відміну від рідин) при їх нагріванні. Таку шкалу (її запропонував лорд Кельвін) називають ідеальною газовою шкалою чи абсолютною шкалою температур.
Абсолютний нуль температур – це температура, при якій зникає всякий поступальний і обертальний рух молекул
Т (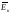 = 0, р = 0)=0К = – 2730С
= 0, р = 0)=0К = – 2730С
0С К F

100 --------------------------373-----------------------212--
0 -------------------------273-------------------------32-
-273-----------------------------0-----------------------459--
Цельсія Кельвіна Фаренгейта
(Європа) (Наука) (США)
t
= (Т – 273) 0C
T
= (t + 273) K
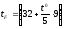 F
(12)
F
(12)
Нормальні умови ТД стану системи
|
Параметри |
Числові значення |
|
Температура |
Т0 = 273 К, t0 = 0 0С |
|
Тиск |
р0 = 1,013∙105 Па = 1 атм = 760 мм.рт.ст. |
|
Молярний об’єм (займає 1 моль газу) |
V0 = 0,0224 м3 = 22,4 л згідно закону Авогадро |

 ~
102
~
102 103
м/с;
103
м/с;
 .
.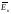 >>
>>

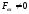 ;
можуть перескакувати з місця на місце
(υк
мала).
;
можуть перескакувати з місця на місце
(υк
мала).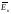 ~
~
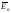
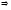 взаємодіють між собою:
взаємодіють між собою: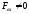 ,
можуть лише коливатися біля положення
рівноваги
,
можуть лише коливатися біля положення
рівноваги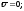 υк
мала;
υк
мала;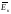 <<
<<