
ЭЛЕМЕНТЫ
.pdfВсе соединения галогенов со степенью окисления +1 сильные окислители. Соли склонны к реакции диспропорционирования, легко разлагаются, особенно в присутствии катализаторов:
3КЭ+1O = 2КЭ-1 + КЭ+5O3; |
2КЭ+1O = 2КЭ-1 + O2. |
Из солей наибольшее применение находит хлорная известь - смешанный гипохлорит-хлорид кальция - Ca(ClO)Cl (отбеливающее средство, средство для дегазации и дешевый окислитель). Получается при взаимодействии хлора с гашеной известью:
Cl2 + 2Сa(OH)2 СaCl2 + Сa(ClO)2 + 2H2O.
Степень окисления +1 также проявляется в соединениях с более электроотрицательными галогенами. Интергалогегиды образуются при непосредственном взаимодействии простых веществ. Например, фторид хлора(I) получают при нагревании сухих веществ выше 270 С.
Формула |
Агрегатное состояние |
Тпл., С |
Ткип., С |
|
|
|
|
ClF |
бесцветный газ |
-154 |
-101 |
BrF |
газ красного цвета |
-33 |
+20 |
BrCl |
газ желтого цвета |
-54 |
+5 |
ICl |
твердое вещество красного цвета |
+27 |
97 (разл.) |
IBr |
твердое вещество серого цвета |
+42 |
119 (разл.) |
|
|
|
|
Интергалогениды данного типа очень неустойчивы за исключением ICl и ClF. Их кислотный характер подтверждается отношением к воде, а также их взаимодействием с однотипными производными щелочных и щелочноземельных металлов.
ClF + H2O = HClO + HF; |
ICl + H2O = HIO + HCl; |
ClF + NaF = Na[ClF2]; |
ICl + NaCl = Na[ICl2]. |
дифторохлорат(I) |
дихлороиодат(I) |
Иодиды щелочных металлов склонны в растворах присоединять молекулу иода с образованием полигалогенидов. Реакцию формально можно рассматривать как взаимодействие с кислотным иодидом иода(I):
I+1I-1 + KI-1 = K[I+1I2-1].
дииодоиодат(I)
К бинарным соединениям хлора в степени окисления +1 следует отнести нитрид хлора(I) – Сl3N. Молекула нитрида имеет геометрию тригональной пирамиды, с sp3-гибридизацией орбиталей атома азота. Соединение представляет собой темно-желтое масло с температурой плавления –27С, летучее, очень неустойчивое.. Кислотный характер соединения подтверждается реакцией гидролиза:
Cl3N + 3H2O = 3HClO + NH3
Соединения со степенью окисления +3. Соединения в степени окисления +3 немногочисленны, оксиды неизвестны, а соответствующие им анионы ЭO2 неустойчивы и легко диспропорционируют:
3HЭ+3O2 = 2HЭ+5O3 + НЭ-1
НClO2 даже в водном растворе быстро разлагается, представляет собой кислоту средней силы (Ка = 1·10-2), называемую хлористой. Хлориты щелочных и щелочноземельных металлов представляют собой белые кристаллические вещества, при нагревании легко диспропорционируют или разлагаются с выделением кислорода. NaClO2·3H2O применяют при отбеливании тканей и бумажной массы.
Известны интергалогениды со степенью окисления +3:
Формула |
Агрегатное состояние |
Тпл., С |
Ткип., С |
|
|
|
|
ClF3 |
светло-зеленый газ |
-76,3 |
+11,6 |
BrF3 |
жидкость |
+8,8 |
+125,8 |
IF3 |
твердое легкоплавкое вещество |
- |
- |
ICl3 |
желтые игольчатые кристаллы |
- |
- |
|
|
|
|
11

Молекулы тригалогенидов имеют Т-образное строение, сильные окислители, например, в парах ClF3 горят такие устойчивые вещества, как стеклянная вата, оксиды алюминия, магния и др.
2Al2O3 + 4ClF3 = 4AlF3 + 3O2 + 2Cl2
Это кислотные соединения, их гидролиз сопровождается диспропорционированием, например:
BrF3 + 2H2O = HBrO2 + 3HF 3HBr+3O2 = 2HBr+5O3 + НBr-1
3BrF3 + 6H2O = 2HBrO3 + НBr + 9HF
Трифториды брома и хлора применяют как фторирующие агенты, а BrF3 и IF3 - в качестве неводных растворителей при проведении специальных синтезов.
Соединения со степенью окисления +4. Оксид хлора(IV) - ClO2 ядовитый газ желтого цвета, взрывоопасный, получают, действуя на хлорат калия концентрированной серной кислотой:
КCl+5O3 + H2SO4 = KCl+7O4 + Cl+4O2 + K2SO4 + H2O
Молекула-радикал ClO2 имеет угловое строение, атомные орбитали хлора находятся в sp2- гибридизации, валентный угол 118 º:
O
.Cl

O
Оксид хлора(IV) является смешанным ангидридом двух кислот (хлористой и хлорноватой):
2Cl+4O2 + H2O = HCl+3O2 + HCl+5O3
Соединения со степенью окисления +5. Из оксидов в степени окисления +5 известен только оксид иода(V), твердое вещество, достаточно устойчивое к нагреванию, разлагается при температуре выше 300 ºС. Энергично взаимодействует с водой, образуя иодноватую кислоту:
I2O5 + H2O = 2HIO3
Известны соответствующие кислоты хлора и брома – хлорноватая и бромноватая. Хлорноватую и иодноватую кислоты получают обменной реакцией:
Вa(ЭO3)2 + H2SO4 = 2HЭO3 + BaSO4
Бромноватая кислота образуется в водных растворах при действии на соединения брома окислителей:
Br2 + 5Cl2 + 6H2O = 2HBrO3 + 10HCl
Хлорноватая кислота по свойствам напоминает азотную кислоту, её смесь с соляной кислотой – окислитель такой силы как "царская водка". Сила кислот в ряду HClO3 - HBrO3 - HIO3 несколько убывает, а устойчивость, наоборот, повышается. Если хлорноватая кислота устойчива только в растворах с концентрацией до 40 %, то HIO3 можно выделить в твердом состоянии – это бесцветные кристаллы с температурой плавления 110 С. При нагревании HIO3 образуется соответствующий оксид - I2O5.
Соли кислот – хлораты, броматы и иодаты. Анион имеет геометрию тригональной пирамиды, атомные орбитали хлора находятся в sp3-гибридизации:
.. -
Cl


O
O
O
Наибольшее практическое значение имеет хлорат калия (бертолетова соль), его получают пропуская хлор через горячий раствор щелочи. КClO3 мало растворим в воде, поэтому его легко отделяют от KCl при охлаждении раствора.
>70 C
3Cl2 + 6КOH 5КCl + КClO3 + 3H2O
При нагревании хлораты диспропорционируют, а в присутствии катализатора (MnO2) разлагаются с выделением кислорода:
4KCl+5O3 = 3KCl+7O4 + KCl-1; |
2KCl+5O3 = 2KCl-1 + 3O2 |
12

Сильные окислители – хлораты – в смеси с восстановителями образуют легко взрывающиеся составы. Бертолетову соль используют в производстве спичек и фейерверков, хлорат натрия применяют в борьбе с сорняками. Иодаты значительно устойчивее соответствующих хлоратов и броматов, однако при сильном нагревании также разлагаются с выделением кислорода.
Из соединений в степени окисления +5 известны интер- и оксогалогениды:
Формула |
Агрегатное состояние |
Тпл., С |
Ткип., С |
|
|
|
|
ClF5 |
неустойчивый газ |
-93 |
-13 |
ClОF3 |
- |
- |
- |
ClО2F |
бесцветный газ |
-115 |
-6 |
BrF5 |
бесцветная жидкость |
-62 |
- |
BrО2F |
бесцветная жидкость |
-9 |
- |
IF5 |
бесцветная жидкость |
+9,6 |
- |
IО2F |
твердое вещество |
разл.>300 |
- |
|
|
|
|
Гидролиз соединений данного типа идет по следующей схеме:
ClО2F + H2O = HClO3 + HF; |
BrF5 + 3H2O = HBrO3 + 5HF |
С основными соединениями галогениды и оксогалогениды дают соответствующие соли, например:
IF5 + KF = K[IF6]; |
IF5 + 6KOH = KIO3 + 5KF + 3H2O |
Соединения со степенью окисления +7. Оксид известен только для хлора - Cl2O7. Это бесцветная жидкость (т.пл. –93,4 С, т.кип. +83 С). Получается при нагревании хлорной кислоты с оксидом фосфора(V):
2HClO4 + P2O5 = Cl2O7 + 2H3PO4
Молекула Cl2O7 полярна ( = 0,24·10-29 Кл·м), в ней согласно электронографическому исследованию два тетраэдра объединены через атом кислорода. Длина связи между атомами хлора и терминальными атомами кислорода составляет 0,172 нм, а между хлором и мостиковым атомом кислорода – 0,142 нм.
O |
O |
|
O |
|
97o |
||
|
|
||
O Cl 115 o |
Cl |
O |
|
|
|||
|
O |
O |
|
Оксид хлора(VII) относительно устойчив, но при нагревании выше 120 С разлагается со взрывом. Оксиду соответствует хлорная кислота:
Cl2O7 + H2O = 2HClO4
Анион ClO4- имеет тетраэдрическое строение, что в рамках теории валентных связей соответствует sp3-гибридизации валентных орбиталей атома хлора, стабилизированной за счет -связей:
O -
Cl 


O







 O
O
O
Хлорную кислоту получают действием на хлораты концентрированной серной кислотой:
KClO4 + H2SO4 = HClO4 + KHSO4
Хлорная кислота - одна из самых сильных минеральных кислот, это бесцветная жидкость (т.пл.
–102 С) хорошо растворимая в воде, способная взрываться. Вследствие повышения устойчивости анионов в ряду: ClO- - ClO2- - ClO3- - ClO4- окислительная способность соединений уменьшается, а сила кислот растет. Из солей хлорной кислоты наибольшее значение имеет KClO4, который получают электролизом раствора KClO3.
13

Бромная кислота - HBrO4 - в свободном состоянии не выделена, но получены её водные растворы. Ее устойчивые соли - перброматы получают по следующей реакции:
NaBrO3 + 2NaOH + F2 = NaBrO4 + H2O + 2NaF
По силе бромная кислота приближается к хлорной, а по окислительной активности она сильнее. Для иода в степени окисления +7 характерно образование ортокислоты – H5IO6 – это бесцветное кристаллическое вещество (т.пл. 122 С), растворимое в воде. Кислотные свойства иодной кислоты выражены слабее, чем хлорной (К1= 2,8·10-2, К3= 2,5·10-13). Периодаты получают либо реакцией диспропорционирования иодатов, либо их окислением:
5Ba(IO3)2 = Ba5(IO6)2 + 4I2 + 9O2;
KIO3 + 6KOH + Cl2 = K5IO6 + 2KCl + 3H2O
Из соединений в степени окисления +7 известны галогениды и оксогалогениды:
Формула |
Агрегатное состояние |
Тпл., С |
Ткип., С |
|
|
|
|
ClO3F |
бесцветный газ |
-147,8 |
-46,7 |
BrF7 |
неустойчивый газ |
- |
- |
IF7 |
неустойчивый газ |
- |
- |
IО3F |
белое кристаллическое вещество |
разл.>90 |
- |
|
|
|
|
Триоксофторид хлора, в отличие от остальных соединений, обладает высокой термической и гидролитической устойчивостью: он не разлагается и не гидролизуется даже при температуре 260С. Его кислотная природа проявляется при взаимодействии с концентрированными растворами щелочей:
ClО3F + 2NaOH = NaClO4 + NaF + H2O
Литература: [1] с. 338 - 359, [2] с. 415 - 423, [3] с. 270 - 296
Лекция № 3. Элементы VIA-подгруппы
В главную подгруппу VI группы (подгруппу VIA) входят следующие элементы: кислород - О, сера - S, селен - Se, теллур - Te и полоний - Po. Общая электронная формула их атомов - ns2np4. Отсутствие энергетически доступных d-орбиталей и высокая электроотрицательность атома кислорода обусловливает его отличие от остальных элементов подгруппы. Для него характерна степень окисления -2; соединения в других степенях окисления представлены единичными примерами:
H2 O-21, KO-21/2 , O2+1F2, O2+F2. Для серы и элементов подгруппы селена наряду со степенью окисле-
ния -2 возможны положительные степени окисления, в основном +4 и +6. Увеличение эффективного радиуса атома при переходе от серы к полонию сопровождается уменьшением электроотрицательности элемента и усилением металлического характера простых веществ.
3.1. Кислород
Кислород - самый распространенный элемент земной коры (58 мол.%). В природе представлен тремя изотопами: 16O, 17O (0,04%), 18O(0,2%). В виде простого вещества входит в состав атмосферы (20,9 об.% или 23,2 мас. %). Значительная часть элемента кислород входит в состав воды гидросферы, многих руд и минералов (оксиды, сульфаты, карбонаты, силикаты и т.д.).
Элемент кислород образует два простых вещества, аллотропные модификации, отличающиеся составом молекул - кислород (О2) и озон (О3). Вещество кислород представляет собой бесцветный газ без вкуса и запаха, плохо растворим воде: при 0 С 5 объемов кислорода в 100 объемах воды. При температуре -183 С кислород сжижается, образуя подвижную жидкость голубого цвета, которая кристаллизуется при - 219 с образованием кристаллов синего цвета. Играет важную биологическую роль, обеспечивая процессы дыхания.
Молекула кислорода весьма устойчива, начинает диссоциировать при 2000 С. Длина связи составляет 0,1207 нм, энергия диссоциации 494 кДж/моль. Молекула кислорода парамагнитна, её парамагнетизм отвечает наличию двух неспаренных электронов.
Озон образован трехатомными молекулами, строение которых можно передать следующей схемой:
+ |
|
+ |
|
|
O |
|
|
|
- O |
|
|
|
|
O |
- |
|
или |
.. . . . . |
O |
|
O |
O |
O |
O |
O |
|
|
|
|
|
14
Озон - газ синего цвета с резким раздражающим запахом, т.кип. -112 С, очень токсичен - предельная допустимая концентрация в воздухе (ПДК) 0,16 мг/м3. В малых концентрациях озон обладает обеззараживающим действием. В природе образуется при грозовых разрядах и в верхних слоях атмосферы при действии на молекулярный кислород жесткого ультрафиолетового облучения:
h
3О2 = 2О3
В приземных слоях атмосферы содержание озона составляет 10-7-10-6%. Основное количество озона находится в верхних слоях атмосферы на высоте 20-30 км, образуя так называемый "озоновый экран". Содержание озона в озоновом экране таково, что при атмосферном давлении он образовал бы слой газа толщиной около 1 см. Несмотря на малую концентрацию, озон играет очень важную биологическую роль, задерживая губительное для всех форм жизни жесткое ультрафиолетовое излучение.
Получение. В промышленности кислород получают фракционной перегонкой (ректификацией) жидкого воздуха. Лабораторные методы получения кислорода основаны на термическом разложение веществ, богатых кислородом - KMnO4, KClO3, H2O2 и т.п.
t |
|
2KMnO4 K2MnO4 + |
MnO2 + O2 ; |
t |
|
2KClO3 2KCl |
+ 3O2 |
Применяется кислород для интенсификации химических и металлургических производств, для сварки и резки металлов, в дыхательных аппаратах (космос, подводные работы, медицина).
Озон получают в лабораторных условиях при действии на кислород слабого (тлеющего) электрического разряда. При этом образуется смесь, содержащая 20-30% озона - озонированный кислород. Применяется озон для дезинфекции воздуха и воды, а также как эффективный окислитель в химическом синтезе.
Химические свойства. По химическим свойствам кислород один из наиболее активных неметаллов, реагирующий с большинством простых веществ. Соответствующие реакции будут рассмотрены при изучении химии других элементов и их соединений. Непосредственно с кислородом не взаимодействуют только инертные газы, галогены и благородные металлы (серебро, золото и платина).
Соединения кислорода
Соединения со степенью окисления –2. Важнейшим из оксидов является оксид водорода – вода, которая рассматривалась выше. Характер оксидов элементов в периодах и группах периодической системы закономерно изменяется. В периодах уменьшается эффективный отрицательный заряд на атомах кислорода и осуществляется постепенный переход от основных оксидов через амфотерные к кислотным. Например, для элементов третьего периода:
Na2O MgO |
Al2O3 |
SiO2 P2O5 SO3 Cl2O7 |
Основные оксиды |
Амфотерный оксид |
Кислотные оксиды |
Классификацию оксидов обычно проводят по способности к образованию солей:
1.Несолеобразующие оксиды - CO, SiO, N2O, NO.
2.Солеобразующие оксиды:
кислотные оксиды, образующие соли при взаимодействии с основаниями, т.е., выполняющие роль кислоты, например:
SO2 + 2NaOH = Na2SO3 + H2O
основные оксиды, образующие соли при взаимодействии с кислотами, т.е., выполняющие роль основания, например,
MgO + H2SO4 = MgSO4 + H2O
амфотерные оксиды, образующие соли при взаимодействии как с кислотами, так и основани-
ями, например,
ZnO + 2HCl = ZnCl2 + H2O;
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
Значительное число оксидов реагирует с водой. При этом кислотные оксиды образуют кислоты, а оксиды щелочных и щелочноземельных металлов (основные оксиды) образуют основания. Кроме того оксиды разных типов могут взаимодействовать друг с другом.
Na2O + Н2O = 2NaOH; |
P2O5 + 3Н2O = 2H3PO4; |
15
t
Na2O + SiO2 = Na2SiO3
Соединения перекисного типа. При химических превращениях молекула кислорода может присоединять или терять электроны с образованием молекулярных ионов типа О22-,О2-.
Соединения, в которых присутствует ион О22- называются пероксидами. Пероксиды получают при окисления активных металлов или реакцией обмена:
Ba + O2 = BaO2; 2LiOH + Н2О2 = Li2О2 + 2Н2О
Наибольшее практическое значение имеет пероксид (перекись) водорода - Н2О2. Строение молекулы показано ниже:
H |
|
|
0,095 нм |
0,148 нм |
120 ° |
|
|
|
O |
|
O |
|
95° |
H |
|
|
Энергия связи О-О почти в два раза меньше энергии связи Н-О. Из-за несимметричного распределения связей молекула сильно полярна ( = 0,7·10-29 Кл·м). Между молекулами возникает довольно прочная водородная связь, приводящая к их ассоциации. Поэтому пероксид водорода - бесцветная сиропообразная жидкость ( = 1,45 г/см3) с довольно высокой температурой кипения (150,2 ºС). Неустойчив в чистом виде, но устойчив в водных растворах до 50% концентрации.
Получают пероксид водорода электролизом водных растворов серной кислоты или гидросульфата аммония. При этом на аноде образуется пероксосерная кислота, гидролиз которой приводит к образованию пероксида водорода:
- 2e- H2S2O8 H2S2O8 + 2H2O = 2H2SO4 + H2O2
В химических реакциях пероксид-анион может, не изменяясь, переходить в другие соединения: BaO2 + Н2SО4 = H2О2 + 2BaSO4
Вследствие промежуточной степени окисления кислорода (-1), пероксид водорода, в зависимости от условий проведения реакции, может быть как окислителем, так и восстановителем. В кислой среде H2O2 довольно сильный окислитель:
H2O2 + 2H+ + |
2e- 2H2O; |
E0 = 1,78 В |
2KI + H2O2 + |
H2SO4 = I2 |
+ K2SO4 + 2H2O |
В то же время пероксид водорода окисляется более сильными окислителями, например, перманганатом калия:
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + 5O2 + K2SO4 + 8H2O
Распад пероксида водорода протекает по типу диспропорционирования и катализируется соединениями тяжелых металлов, например, MnO2.
2Н2О2-1 = 2Н2О-2 + О20
Водные растворы пероксида водорода (в основном 3%) применяются для отбеливания тканей и меха, дезинфекции, консервации, протравливания семян. Важную роль пероксид водорода играет в процессах самоочищения природных водоемов, в которых он содержится в ничтожной концентрации (порядка 3 10-5 моль/л) и эффективно окисляет биологические загрязнения.
Соединения, содержащие О2-1-ион называют надпероксидами. Надпероксиды известны для элементов IА, IIА и IIБ подгрупп. Получают их прямым синтезом или окисление пероксидов
t |
t |
|
K + O2 = KO2; |
Na2О2 + О2 = 2NaО2; |
2Li2О2 + 2O3 = 4LiО2 + O2 |
Надпероксиды – кристаллические вещества, обычно имеющие цвет от желтого до оранжевого. Сильные окислители, бурно реагируют с водой и оксидом углерода(IV):
2KO2 + 2H2О = 2KОH + О2 + H2О2; |
4KО2 + 2CO2 = 2K2CО3 + 3O2 |
16

Соединения со степенями окисления +2 и +1. Положительные степени окисления кислорода проявляются в его соединениях со фтором. Простейший представитель такого рода соединений – OF2. Молекула имеет угловую форму, валентный угол составляет 104º 16'. Дифторид кислорода – ядовитый светло-желтый газ, термически устойчив до 200 – 250 ºС, сильный окислитель, эффективный фторирующий агент. Его получают при быстром пропускании фтора через 2 % раствор щелочи:
2F2 + 2NaOH = OF2 + 2NaF + H2O
Диоксофторид – O2F2 – образуется при непосредственном взаимодействии простых веществ в электрическом разряде или под действием ионизирующих излучений при температуре жидкого воздуха. По структуре молекула диоксофторида аналогична молекуле перекиси водорода. Соединение крайне неустойчиво.
Соединения со степенью окисления +4. В качестве производного, в котором кислород проявляет степень окисления +4, можно рассматривать аллотропную модификацию кислорода – озон.
Молекула озона диамагнитна, имеет угловую форму, валентный угол 116,5º. Длина связи является промежуточной между длиной одинарной или двойной связи. Центральный атом кислорода находится в состоянии sp2-гибридизации. Строение молекулы можно представить следующим образом:
O |
0,126 нм |
|
O O
Озон в отсутствие катализатора или ультрафиолетового облучения разлагается довольно медленно даже при 250 ºС. Жидкий озон и его концентрированные смеси взрывоопасны.
Озон по химическим свойствам напоминает кислород, однако отличается большей активностью. Например, озон при обычных условиях окисляет малоактивные металлы:
8Ag + 2O3 = 4Ag2O + O2
Качественной реакцией на озон является посинение бумаги, смоченной иодидом калия и крахмалом (иодокрахмальная бумага), за счет образования иода при окислении KI.
2KI + O3 + H2O = I2 + 2KOH + O2
Озон может достаточно легко переходить в озонид-ион О3-. Так при действии озона на щелочные металлы образуются озониды:
K + O3 = KO3
Наличие в ионе О3- неспаренного электрона обусловливает парамагнитные свойства озонидов и наличие окраски, обычно озониды окрашены в красный цвет. Это кристаллические вещества, самопроизвольно разлагаются уже при комнатной температуре, реагируют с водой:
2KO3 = 2KО2 + О2; 2KО3 + 2Н2О = 2KОН + 2O2 + Н2О2
3.2. Сера
Сера представлена в природе четырьмя изотопами: 32S (95%), 33S, 34S и 36S. Кларк серы составляет 0,03 мол.%. Значительное количество серы находится в виде простого вещества (самородная сера). Однако бóльшая часть серы входит в состав минералов, как сульфидных, так и сульфатных: ZnS - цинковая обманка, сфалерит; PbS - свинцовый блеск, галенит; Cu2S - медный блеск; HgS - киноварь; FeS2 - железный колчедан или пирит; CuFeS2 - халькопирит; Na2SO4 10H2O - глауберова соль или мирабилит; CaSO4 2H2O - гипс.
Элемент сера образует несколько аллотропных модификаций. Наиболее устойчива ромбическая сера ( -сера), представляющая собой желтые хрупкие кристаллы, нерастворимые в воде, но растворимые в некоторых органических растворителях (сероуглерод, толуол). При температуре выше 96 С устойчива моноклинная сера ( -сера). Обе модификации имеют молекулярное строение и построены из циклических молекул S8 , по-разному упакованных в кристалле, т.е. фактически представляют собой полиморфные модификации.
S S S S
 S
S 

 S
S

 S
S 

 S
S
При нагревании кристаллической серы до 113 С она плавится, образуя темную подвижную жидкость, которая при дальнейшем нагревании вначале густеет, а затем снова размягчается и при температуре 445 С закипает. В зависимости от температуры сера образует в парах молекулы разного состава:
17

>1500 C
S8 S6 S4 S2 S
При выливании кипящей серы в воду образуется пластическая сера, представляющая собой тягучую массу, напоминающую сырой каучук. Пластическая сера образована полимерными зигзагообразными молекулами, неустойчива и со временем переходит в ромбическую серу.
 S S S S S
S S S S S
Серу получают главным образом выплавкой самородной серы непосредственно в местах её залегания под землей. Она применяется в производстве серной кислоты, для вулканизации каучука, как инсектицид в сельском хозяйстве. Чистая сера не ядовита. Прием внутрь небольших ее количеств способствует заживлению ран и нарывов. Серный порошок входит в состав мазей для лечения кожных заболеваний.
Строение атома серы - 1s22s22p63s23p43d0 - обуславливает проявление этим элементом степени окисления - 2 при взаимодействии с элементами меньшей электроотрицательности. С элементами большей электроотрицательности (F, O, N, Cl), сера проявляет положительные степени окисления, в основном +4 и +6, за счет переноса части валентных электронов на вакантные d- орбитали:
n = 3 


d
n = 2
p
n = 1
s
Химические свойства. Сера - активный неметалл, легко взаимодействующий с активными металлами и неметаллами. В парах серы горит водород:
t
H2 + S |
|
H2S |
При нагревании сера окисляет углерод и кремний: |
|
t |
t |
С + 2S = CS2; |
Si + 2S = SiS2 |
В качестве окислителя сера выступает также при взаимодействии с металлами. Большинство реакций данного типа требует нагревания, при комнатной температуре с серой реагирует только ртуть.
t |
|
Zn + S = ZnS; |
Hg + S = HgS |
Использование избытка серы приводит к образованию полисульфидов, простейшим представителем которых является дисульфид железа(II), образующий минерал пирит:
Fe + 2S = FeS2
При взаимодействии с галогенами и кислородом сера выступает в качестве восстановителя. Фтор обычно окисляет серу до высшей степени окисления с образованием SF6. Взаимодействие серы с хлором идет ступенчато:
t |
t |
2S + Cl2 = S2Cl2; |
S2Cl2 + Cl2 = 2SCl2 |
Горение серы на воздухе и в атмосфере кислорода приводит к образованию оксида серы(IV): t
= SO2
При кипячении с кислотами-окислителями (азотная и концентрированная серная кислота) сера также окисляется:
t
S + 4HNO3(конц) = SO2 + 4NO2 + 2H2O
При нагревании с водными растворами щелочей сера диспропорционирует:
3S0 + 6KOH = 2K2S-2 + K2S+4O3 + 3H2O
18

Соединения серы
Соединения со степенью окисления –2. Наиболее важными соединениями серы в степени окисления -2 являются сероводород и сульфиды. Сероводород - H2S - бесцветный газ с характерным запахом гниющего белка, токсичен. Молекула сероводорода имеет угловую форму, валентный угол равен 92º. Образуется при непосредственном взаимодействии водорода с парами серы. В лаборатории сероводород получают действием сильных кислот на сульфиды металлов:
Na2S + 2HCl = 2NaCl + H2S
Сероводород сильный восстановитель, окисляется даже оксидом серы(IV).
2H2S-2 + S+4O2 = 3S0 + 2H2O
В зависимости от условий продуктами окисления сульфидов могут быть S, SO2 или Н2SO4:
2KMnO4 + 5H2S-2 + |
3H2SO4 |
2MnSO4 + 5S |
+ |
K2SO4 + 8H2O; |
H2S-2 + |
4Br2 + |
4H2O = H2S+4O4 |
+ |
8HBr |
На воздухе и в атмосфере кислорода сероводород горит, образуя серу или SO2 в зависимости от условий.
В воде сероводород мало растворим (2,5 объема H2S на 1 объем воды) и ведет себя как слабая двухосновная кислота.
H2S |
|
|
H+ + HS-; |
К1 = 1 10-7 |
|
|
|
||||
HS- |
|
|
|
H+ + S2-; |
К2 = 2,5 10-13 |
|
|
|
|||
Как двухосновная кислота сероводород образует два ряда солей: гидросульфиды (кислые соли) и сульфиды (средние соли). Например, NaНS - гидросульфид и Na2S - сульфид натрия.
Сульфиды большинства металлов в воде малорастворимы, окрашены в характерные цвета и отличаются по растворимости в кислотах: ZnS - белый, CdS - желто-оранжевый, MnS - телесного цвета, HgS, CuS, PbS, FeS - черные, SnS - бурый, SnS2 - желтый. В воде хорошо растворимы сульфиды щелочных и щелочноземельных металлов, а также сульфид аммония. Растворимые сульфиды сильно гидролизованы.
Na2S + H2О |
|
NaHS + NaOH |
|
Сульфиды, как и оксиды, бывают основными, кислотными и амфотерными. Основные свойства проявляют сульфиды щелочных и щелочноземельных металлов, кислотные свойства – сульфиды неметаллов. Различие химической природы сульфидов проявляется в реакциях гидролиза и при взаимодействии сульфидов разной природы между собой. Основные сульфиды при гидролизе образуют щелочную среду, кислотные гидролизуются необратимо с образованием соответствующих кислот:
SiS2 + 3H2О = H2SiO3 + 2H2S
Амфотерные сульфиды в воде нерастворимы, некоторые из них, например, сульфиды алюминия, железа(III), хрома(III), полностью гидролизуются:
Аl2S3 + 3H2О = 2Al(OH)3 + 3H2S
При взаимодействии основных и кислотных сульфидов образуются тиосоли. Отвечающие им тиокислоты обычно неустойчивы, их разложение аналогично разложению кислородсодержащих кислот.
СS2 + Na2S = Na2CS3; |
Na2CS3 + H2SO4 = H2CS3 + Na2SO4; |
тиокарбонат натрия |
тиоугольная кислота |
H2CS3 = H2S + CS2
Персульфидные соединения. Тенденция серы образовывать гомоцепи реализуется в персульфидах (полисульфидах), которые образуются при нагревании растворов сульфидов с серой:
Na2S + (n-1)S = Na2Sn
Персульфиды встречаются в природе, например, широко распространенный минерал пирит FeS2 представляет собой персульфид железа(II). При действии на растворы полисульфидов минеральных кислот выделены полисульфаны - нестойкие маслоподобные вещества состава H2Sn , где n изменяется от 2 до 23.
Персульфиды подобно пероксидам проявляют как окислительные, так и восстановительные свойства, а также легко диспропорционируют.
Na2S2 + SnS = SnS2 + Na2S; |
4FeS2 + 11O2 = 2Fe2O3 + 8SO2; |
19
Na2S2-1 = S0 + Na2S-2
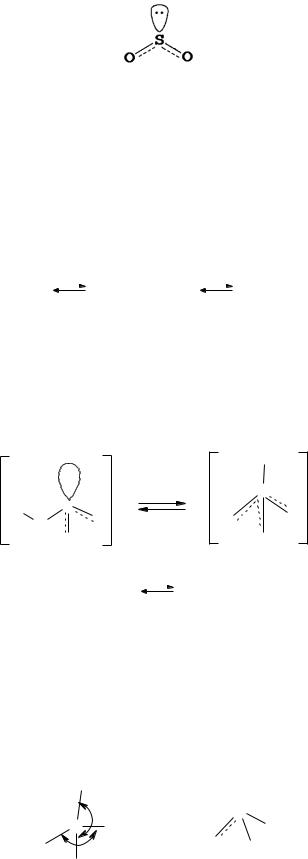
Соединения со степенью окисления +4. Наибольшее значение имеет оксид серы(IV) - бесцветный газ с резким неприятным запахом горящей серы. Молекула SO2 имеет угловое строение
(угол OSO равен 119,5 ):
В промышленности SO2 получают обжигом пирита или сжиганием серы. Лабораторный метод получения диоксида серы - действие сильных минеральных кислот на сульфиты.
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
Оксид серы(IV) является энергичным восстановителем
S+4O2 + Cl2 = S+6O2Cl2,
но, взаимодействуя с сильными восстановителями, может выступать в роли окислителя:
2H2S + S+4O2 = 3S0 + 2H2O
Диоксид серы хорошо растворим в воде (40 объемов на 1 объем воды). В водном растворе гидратированные молекулы SO2 частично диссоциируют с образованием катиона водорода:
SO2 H2O |
|
H+ + HSO3- |
|
2H+ + SO32- |
|
|
По этой причине водный раствор диоксида серы часто рассматривают как раствор сернистой кислоты - H2SO3, хотя реально это соединение, по-видимому, не существует. Тем не менее, соли сернистой кислоты устойчивы и могут быть выделены в индивидуальном виде:
SO2 + NaOH = NaHSO3; |
SO2 + 2NaOH = Na2SO3 |
гидросульфит натрия |
сульфит натрия |
Сульфит-анион имеет структуру тригональной пирамиды с атомом серы в вершине. Неподеленная пара атома серы пространственно направлена, поэтому анион – активный донор электронной пары, легко переходит в тетраэдрический HSO3- и существует в виде двух таутомерных форм:
|
.. |
-1 |
|
H |
-1 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
S |
|
H |
S |
O |
O |
|
O |
O |
|
|
|||
|
|
|
|||
|
O |
|
|
O |
|
Сульфиты щелочных металлов хорошо растворимы в воде, в значительной мере гидролизованы:
SO32- + H2О |
|
HSO3- + ОН- |
|
Сильные восстановители, при хранении их растворов постепенно окисляются кислородом воздуха, при нагревании диспропорционируют:
|
|
t |
|
2Na2S+4O3 + О2 = 2Na2S+6O4; |
4Na2S+4O3 = Na2S-2 |
+ 3Na2S+6O4 |
|
Степень окисления +4 проявляется в галогенидах и оксогалогенидах: |
|
||
SF4 |
SOF2 |
SOCl2 |
SOBr2 |
фторид серы(IV) |
оксофторид серы(IV) |
оксохлорид серы(IV) |
оксобромид серы(IV) |
Во всех приведенных молекулах на атоме серы локализована неподеленная электронная пара, SF4 имеет форму искаженного тетраэдра (бисфеноид), SOHal2 – тригональной пирамиды.
F |
|
.. |
|
|
173 o |
|
|
..S |
|
|
S |
F |
|
Cl |
|
F |
101,5 o |
O |
Cl |
F |
|
|
|
20
