
ЭЛЕМЕНТЫ
.pdf
Получают бор, восстанавливая его активными металлами из соединений, или пиролизом бороводородов:
t |
t |
B2O3 + 3Mg = 3MgО + 2B; |
NaBF4 + 3Na = 4NaF + B |
t |
|
B2H6 = 2B |
+ 3H2 |
Химические свойства. Бор - химически инертное вещество, в обычных условиях реагирует только со фтором:
2B + 3F2 = 2BF3
При нагревании до 400 - 700 С реагирует с кислородом, серой, хлором и активными металла-
ми:
4B + 3O2 = 2B2O3; 2B + 3S = B2S3;
1200 С
2B + N2 2BN
нитрид бора
Бор обладает очень высоким сродством к кислороду, поэтому энергично реагирует с многими оксидами:
t
4B + 3SiO2 = 3Si + 2B2O3
С водой бор не реагирует, но окисляется концентрированной серной и азотной кислотами, щелочи растворяют бор только в присутствии окислителей.
|
|
t |
B |
+ |
3HNO3(конц) = H3BO3 + 3NO2 ; |
2B |
+ |
2KOH + H2O2 = 2KBO2 + 2H2 |
|
|
метаборат калия |
Основная область применения бора - атомная энергетика. Изотоп 10B имеет очень большое сечение захвата нейтронов. По поглощающей способности слой бора-10 толщиной 1 см эквивалентен 20 см свинца или 5 м бетона. В то же время изотоп 11B один из самых прозрачных для нейтронов материалов. Значительное количество бора идет на легирование сплавов, которым он придает твердость и коррозионную устойчивость.
Соединения бора
Металлические соединения бора. С металлами бор образует бориды состава: М4В, М2В, МВ, М3В4, МВ2, МВ6. Бориды s-элементов химически активны, разлагаются кислотами образуя смеси бороводородов. Большинство боридов d- и f-элементов очень тверды и химически устойчивы. Жаропрочные бориды таких d-элементов, как Cr, Zr, Ti, Nb, Ta, применяют для изготовления деталей реактивных двигателей, лопаток газовых турбин и пр.
Соединения со степенью окисления +3. Важнейшими соединениями бора являются гидриды, галогениды, оксид, борные кислоты и их соли.
Оксид бора - B2O3 - бесцветная хрупкая стеклообразная масса, кислотный оксид, энергично присоединяет воду с образованием ортоборной кислоты:
B2O3 + 3H2O = 2H3BO3
H3BO3 - очень слабая одноосновная кислота, причем ее кислотные свойства проявляются не за счет отщепления катиона водорода, а за счет связывания гидроксид-аниона:
H3BO3 + H2O |
|
H+ + [B(OH)4]-; |
рКа = 9,0 |
|
При нагревании борная кислота ступенчато теряет воду, образуя вначале метаборную кислоту, а затем оксид бора:
- H2O |
- H2O |
H3BO3 HBO2 |
B2O3 |
При взаимодействии со щелочами образует тетрабораты - соли гипотетической тетраборной кислоты:
4H3BO3 + 2NaOH = Na2B4O7 + 7H2O
Большинство солей – боратов – в воде нерастворимы, исключение составляют бораты s- элементов. Более других используется тетраборат натрия Na2B4O7. В большинстве своем бораты полимерны, выделяются из растворов в виде кристаллогидратов. Полимерных борных кислот из раствора выделить не удается, в связи с тем, что они легко гидратируются. Поэтому при действии
51

кислот на полибораты обычно выделяется борная кислота (эта реакция используется для получения кислоты):
Na2B4O7 + H2SO4 + 5H2O = 4H3BO3 + Na2SO4
Безводные метабораты получают сплавлением оксида бора или борной кислоты с оксидами металлов:
CaO + B2O3 = Ca(BO2)2
Гидриды бора. Простейший гидрид бора - BH3 - не существует, поскольку атом бора в данной молекуле должен содержать на внешнем уровне шесть электронов вместо восьми (завершенный электронный уровень). Электронодефицитность бора компенсируется за счет образования мостиковых связей с атомом водорода.
H  H H
H H
B B
H  H
H  H
H
В молекулах других бороводородов наряду с мостиковыми и терминальными (концевыми) связями бор - водород образуются связи бор - бор, что приводит к образованию более сложных структур. Например, молекула тетраборана имеет следующее строение:
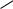 B B
B B
H H H H
H B 
 B H
B H
H H
Обычным методом получения бороводородов (боранов) является гидролиз боридов металлов, например:
6MgB2 + 12HCl = B4H10 + 8B + 6MgCl2 + H2
Большинство боранов ядовиты и имеют отвратительный запах. Из выделенных в свободном состоянии гидридов простейшими представителями являются: B2H6, B4H10 – газы, B5H9, B6H10 – жидкости, B10H14 – твердое вещество.
Бороводороды - реакционноспособные вещества, на воздухе горят, многие самовоспламеняются, разлагаются водой:
B2H6 + 3O2 = B2O3 + 3H2O; |
B2H6 + 6H2O = 2H3BO3 + 6H2 |
Будучи соединениями кислотными бораны с основными гидридами образуют анионные комплексы, например:
B2H6 + 2LiH = 2Li[BH4];
тетрагидридоборат лития
AlСl3 + 3Li[BH4] = Al[BH4]3 + 3LiCl
Гидридобораты щелочных металлов имеют связь, близкую к ионной, в водных растворах медленно гидролизуются, являются активными восстановителями. Гидридобораты алюминия и бериллия – полимерны, на воздухе взрываются.
Бороводороды и органические соединения бора широко применяются в качестве ракетного топлива.
Галогениды бора известны для всех галогенов. Молекулы галогенидов имеют форму плоского треугольника с атомом бора в центре (sp2-гибридное состояние). В обычных условиях фторид BF3
– газ, BCl3 и BBr3 – жидкости, BI3 – твердое вещество. Все они бесцветны. Могут быть получены из простых веществ при нагревании. Фторид в промышленности получают нагреванием оксида бора с фторидом кальция в присутствии концентрированной серной кислоты:
B2O3 + 3CaF2 + 3H2SO4 = 2BF3 + 3CaSO4 + 3H2O
Получение хлорида основано на хлорировании раскаленной смеси оксида бора и угля:
B2O3 + 3C + 3Cl2 = 2BCl3 + 3CO
Галогениды бора, особенно фторид, сильнейшие акцепторы электронов (кислоты Льюиса), легко реагируют с донорами электронной пары:
BF3 + KF = KBF4; |
BF3 + :NH3 = F3B :NH3 |
тетрафтороборат калия
52
Кислотная природа галогенидов проявляется при их гидролизе, который протекает необратимо. Вследствие этого BCl3 и BBr3 на влажном воздухе дымят, а взаимодействие иодида бора с водой идет со взрывом.
BCl3 + 3H2O = H3BO3 + 3HCl
Нитрид бора - BN - получается прямым взаимодействием простых веществ и существует в двух модификациях: графито- и алмазоподобной (боразон или эльбор). В гексагональной слоистой структуре типа графита атомы бора и азота находится в sp2-гибридизации. В отличие от графита BN белого цвета полупроводник, легко расслаивается, огнеупорен (т.пл. ~3000 ºС). Очень медленно разлагается водой при нагревании.
Алмазоподобный нитрид бора имеет кубическую кристаллическую решетку (sp3-гибридизация атомов), получают его из гексагональной модификации при 1800 ºС и давлении 60 – 80 тыс.атм. Эльбор (боразон) очень твердый материал, некоторые его образцы царапают алмаз. При этом он термически устойчив до 2000 С, инертен, диэлектрик. Используется для обработки твердых материалов.
6.2. Алюминий
Для алюминия (1s22s22p63s23p1) характерна степень окисления +3, типичные гибридизации – sp3 и sp3d2, в соединениях проявляет координационные числа 4 и 6.
Алюминий - один из наиболее распространенных элементов земной коры (кларк составляет 6,6 мол.%). Основные минералы: Al2O3 - корунд (окрашенные модификации - рубин, сапфир), Al2O3 nH2O - боксит, Na3AlF6 - криолит. Значительное количество алюминия находится в земной коре в виде алюмосиликатов.
Алюминий - серебристо-белый металл (т.пл. 660 ºС) с высокой электро- и теплопроводностью, очень легкий (плотность 2,7 г/см3). Широко применяется в электротехнике, по электропроводности уступает только золоту, серебру и меди. Пластичен, хорошо обрабатывается прессованием и ковкой. Сплавы алюминия: силумины (11-14% кремния), дюралюмины (3,5-4% меди, 0,5-1% магния, кремния и марганца), магналий (3-30% магния) отличаются высокой прочностью и легкостью, что делает их основными конструкционными материалами в самолето- и ракетостроении.
В промышленности алюминий получают электролизом глинозема (технический оксид алюминия), растворенного в расплаве криолита Na3AlF6. В расплаве Al2O3 ведет себя как электролит (алюминат алюминия).
Al2O3 = Al3+ + AlO33-; Катод: Al3+ + 3e- = Al;
Анод: 4AlO33- - 12e- = 2Al2O3 + 3O2
Химические свойства. Алюминий - очень активный металл, по активности уступает только щелочным и щелочноземельным металлам. Однако прочная оксидная пленка на поверхности алюминия придает ему повышенную устойчивость в обычных условиях. Если оксидную пленку удалить, алюминий активно реагирует с водой и кислородом воздуха:
4Al + 3O2 = 2Al2O3; 2Al + 6H2O = 2Al(OH)3 + 3H2
При высоких температурах оксидная пленка не защищает алюминий и металл энергично взаимодействует с кислородом, серой, галогенами, азотом, фосфором, углеродом, образуя соответствующие бинарные соединения. Высокое сродство алюминия к кислороду позволяет использовать его для восстановления металлов из их оксидов (алюмотермия):
t
+ 2Al = 2Fe + Al2O3
Алюминий легко растворяется в водных растворах щелочей и кислот, не обладающих окислительными свойствами:
2Al + 6KOH + 6H2O = 2K3[Al(OH)6] + 3H2 ; 2Al + 6HCl = 2AlCl3 + 3H2
Концентрированные кислоты-окислители и очень разбавленная азотная кислота на холоду пассивируют алюминий, но растворяют его при нагревании:
t
8Al + 30HNO3(разб) = 8Al(NO3)3 + 3NH4NO3 + 9H2O
Соединения алюминия
Оксид алюминия существует в нескольких модификациях, основной из которых является - Al2O3 (корунд) - твердое, тугоплавкое соединение (т.пл. 2050 С). По твердости уступает только
53

алмазу, эльбору и карборунду. Очень устойчивое соединение, не реагирующее с водными растворами кислот и щелочей. При сплавлении проявляет свойства амфотерного оксида:
|
|
t |
|
|
|
Al2O3 |
+ 2NaOH |
= |
2NaAlO2 |
+ |
H2O; |
|
|
t |
|
|
|
Al2O3 + |
3K2S2O7 |
= |
Al2(SO4)3 |
+ |
3K2SO4 |
Гидроксид алюминия выделяется при действии аммиака на водные растворы солей алюминия:
Al3+ + 3NH3 H2O = Al(OH)3 + 3NH4+
Свежеполученный Al(OH)3 реакционноспособное вещество, типичный амфотерный гидроксид, растворимый в растворах кислот и щелочей:
Al(OH)3 + 3HCl = AlCl3 + 3H2O; |
Al(OH)3 + 3KOH = K3[Al(OH)6] |
Со временем гидроксид алюминия теряет активность за счет частичной потери воды и образования полимерных структур.
Галогениды алюминия - сильные кислоты Льюиса, энергично присоединяют электронодонорные молекулы, очень энергично растворяются в воде, иодид алюминия со взрывом. Фторид алюминия представляет собой полимерное вещество, нерастворимое в воде и органических растворителях. Хлорид, бромид и иодид алюминия - летучие кристаллические вещества, растворимые в органических растворителях, в парах и в инертных органических растворителях существуют в виде димерных молекул. Например:
|
Cl |
|
|
Cl |
|
Cl |
|
Al |
Al |
||
|
|||
Cl |
|
Cl |
|
|
|
||
|
Cl |
|
При сплавлении с основными галогенидами образуют анионные координационные соединения типа M+13[AlF6], M+1[AlHal4]. Из них наиболее устойчив гексафтороалюминат Na3[AlF6] (криолит), нашедший применение в промышленности для получения алюминия, стекол и эмалей. Фтороалюминаты щелочных металлов в воде малорастворимы. В хлоро-, бромо- и иодоалюминатах координационное число алюминия равно 4, в растворе комплексные соли полностью гидролизуются.
Соли алюминия в основном хорошо растворимы в воде, сильно гидролизованы. Наибольшее применение находит сульфат алюминия и алюмокалиевые квасцы - K2SO4 Al2(SO4)3 24H2O.
Сульфид алюминия получают прямым синтезом. Соединение представляет собой желтые иглообразные кристаллы, существует только в безводных условиях, водой полностью гидролизуется:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Гидрид алюминия (алан) белое полимерное соединение, получают в эфире по следующей реакции:
AlСl3 + 3Li[AlH4] = 4AlH3 + 3LiCl
При температуре 105 ºС разлагается, активный восстановитель, самовоспламеняется на воздухе. Гидрид алюминия амфотерен, кислотная природа соединения проявляется в реакции с основными гидридами:
AlН3 + NaH = Na[AlH4]
Тетрагидридоалюминаты – белые твердые вещества, сильные восстановители, водой бурно разлагаются:
Na[AlH4] + 4H2O = Al(OH)3 + NaOH + 4H2
Применяются в органическом синтезе.
Нитрид алюминия – AlN – получают прямым синтезом или по реакции:
2Al + 2NH3 = 2AlN + 3H2
Нитрид – желтое кристаллическое вещество, разлагается кипящей водой:
AlN + 3H2O = Al(OH)3 + NH3
Карбид алюминия - Al4С3 - относится к ряду метанидов (производных метана). Твердое солеподобное вещество, получают прямым синтезом, в воде полностью гидролизуется:
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
54
6.3. Подгруппа галлия
Элементы подгруппы галлия располагаются в периодической системе сразу после элементов d-семейства, поэтому на свойства галлия и его аналогов в значительной степени сказывается d- сжатие. Так от Аl к Ga атомный радиус несколько уменьшается, а энергия ионизации возрастает. На свойствах таллия, кроме того, сказывается f-сжатие, поэтому от In к Tl размер атома увеличивается незначительно, а энергия ионизации даже возрастает. В связи с эффектом экранирования устойчивость 6s2 электронной пары возрастает, поэтому для таллия наиболее характерна степень окисления +1, а не +3 как для галлия и индия.
Галлий, индий и таллий - рассеянные элементы, самостоятельных месторождений практически не образуют, входят в состав некоторых полиметаллических руд. Легкоплавкие серебристо-белые металлы.
Химические свойства. Подобно алюминию галлий и индий на воздухе покрыты пассивирующей оксидной пленкой. Таллий на воздухе медленно окисляется. При нагревании реагируют с кислородом, серой и галогенами. Растворимы в кислотах. При этом галлий и индий образуют соли в степени окисления +3, а таллий образует соли таллия(I). Таллий в соляной кислоте пассивируется за счет образования нерастворимого в воде TlCl.
2Ga + 3H2SO4 = Ga2(SO4)3 + 3H2 ;
2Tl + H2SO4 = Tl2SO4 + H2
Галлий подобно алюминию реагирует со щелочами, индий и таллий в отсутствие окислителей к щелочам устойчивы.
2Ga + 6KOH + 6H2O = 2K3[Ga(OH)6] + 3H2
Соединения элементов подгруппы галлия
Соединения со степенью окисления +3. Оксиды галлия(III) Ga2O3 (белого цвета) и индия(III)
In2O3 (желтого цвета) могут быть получены прямым синтезом. Оксид таллия(III) Tl2O3 (коричневого цвета) образуется окислением оксида таллия(I) озоном. Все оксиды нерастворимы воде. Оксиды галлия(III) и индия(III) амфотерны. У оксида таллия(III) наблюдается сильное доминирование основных свойств. В соответствии с усилением основных свойств в ряду Ga2O3 - In2O3 - Tl2O3 возрастает растворимость в кислотах:
Э2O3 + 6HCl = 2ЭСl3 + 3H2O
Гидроксиды – Э(ОН)3 – нерастворимые в воде студенистые осадки переменного состава, получают аналогично гидроксиду алюминия. У Ga(OH)3 (белого цвета) основные и кислотные свойства проявляются практически в равной степени; у In(OH)3 (белого цвета) основные свойства преобладают над кислотными, а у Tl(OH)3 (красно-коричневого цвета) кислотные свойства практически не проявляются.
При растворении оксидов и гидроксидов в кислотах образуются аквакомплексы состава [Э(OH2)6]3+. Поэтому соли этих элементов всегда выделяются в виде кристаллогидратов. Аквакомплексы галлия и индия бесцветны, а таллия окрашены в светло-желтый цвет.
При растворении оксидов и гидроксидов в щелочах образуются гидроксокомплексы, например:
In(OH)3 + 3ОН- = [In(OH)6]3-
В ряду галогенидов ЭF3 – ЭCl3 – ЭBr3 – ЭI3 устойчивость падает. Фториды галлия, индия, таллия тугоплавки, бромиды и иодиды легкоплавки и летучи. В воде галогениды растворяются, в парах и органических растворителях находятся в виде димерных молекул. При взаимодействии с основными галогенидами образуют комплексные соединения:
3KHal + Э(Hal)3 = K3[Э(Hal)6]
Для галлия наиболее характерны фторидные комплексы, индий и таллий образуют устойчивые координационные соединения с хлорид- и бромид-анионом, для таллия устойчивым является иодидный комплекс.
Гидриды галлия и индия полимерны. Известен тетрагидридогаллат(III) лития - Li[GaH4]. 4LiH + GaCl3 = Li[GaH4] + 3LiCl;
Li[GaH4] медленно разлагается при 25 С до LiH, Ga и Н2, энергично реагирует с водой:
Li[GaH4] + 4H2О = LiОН + 4H2 + Ga(ОН)3
Все соединения таллия(III) – сильные окислители.
55
Соединения со степенью окисления +1. Соединения галлия и индия(I) неустойчивы, сильные восстановители. Для соединений таллия степень окисления +1 наиболее устойчива, все соединения проявляют основные свойства.
Оксид таллия (черного цвета) с водой реагирует подобно оксидам щелочных металлов:
Tl2O + H2O = 2TlOH
Гидроксид таллия(I) желтого цвета сильное основание, отщепляющее воду при нагревании до 100 С. Как и для щелочных металлов для таллия(I) комплексообразование не характерно. Соли таллия(I) напоминают соли серебра(I), при освещении разлагаются.
Все соединения галлия, индия и особенно таллия ядовиты!
Литература: [1] с. 608 - 619, [2] с. 472 - 481, [3] с. 412 - 446
Лекция № 7. Элементы IIA-подгруппы
IIA-Подгруппа включает бериллий - Be, магний - Mg, щелочноземельные металлы: кальций - Ca, стронций - Sr и барий - Ba, а также радиоактивный металл радий - Ra. Общая электронная формула - ns2, устойчивая степень окисления +2. Соединения бериллия амфотерны, во всех соединениях бериллий имеет координационное число 4, склонен к образованию ковалентных связей. Щелочноземельные металлы образуют преимущественно ионные соединения, активные металлы. Для магния наиболее характерно координационное число 6, щелочноземельные металлы могут проявлять и более высокие КЧ.
7.1. Бериллий
Бериллий представлен в земной коре одним изотопом 9Be (кларк 0,001 мол.%). Основные минералы: берилл Be3Al2(SiO3)6 и фенакит Be2SiO4. Окрашенные разновидности берилла образуют драгоценные камни изумруд и аквамарин.
Бериллий - металл серо-стального цвета, т.пл. 1283 С, плотность 1,85 г/см3, довольно тверд и хрупок, на воздухе покрыт плотной оксидной пленкой, защищающей его от коррозии.
Получают бериллий электролизом расплава его хлорида, или восстановлением фторида бериллия магнием:
t
BeF2 + Mg = MgF2 + Be
Используется бериллий как легирующая добавка к сплавам, которым он придает прочность и твердость, увеличивая коррозионную устойчивость. Бериллиевые бронзы устойчивы в бензине, морской воде и не искрят при ударе. Бериллий - эффективный отражатель нейтронов, что обуславливает его применение в ядерной энергетике. В то же время бериллий прозрачен для рентгеновских лучей, из него изготавливают окна рентгеновских аппаратов. Однако широкое применение бериллия ограничено высокой токсичностью его соединений.
Химические свойства. Активный металл. При нагревании взаимодействует с кислородом, серой, азотом и галогенами (со фтором при комнатной температуре):
t |
t |
t |
2Be + O2 = 2BeO; |
Be + S = BeS; |
3Be + N2 = Be3N2 |
На холоду бериллий с водой не взаимодействует, но растворяется в кислотах и щелочах. В концентрированных азотной и серной кислотах пассивируется.
Be + |
2HCl = |
BeCl2 + H2; |
Be + 2KOH |
+ 2H2O |
= K2[Be(OH)4] + H2 |
Соединения бериллия
Оксид бериллия - BeO - тугоплавкое полимерное вещество белого цвета, химически очень инертен. Амфотерен, при сплавлении реагирует с кислотными и основными оксидами, при нагре-
вании растворяется в кислотах и щелочах: |
|
|
|
||
t |
|
|
|
|
t |
BeO + SiO2 = |
BeSiO3; |
Na2O |
+ |
BeO = Na2BeO2; |
|
|
|
|
t |
|
|
BeO |
+ H2SO4 |
= BeSO4 |
+ |
H2O; |
|
|
|
|
t |
|
|
BeO |
+ |
2NaOH + |
H2O = Na2[Be(OH)4] |
||
Также амфотерен гидроксид бериллия - аморфное, полимерное вещество, нерастворимое в воде.
56

Из солей Be2+ в воде растворимы сульфат, нитрат и хлорид. В растворах сильно гидролизованы. Галогениды бериллия полимерны, сильно гигроскопичны (за исключение фторида), склонны к образованию координационных соединений:
BeF2 + 2KF = K2[BeF4]
тетрафторобериллат калия
Сульфид бериллия – кристаллическое вещество, образуется в результате взаимодействия простых веществ при 1350 С или взаимодействием бериллия с сероводородом. В горячей воде сульфид полностью гидролизуется, его амфотерная природа проявляется при сплавлении с основными и кислотными сульфидами:
Na2S + BeS = Na2BeS2; |
SiS2 + BeS = BeSiS3 |
тиобериллат натрия |
тиосиликат бериллия |
Нитрид бериллия – Be3N2 – кристаллическое вещество, получается при нагревании металла в атмосфере азота выше 1000 С. Нитрид бесцветен, очень тверд и тугоплавок (т.пл. 2200 С). Разлагается водой при нагревании:
Be3N2 + 6Н2О = 3Be(ОН)2 + 2NH3
При действии кислот разложение протекает достаточно активно.
Гидрид бериллия - BeН2 - твердое полимерное вещество белого цвета, по свойствам напоминает гидрид алюминия. Его можно получить в эфирном растворе реакцией обмена:
BeCl2 + 2LiH = BeH2 + 2LiCl
При разложении гидрида водой выделяется водород.
7.2. Магний
Магний - один из самых распространенных элементов земной коры, его кларк составляет 2,0 мол.%. Основные минералы: оливин - Mg2SiO4, магнезит - MgCO3, доломит - CaCO3 MgCO3, карналлит - KCl MgCl2 6H2O. Хлорид магния содержится в морской воде (до 0,38%) и в воде некоторых соленых озер. Магний является биометаллом, входит в состав хлорофилла, играющего важную роль в процессе фотосинтеза. Катион Mg2+ - активатор ферментов, регулирует работу сердечнососудистой системы.
Магний представляет собой легкий белый металл, плотность 1,74 г/см3, т.пл. 651 С, мягче и пластичнее бериллия, на воздухе быстро окисляется. Получают магний электролизом расплава его хлорида или восстановлением прокаленного доломита кремнием при 1200 – 1300 С.
2(CaO·MgO) + Si = Ca2SiO4 + 2Mg
Основная область применения - получение "сверхлегких" сплавов. Наиболее важный сплав – электрон (3 - 10 % алюминия; 0,2 - 3 % цинка, остальное магний) - благодаря прочности и малой плотности применяется в ракетной технике и авиастроении. Кроме того магний используется в качестве восстановителя при получении других металлов (магнийтермия) и в пиротехнике.
Химические свойства. Очень активный металл. При комнатной температуре реагирует с галогенами, при нагревании сгорает на воздухе, окисляется серой и азотом. Магний взаимодействует практически со всеми неметаллами с образованием бинарных соединений, исключение составляют инертные газы и водород.
Mg
+ S |
+ O2 |
+ Hal2 |
+ N2 |
MgS |
MgO |
MgHal2 |
Mg3N2 |
Магний горит даже в атмосфере углекислого газа:
t
2Mg + CO2 = 2MgO + C
Магний в ряду активности металлов расположен левее водорода, с холодной водой взаимодействует медленно, так как образующийся при этом гидроксид плохо растворим; при нагревании реакция ускоряется. С водными растворами кислот реагирует очень энергично, за исключением плавиковой и фосфорной кислот, которые образуют с магнием нерастворимые соли.
Mg + 2H2O = Mg(OH)2 + H2; |
Mg + 2HCl = MgCl2 + H2 |
57
Соединения магния
Оксид магния - MgO (жженая магнезия) - тугоплавкое вещество (т.пл. 2800 ºС). В промышленности получают термическим разложением карбоната магния:
t
MgCO3 = MgO + CO2
Мелкокристаллический оксид химически активен, является основным соединением, реагирует с кислотами и горячей водой. Сильно прокаленный оксид магния теряет химическую активность.
Жженную магнезию применяют как наполнитель в производстве резин, в огнеупорных строительных материалах, для очистки нефтепродуктов.
Гидроксид магния - Mg(OH)2 - малорастворим в воде, растворим в кислотах, основание средней силы (К2 = 2,5·10-3). Из насыщенных солей аммония вытесняет аммиак:
t
2NH4Cl + Mg(OH)2 = MgCl2 + 2NH3 + 2H2O
Большинство солей магния хорошо растворимы в воде, обычно кристаллизуются с шестью молекулами воды. Малорастворимы фторид MgF2, карбонат MgCO3 и фосфат Mg3(РO4)2. Безводные соли магния очень гигроскопичны. Перхлорат магния (ангидрон) - Mg(ClO4)2 - один из наиболее эффективных осушителей газов. Широкое применение находит хлорид магния, его получают хлорированием оксида магния в присутствии угля:
MgO + Сl2 + C = MgCl2 + CO
Используют хлорид для приготовления магнезиального цемента, устойчивого к действию кислот и щелочей. Цемент получают, смешивая прокаленный оксид магния с 30 % раствором хлорида. Смесь постепенно превращается в белую твердую массу вследствие образования полимерных цепей.
7.3. Щелочноземельные металлы
Кальций широко распространен в земной коре, его кларк равен 2 мол.%, стронций и барий - более редкие элементы (кларк Sr - 0,01; Ba - 6 10-3 мол.%). Основные минералы: CaCO3 - кальцит,
CaCO3 MgCO3 - доломит, CaSO4 2H2O - гипс, CaF2 - флюорит, Ca5(PO4)3(OH,F,Cl) - апатиты, SrCO3 -
стронцианит, BaCO3 - витерит, BaSO4 - барит. Кальций входит в состав костной ткани и зубной эмали животных и человека. Катионы кальция играют важную роль в механизме сокращения мышц.
Серебристо-белые металлы, быстро корродирующие на воздухе. Кальций твердый, барий и стронций мягкие, как свинец. В промышленности их получают электролизом расплавов хлоридов. Барий получают также восстановлением его оксида алюминием:
t
3BaO + 2Al = 3Ba + Al2O3
Кальций применяют в химической промышленности для получения некоторых металлов в качестве восстановителя. Фосфаты кальция используют как фосфорные удобрения: Ca3(PO4)2 - фосфоритная мука; CaHPO4 2H2O - преципитат; Ca(H2PO4)2 H2O - двойной суперфосфат; Ca(H2PO4)2 H2O + 2CaSO4 – суперфосфат. Хлорид кальция применяется в медицине.
Карбонат кальция (мел, известняк), оксид и гидроксид кальция (негашеная и гашеная известь), а также гипс (CaSO4·2H2O) и алебастр (2CaSO4·H2O) применяются как строительные материалы. Природные соединения кальция широко применяются в производстве вяжущих материалов, к которым относятся цементы, гипсовые материалы, известь.
По химическому составу цемент представляет собой силикаты и алюмосиликаты кальция. Силикатные цементы получают обжигом при 1400 – 1600 ºС смеси известняка и глины. Тонко измельченный цементный клинкер, замешанный с водой, постепенно твердеет за счет образования высокомолекулярных силикатов и алюминатов кальция.
Гипсовые материалы – это прежде всего жженый гипс или алебастр 2CaSO4·H2O. Его получают обжигом гипса при 150 – 180 ºС. При замешивании алебастра с водой происходит присоединение воды, сопровождающееся кристаллизацией и затвердеванием всей массы.
В качестве вяжущего материала также используют смесь гашеной извести с песком и водой (известковый раствор). Известковый раствор затвердевает за счет перехода Са(ОН)2 в кристаллический СаСО3 при поглощении углекислого газа из воздуха. Одновременно образуются силикаты кальция.
Применение бария очень сильно ограничено высокой токсичностью его растворимых соединений. Из нерастворимых соединений бария наиболее широко применяется BaSO4 как рентгеноконтрастное вещество. Металлический стронций используют в качестве добавок к некоторым сплавам. Соединения стронция используют в пиротехнике, в медицине при лечении некоторых кожных заболеваний. Изотоп 90Sr - один из самых опасных продуктов деления урана, он замещает кальций в костях, облучая организм изнутри (период полураспада около 30 лет).
58
Химические свойства. Щелочноземельные металлы химически очень активны, при комнатной температуре реагируют с кислородом и галогенами, при нагревании - с водородом, серой, азотом и фосфором, углеродом и кремнием. Энергично взаимодействуют даже с холодной водой. В ряду кальций, стронций, барий активность металлов увеличивается.
Соединения щелочноземельных металлов
Щелочноземельные металлы образуют основные оксиды, которые получают термическим разложением карбонатов или нитратов:
СаCO3 = СаO + CO2; 2Ba(NO3)2 = 2BaO + 4NO2 + O2
Энергично взаимодействуют с водой с образованием растворимых сильных оснований (щелочей). При переходе от Ca(OH)2 к Ba(OH)2 растворимость заметно увеличивается (от 0,02 М до 0,2 М),
в том же направлении увеличивается термическая устойчивость гидроксидов и усиливаются основные свойства. По силе основания уступают только гидроксидам щелочных металлов. Раствор Ва(ОН)2 – баритовая вода – лабораторный реактив на CO2.
Катионы щелочноземельных металлов образуют соли со всеми кислотами. Хорошо растворимы галогениды, нитраты, перхлораты и большинство кислых солей. Плохо растворимы в воде фториды, карбонаты, силикаты и фосфаты. Образование мелкокристаллического осадка сульфата бария является качественной реакцией на сульфат-анион:
Ba2+ + SO42- = BaSO4
Присутствие в природной воде растворимых солей кальция и магния обуславливает ее жесткость. Количественно жесткость измеряют суммарной концентрацией катионов Ca2+ и Mg2+ (ммоль экв/л). Различают временную (карбонатную) и постоянную жесткость. Первая удаляется кипячением:
t |
t |
|
Ca(HCO3)2 = CaCO3 + CO2 + H2O; |
Mg(HCO3)2 = |
Mg(OH)2 + 2CO2 |
Для удаления постоянной жесткости к воде добавляют вещества (соду, фосфат натрия и т.п.), переводящие катионы кальция и магния в осадок. Кроме того применяют метод ионного обмена, в этом случае катионы Ca2+ и Mg2+ меняются на катионы водорода или щелочного металла, удерживаемые на поверхности полимерной смолы (катионита).
Гидриды представляют собой белые солеподобные вещества, разлагающиеся водой с выделением водорода, сильные восстановители. В отличие от бериллия и магния, гидриды щелочноземельных металлов можно получить прямым синтезом:
t
Ca + H2 = CaH2
Литература: [1] с. 587 - 599, [2] с. 481 - 486, [3] с. 447 - 460
7.4. Элементы IA-подгруппы (щелочные металлы)
Элементы IA-подгруппы: литий - Li, натрий - Na, калий - K, рубидий - Rb, цезий - Cs и радиоактивный франций часто называют щелочными металлами. Общая формула ns1 обуславливает проявление щелочными металлами степени окисления +1.
Увеличение эффективного радиуса и уменьшение энергии ионизации в ряду Li – Na – K – Rb – Cs сопровождается заметным увеличением активности металлов. Небольшой радиус атома лития вызывает довольно сильные отличия данного элемента от остальных щелочных металлов, что в первую очередь проявляется в склонности к образованию ковалентных связей. Для натрия и особенно элементов подгруппы калия образование ковалентных связей нетипично. Малый размер и большая энергия гидратации катиона лития приводит к нарушению ожидаемой последовательности расположения щелочных металлов в ряду стандартных электродных потенциалов (литий стоит в нем первым). Нарушается ожидаемая последовательность активности щелочных металлов и в расплавах, в которых натрий более активен, что связано с образованием его ионом более прочных кристаллических решеток:
t
KOH + Na = NaOH + K
Литий, натрий, калий и рубидий - серебристо-белые металлы, цезий золотисто-желтого цвета. На воздухе поверхность лития, натрия и калия очень быстро тускнеет, рубидий и цезий самопроизвольно воспламеняются. Литий, натрий и калий хранят под слоем вазелина или вазелинового масла, рубидий и цезий хранят в запаянных ампулах. Металлы очень легкие и легкоплавкие, имеют довольно большой диапазон жидкого состояния. Щелочные металлы очень мягкие, натрий и калий легко режутся ножом.
59
Свойства |
Li |
Na |
K |
Rb |
Cs |
|
|
|
|
|
|
Плотность, г/см3 |
0,53 |
0,97 |
0,86 |
1,53 |
1,90 |
Т.пл., С |
181 |
98 |
64 |
39 |
29 |
Т.кип., С |
1340 |
886 |
771 |
630 |
672 |
Кларк, мол.% |
0,02 |
2,4 |
1,4 |
7 10-3 |
1 10-8 |
|
|
|
|
|
|
Литий, натрий и калий весьма распространены в природе, образуют много самостоятельных минералов: LiAl(SiO3)2 - сподумен, LiAl(PO4)F - амблигонит, NaCl галит (каменная или поваренная соль), Na2SO4 10H2O - мирабилит, KCl - сильвин, NaCl KCl - сильвинит, KCl MgCl2 6H2O - карналлит, КCl MgSO4 3H2O - каинит. Рубидий и цезий самостоятельных минералов не образуют, встречаются в виде примесей в минералах калия.
Литий и натрий получают электролизом ионных расплавов. Калий обычно получают восстановлением расплавов его соединений натрием или магнием.
Литий применяется в качестве легирующей добавки, придает сплавам твердость и пластичность. Натрий используется как теплоноситель в ядерных реакторах и восстановитель в металлотермии, а также как катализатор процессов полимеризации диенов. В лабораториях натрий широко используется для осушки газов и органических растворителей. Калий используется в промышленности как восстановитель и теплоноситель (в основном в виде жидкого сплава с натрием). Рубидий и цезий в основном применяются для изготовления фотоэлементов.
Химические свойства. Очень активные металлы, реагируют со всеми неметаллами, кроме инертных газов. Состав продуктов окисления кислородом зависит от природы металла: литий образует оксид, натрий и калий - перекисные соединения.
4Li + O2 = 2Li2O; |
2Na + O2 = Na2O2; |
K + O2 = KO2 |
|
пероксид натрия |
супероксид калия |
С водой реагируют очень энергично, калий - со взрывом:
2K + 2H2O = 2KOH + H2
Растворимы в аммиаке, с которым реагируют в присутствии катализатора:
2Na + 2NH3 = 2NaNH2 + H2
Растворимы в ртути, образуя амальгамы, которые медленно разлагаются водой и используются в качестве мягкого восстановителя. Активно реагируют с оксидами, отбирая у них кислород, го-
рят в атмосфере оксида углерода(IV): |
|
t |
t |
4Na + SiO2 = 2Na2O + Si; |
4Li + CO2 = 2Li2O + C |
Соединения щелочных металлов
Оксиды - белые кристаллические вещества, энергично растворяющиеся в воде с образованием щелочей:
Na2O + H2O = 2NaOH
Реагируют с кислотными и амфотерными оксидами с образованием солей. Получают оксид лития прямым синтезом, оксиды других металлов восстановлением пероксида:
Na2O2 + 2Na = 2Na2O
Пероксиды щелочных металлов термически неустойчивы, при нагревании разлагаются: t
= 2Na2O + O2
Реагируют с водой и диоксидом углерода: |
|
Na2O2 + 2H2O = 2NaOH + H2O2; |
2Na2O2 + 2CO2 = 2Na2CO3 + O2 |
Последняя реакция используется для регенерации воздуха.
Надпероксиды образуются в результате прямого синтеза только для металлов подгруппы калия. Представляют собой кристаллические вещества желтого цвета, очень реакционноспособны:
2КO2 + 2H2O = 2КOH + Н2O2 + O2;
Озониды - красные кристаллические вещества, получают пропуская озон через расплав гидроксида:
4КOН + 4O3 = 4KO3 + O2 + 2Н2O
60
