
Кулонометрические методы анализа
.pdf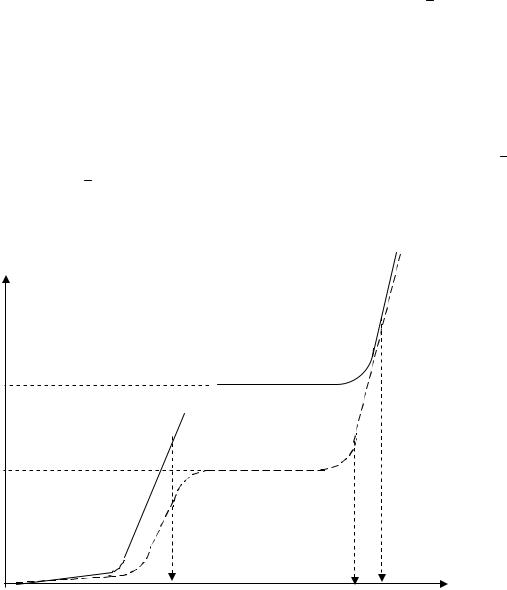
2.2. Гальваностатическая (амперостатическая) кулонометрия
Разновидность этой прямой кулонометрии основана на проведении электиролиза определяемого вещества при постоянной силе тока и находит применение только для определения веществ, находящихся на поверхности рабочего электрода в твердом состоянии (например, металлов, малорастворимых солей, оксидов).
Рассмотрим, почему гальваностатическую кулонометрию нельзя использовать для определения растворенных веществ. Предположим, что в водном растворе содержится в небольшой концентрации вещество А, способное окисляться на платиновом электроде (А + nе В). Для этого электроактивного вещества может быть получена вольтамперная кривая с площадкой предельного тока (рис.4.).
Допустим, что выбрана постоянная сила тока электролиза ( э ), величина которой больше предельного тока компонента А ( пр. ). Тогда в соответствии с вольтамперной кривой (рис.4., кривая 1) потенциал рабочего электрода будет соответствовать значению Е1. При этом потен-
циале на электроде будут проходить две реакции: основная А - nе В и побочная 4Н2О - 4е О2 + 4Н+. Протекание побочной реакции приведет к тому, что выход по току будет менее 100 %.
ок. |
1 2 |
э
Н2О О2
О2
пр.
А  В
В
э 


 пр.
пр.
Е2 Е3 Е1 +Е Рис. 4. Схемы вольтамперных кривых окисления вещества А на
платиновом электроде: 1 - в начальный момент времени; 2 - по истечении некоторого времени электролиза.
Если задать величину тока электролиза ( э ) меньше предельного тока вещества А ( пр. ), то потенциал электрода сначала принимает зна-
11
www.mitht.ru/e-library
чение Е2 и на электроде некоторое время реагирует только вещество А.
Протекание реакции А - nе В приведет к уменьшению концентрации вещества А в растворе и снижение предельного тока. Когда концентрация вещества А понизится настолько, что ток электролиза ( э ) будет превышать величину предельного тока ( э пр. ), то будут наблюдаться явления, аналогичные описанным выше. В соответствии с новым расположением вольтамперной кривой (рис.4, кривая 2) для сохранения тока электролиза на заданном уровне произойдет изменение потенциала электрода до значения Е2, что вызовет протекание побочной реакции на электроде. Таким образом, для растворенного электроактивного вещества невозможно обеспечить 100 % выход по току при проведении электролиза в амперостатическом режиме.
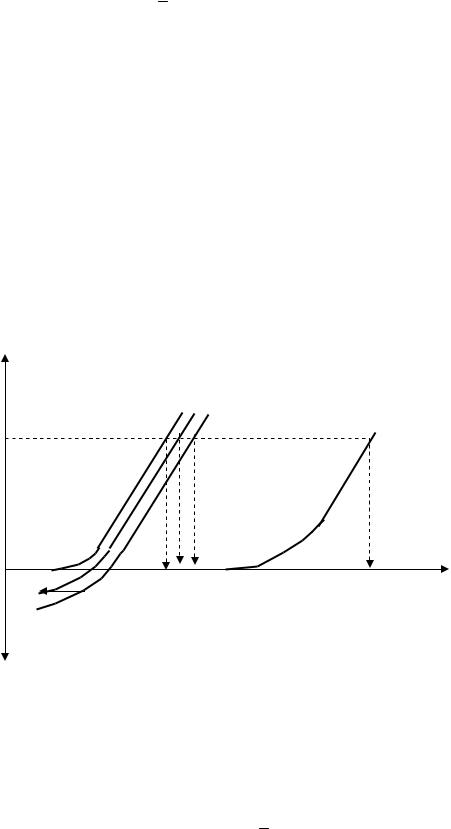
В отличие от растворов твердые электроактивные вещества дают вольтамперные кривые без площадок предельного тока. Например, если на поверхности электрода находится металл, способный электрохимически окисляться, то анодную вольтамперную кривую растворения можно представить так, как показано на рис.5.
ан.
1 |
2 |
3 |
4 |
э
М М+n
М+n
Н2О  О2
О2
М |
М+n Е1Е2Е3 |
Е4 |
+Е |
кат.
Рис. 5. Вольтамперные кривые анодного окисления металла М: 1 - в начальный момент электролиза; 2,3 – по истечении некоторого времени электролиза; 4 – кривая окисления воды
Предположим, что проводят анодное окисление металла М при постоянной силе тока электролиза ( э). В соответствии с кривой 1 (рис.5.) потенциал электрода принимает значение Е1 и на нем протекает только основная электродная реакция (М - nе М+n). По окончании этой реакции, когда окислится весь металл М с поверхности электрода, для протекания тока заданной величины произойдет изменение потенциала электрода, что вызовет новую электродную реакцию. Это может быть реакция окисления другой твердой фазы (если она имеется на электро-
12
www.mitht.ru/e-library

де), самого материала электрода или окисление растворителя, например, воды (2Н2О - 4е О2 + 4Н+).
В процессе анодного окисления металла М потенциал электрода меняется сравнительно мало и близок к значению Е1 (рис. 5). По окончании основного электродного процесса на электроде начнет протекать новая электродная реакция, что сопровождается скачком потенциала тем большим, чем больше разность стандартных (точнее, реальных) потенциалов редокс-пар, участвующих в электродных процессах. Следовательно, за окончание электролиза принимается момент резкого изменения потенциала рабочего электрода. По кривой зависимости потенциала рабочего электрода от времени электролиза находят время окончания процесса, а затем вычисляют количество электричества (Q = э.t).
Для анализа используют и процессы катодного восстановления, например, при определении оксидов металлов. При наличии на поверхности электрода нескольких электроактивных твердых фаз возможно их раздельное определение, если потенциалы окисления (восстановления) отличаются не менее, чем на 0,3 В.
Амперостатическую кулонометрию применяют для определения толщины металлических покрытий, оксидных пленок, пленок солей (например, хлорида серебра). Метод можно использовать в инверсионном варианте. Для этого предварительно осаждают определяемое вещество из раствора на электроде, а затем проводят анодный или катодный процесс с выделенным продуктом электрохимической реакции.
Нижняя граница определяемых содержаний прямой амперостатической кулонометрии составляет около 10-8 г.
3. Кулонометрическое титрование
Эта разновидность кулонометрического анализа относится к косвенной кулонометрии и используется для определения растворенных веществ. Этот метод основан на взаимодействии определяемого вещества с титрантом, который получают электролизом. Титрант в этом слу-
чае называют электрогенерированным.
В кулонометрическом титровании могут применяться два способа генерирования титранта: внутренний и внешний. В первом из них титрант получают в том же растворе, который содержит анализируемый компонент. Реже используют генерирование титранта в отдельной электролитической ячейке с последующим введением его в раствор анализируемого вещества (внешняя генерация).
Кулонометрическое титрование можно применять для определения как неэлектроактивных, так и электроактивных веществ. Тогда в первом случае электродная реакция используется только для получения титранта, во втором случае и само определяемое вещество может принимать участие в реакции на рабочем (генераторном) электроде. Наибо-
13
www.mitht.ru/e-library

лее часто кулонометрическое титрование осуществляют при постоянной силе тока, т.е. в гальваностатическом режиме.
В случае определения неэлектроактивного вещества А в анализируемый раствор вводят достаточно большое количество вспомогательного электроактивного реагента D, способного, например, восстанавливаться на электроде с образованием продукта С (D + n. е C). Получающееся вещество С (титрант) реагирует количественно с определяемым веществом А, например, с образованием малорастворимого соединения
А + С АС . |
(6) |
||
Суммарная реакция: |
|
||
А + D + |
|
АС . |
(7) |
е |
|||
Очевидно, что количество электричества, израсходованное на получение титранта С, эквивалентно количеству образовавшегося осадка и содержанию А в растворе.
Определяемое вещество может быть и электрохимически активным. Предположим, что вещество А способно окисляться на электроде: А - n.е В. В исследуемый раствор также вводят электроактивное вещество D, например, окисляющееся на электроде с образованием титранта С (D - n.е C). Поскольку ток электролиза (генераторный ток), как правило, больше предельного тока вещества А, то обе электродные реакции протекают одновременно. Получающийся титрант С должен количественно реагировать с определяемым веществом А, например, по ти-
пу окислительно-восстановительной реакции |
|
|||
А + С В + D. |
(8) |
|||
Заменив в указанной реакции С на D - |
е |
, получим суммарную реак- |
||
цию |
|
|||
А - n. |
|
В. |
(9) |
|
е |
||||
Таким образом, несмотря на то что часть определяемого вещества превращается в конечный продукт за счет реакции на электроде, а другая часть – за счет взаимодействия с титрантом, получается, будто все определяемое вещество А претерпевает электрохимическое превращение. Как и в случае неэлектроактивного вещества, количество электричества эквивалентно содержанию определяемого компонента.
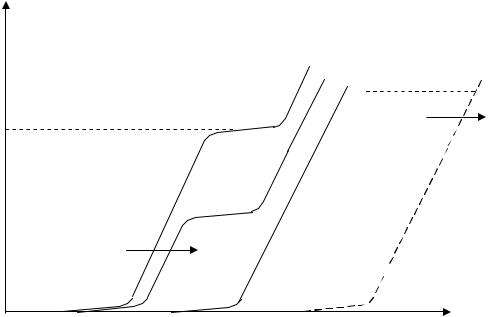
Для выбора условий кулонометрического титрования используют вольтамперные кривые компонентов. Схематически вольтамперные кривые титрования электроактивного вещества приведены на рис.6.
Как было указано выше, ток электролиза ( э) обычно больше предельного тока определяемого вещества А. Это обусловлено тем, что, с одной стороны, анализируются небольшие концентрации вещества (соответственно, мал предельный ток), а, с другой стороны, большая величина тока электролиза позволяет сократить время определения.
При выборе вспомогательного компонента D, из которого генерируется титрант С, руководствуются тем, что он должен разряжаться на
14
www.mitht.ru/e-library
электроде при сравнительно низких потенциалах, в противном случае возможны побочные реакции (например, разряд молекул растворителя). Кроме того, концентрация этого компонента должна быть сравнительно высокой (в 1000 и более раз превышать концентрацию определяемого вещества). В этом случае он служит своеобразным буфером, препятст-
ок.
D  C
C
э 


1 |
H2O |
O2 |
пр.
2
АВ
3
+E
Рис.6. Схемы вольтамперных кривых при кулонометрическом титровании электроактивного вещества: 1 – начало титрования; 2 – промежуточный момент; 3 – окончание титрования.
вующим смещению потенциала рабочего (генераторного) электрода до значений, при которых возможны побочные электродные реакции. В ряде случаев сам генераторный электрод является вспомогательным реагентом. Так, за счет окисления серебряного и ртутного электродов получают генерируемые ионы Ag (I), Hg(II) и Hg(I), широко используемые в кулонометрическом титровании.
Таким образом, в кулонометрическом титровании, как и в обычных титриметрических методах, используются химические реакции между определяемым веществом и титрантом. Но в отличие от других титриметрических методов титрант получается электрохимически. Определения основываются на нахождении количества электричества, что сводится к измерению времени электролиза до завершения титрования (при постоянном значении тока электролиза). Вновь можно заметить аналогию между обычным титрованием и кулонометрическим: измерение объема титранта соответствует измерению времени, а концентрация рабочего раствора – величине тока электролиза. Наконец, как и для других титриметрических методов, при использовании кулонометрического титрования необходимо определить завершение химической реакции, т.е. конечную точку титрования (к.т.т.).
15
www.mitht.ru/e-library
Большинство методов определения к.т.т., используемых в титриметрии, пригодны и для кулонометрического титрования. Широко применяемые в обычном титровании визуальные индикаторные методы в кулонометрическом титровании используются редко. Значительно чаще используются инструментальные методы индикации: потенциометрические, фотометрические, амперометрические. Применение того или иного способа индикации зависит от физико-химических свойств компонентов титриметрической реакции.
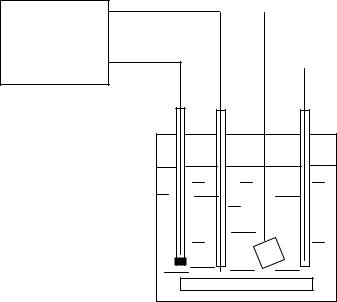
Принципиальная схема кулонометрической установки с использованием электрохимических методов индикации к.т.т. (потенциометрического или амперометрического) приведена на рис. 7.
При потенциометрической индикации к.т.т. в кулонометрическую ячейку помещают соответствующий индикаторный электрод и электрод сравнения. В качестве индикаторного электрода используют, например, платиновый электрод, если проводят окислительно-восстановительную реакцию, стеклянный электрод, если происходит реакция с изменением рН раствора. Следят за изменением потенциала индикаторного электрода в процессе кулонометрического титрования. По скачку потенциала на кривой потенциал-время находят конечную точку титрования.
В случае амперометрической индикации в ячейку также помещают индикаторный электрод и электрод сравнения. Предварительно по вольтамперным кривым выбирают потенциал индикаторного электрода в области диффузионного тока электроактивного компонента. В ходе титрования фиксируют изменение диффузионного тока в индикаторной цепи в зависимости от времени электролиза. Если ток в индикаторной цепи обусловлен электродной реакцией титранта, то получают кривую,
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
3 |
1 |
2 |
5 |
|
|
|
Рис. 7. Принципиальная схема установки для кулонометрического титрования с электрохимической индикацией к.т.т.: 1 - рабочий (генераторный) электрод; 2 – вспомогательный электрод; 3 – индикаторный
16
www.mitht.ru/e-library
электрод; 4 – электрод сравнения; 5 – мешалка; - контур генераторной системы; - контур индикаторной системы.
аналогичную по форме кривой амперометрического титрования по току титранта.
При образовании в ходе кулонометрического титрования окрашенных соединений можно использовать индикацию к.т.т., измеряя оптическую плотность раствора в зависимости от времени электролиза.
Чувствительность кулонометрического титрования зависит от способа определения конечной точки титрования. Наиболее чувствительными, т.е. позволяющими определять наиболее низкие содержания, являются амперометрические и спектрофотометрические методы индикации.
3.1. ОБЛАСТИ ПРИМЕНЕНИЯ КУЛОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
Методы кулонометрического титрования разработаны для всех типов химических реакций: кислотно-основных, осаждения, комплексообразования и окисления-восстановления (см. табл.1 и 2).
Примеры кулонометрического титрования |
Таблица 1. |
|||||||||||
|
||||||||||||
Определяемое |
Генераторная |
Химическая реакция |
||||||||||
вещество |
электродная реакция |
|
||||||||||
Кислоты: сильные |
Н2О+ |
|
=1/2Н2 + ОН- |
Н3О+ + ОН- 2 Н2О |
||||||||
е |
||||||||||||
(Н3О+) и слабые (НА) |
|
|
|
|
|
|
|
|
|
|
|
НА + ОН- А- + Н2О |
Основания: сильные |
|
|
|
|
1 |
+ |
ОН- + Н3О+ 2 Н2О |
|||||
|
|
|||||||||||
(ОН-) и слабые (МОН) |
3Н2О-2е= |
|
О2+2Н3О |
МОН+Н3О+ М++2Н2О |
||||||||
2 |
||||||||||||
Cl-, Br-, I- (Hal-), мер- |
Ag(т.) - |
|
|
= Ag+ |
Hal- + Ag+ AgHal |
|||||||
е |
||||||||||||
каптаны (RSH) |
|
|
|
|
|
|
|
|
|
|
|
RSH+Ag+ AgSR + Н+ |
Ca+2, Cu+2, Zn+2, Pb+2 и др. |
HgNH3Y-2 + NH4+ + 2 |
|
= |
HY-3+ Ca+2 CaY-2+ H+ и |
||||||||
е |
||||||||||||
|
Hg(ж)+2NH3+HY-3, где Y-4 – |
т.д. |
||||||||||
|
ион ЭДТА |
|
|
|
|
|||||||
Наибольшее распространение получили кулонометрические методы титрования генерированными окислителями и восстановителями (табл.2). Одним из примеров является кулонометрическое определение воды генерированным иодом. Преимущество кулонометрического метода перед обычным классическим заключается в определении малых содержаний (10-4 - 10-5 % масс.) с высокой точностью (относительная по-
грешность 0,01-0,02).
Кулонометрическое титрование целесообразно использовать для определяемого вещества. Относительное стандартное отклонение обычно составляет 0,001-0,01. Этот метод во многих случаях позволяет осуществить титрование, которое нельзя выполнить обычными классическими методами. В качестве примера можно указать методики, в
17
www.mitht.ru/e-library
которых используются неустойчивые или с большим трудом получаемые титранты, такие как хлор, бром, Cr(II), Ag(II), Cu(I) и другие. Кроме того, кулонометрическое титрование не требует приготовления стандартных растворов, в процессе анализа растворов не разбавляется, процесс может быть легко автоматизирован.
Таблица 2. Примеры кулонометрического титрования электрогенерированными
окислителями и восстановителями
Титрант |
Генераторная электродная |
Определяемое |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
реакция |
вещество |
Cl2 |
2Cl - - 2 |
|
|
|
|
|
|
|
|
|
= Cl2 |
As(III), I- |
||||
е |
||||||||||||||||
Br2 |
2 Br - - 2 |
|
|
|
|
|
= Br2 |
Фенол, анилин, окси- |
||||||||
е |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
хинолин, N2H4, As(III), |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sb(III), U(IV) и др. |
I2 |
2 l - - 2 |
|
|
|
|
|
|
= l2 |
H2S, S2O32-, As(III), |
|||||||
е |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sb(III), Н2О и др. |
Ce(IV) |
Ce(III) - |
|
|
|
|
|
= Ce(IV) |
Sn(II), Fe(II), Ti(III) и др. |
||||||||
е |
||||||||||||||||
Ag(II) |
Ag(I) - |
|
|
|
|
= Ag(II) |
Ce(III), U(IV) и др. |
|||||||||
е |
||||||||||||||||
Fe(II) |
Fe(III) + |
|
|
|
|
= Fe(II) |
Cr(VI), Mn(VII), U(V) и |
|||||||||
е |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
др. |
Ti(III) |
TiO+2 + 2H+ + |
|
= Ti(III) + H2O |
Fe(II), U(VI) и др. |
||||||||||||
е |
||||||||||||||||
4.ВОПРОСЫ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ
1.На чем основаны кулонометрические методы анализа?
2.Какие законы положены в основу кулонометрических определений? Сформулируйте их.
3.В чем сущность прямой кулонометрии и кулонометрического титрования?
4.Каковы особенности кулонометрического анализа при контролируемой силе тока (амперостатической кулонометрии)?
5.На чем основана прямая кулонометрия при контролируемом потенциале?
6.Какими способами можно измерить количество электричества
вкулонометрии?
7.Объясните принцип действия электрохимических кулонометров (гравиметрического, титриметрического, газового).
8.Почему при кулонометрических определениях необходимо обеспечить 100 %-ный выход по току или точно знать его величину?
9.Каким образом выбирают потенциал рабочего электрода для прямой потенциометрической кулонометрии? От каких факторов зависит выбор материала рабочего электрода?
10.Какими приемами можно уменьшить время, необходимое для завершения прямых кулонометрических определений при контролируемом потенциале?
18
www.mitht.ru/e-library

11.Какие способы используются для фиксирования конечной точки при использовании кулонометрического титрования?
12.Почему при избытке вспомогательного реагента процесс получения электрогенерированного кулонометрического титранта протекает со 100%-ным выходом по току?
13.Напишите уравнение электрохимической реакции, протекающей при генерировании титранта при кулонометрическом титровании кислоты основанием.
14.Начертите кривую кулонометрического титрования слабой кислоты электрогенерированными ОН- ионами (способ определения окончания титрования - потенциометрический, индикаторный электрод - стеклянный).
15.Начертите кривую кулонометрического титрования слабого основания электрогенерированными Н+-ионами (способ индикации - потенциометрический, индикаторный электрод - стеклянный).
16.Восстановитель ( А ) титруют окислителем ( В ) кулонометрически по реакции: А + В = С + Д. Титрант (В) получают окислением вспо-
могательного компонента С (С - nе B) на рабочем электроде. Из какого материала следует изготовить этот электрод? Начертите форму кривой кулонометрического титрования, если использовать потенциометрический способ определения завершения титрования (выбрать индикаторный электрод).
17.Какие электрохимические параметры поддерживаются постоянными при кулонометрическом титровании с амперометрической фиксацией конечной точки титрования?
18.Какие физические величины используются для определения количества электричества, затраченного на генерирование титранта?
19.Какие факторы влияют на воспроизводимость определения при использовании кулонометрического титрования?
20.Каковы преимущества кулонометрического титрования по сравнению с амперометрическим и потенциометрическим титрованием?
21.Изменением какого параметра можно менять скорость кулонометрического титрования?
5.Литература
1.Зозуля А.П. Кулонометрический анализ.-М.-Л.:Химия, 1968.
2.Агасян П.К., Хамракулов Т.К. Кулонометрический метод анализа.-
М.:Химия, 1984.
3.Плэмбек Дж. Электрохимические методы анализа. Основы теории и приложение.- М.: Мир, 1985.
4.Речниц Г.А. Электроанализ при контролируемом потенциале.- Л.: Хи-
мия, 1967.
19
www.mitht.ru/e-library
Издание учебное
Александр Петрович Рысев
Игорь Юрьевич Ловчиновский,
КУЛОНОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Учебно-методическое пособие
Подписано в печать , Формат 60х84/16. Бумага писчая. Отпечатано на ризографе. Уч.изд.листов 1,0. Тираж 400. Заказ №
Лицензия на издательскую деятельность ИД № 03507 от 15.12.2000
Издательско-полиграфический центр.
119571 Москва, пр.Вернадского, 86.
20
www.mitht.ru/e-library
