
- •Природа и свойство электронновозбужденных состояний органических молекул.
- •Электронные состояния комплексных соединений
- •Закономерности, характеризующие спектр люминесценции
- •1. Влияние рН среды и растворителя.
- •2. Влияние температуры.
- •3. Влияние посторонних примесей.
- •Обработка результатов анализа.
Федеральное агентство по образованию
Московская Государственная Академия Тонкой Химической Технологии
им. М.В.Ломоносова
Кафедра аналитической химии
Люминесценция
Выполнили студенты гр. ХТ-407
Баева Е.
Горбов П.
Ивкин В.
Козлова М.
Рыкун А.
Серегина А.
Сумина А.
Тимофеев Г.
Уварова В.
Москва 2011
Содержание:
Теоретическая часть. Люминесценция……………………………………………3
Механизм возникновения люминесценции………………………..…………….3
Качественный анализ……………………………….............……………………….6
Количественный анализ…………………………….............………………………7
Факторы, влияющие на интенсивность люминесценции…………………...7
Практическое применение……………………..……………………………………8
Общая характеристика метода……………………………………………………..9
Задание к лабораторной работе…………………………………………………..10
Методика определения............................................................................10
Обработка результатов данных, техника работы на флуориметре ЭФ-ЗМА.......……….....…………………………………..…………………………….12
Теоретическая часть. Люминесценция.
Люминесценция- свечение, избыточное над температурным, и обладающее длительностью не менее чем 10-10 с, что превышает период световых колебаний. От излучения нагретых тел она отличается своей неравновесностью: люминесценция практически не использует тепловую энергию излучаемой системы, поэтому ее часто называют холодным светом. Это определение отличает люминесценцию также от всех других видов неравновесного свечения- рассеяния и отражения света, комбинационного рассеяния.
Люминесценция возникает в результате электронного перехода при возвращении частиц из возбужденного состояния в нормальное. Таким образом, молекула преобразует поглощенную энергию в собственное излучение. Этим люминесценция также отличается от процессов несобственного излучения- рассеяния и отражения света. Люминесцирующие вещества могут находиться в любом агрегатном состоянии.
В возбужденном состоянии частицы люминесцирующего вещества могут переходить под действием света, и тогда люминесценцию называют фотолюминесценцией (флуоресценцией или фосфоресценцией), под действием рентгеновского излучения - рентгенолюминесценцией, в результате химической реакции - хемилюминесценцией.
Эффективность преобразования энергии поглощенного света в энергию люминесценции характеризуется энергетическим и квантовым выходом люминесценции. Отношение излучаемой энергии люминесценции к энергии поглощенного света называют энергетическим выходом люминесценции, а отношения числа излучаемых квантов к числу поглощенных называют квантовым выходом люминесценции.
Механизм возникновения люминесценции.
-
Природа и свойство электронновозбужденных состояний органических молекул.
Поглощение кванта света приводит к изменению электронной конфигурации органической молекулы, к переходу ее из основного состояния в возбужденное. Электронное возбуждение молекулы всегда связано с некоторым колебательным возбуждением, поэтому обычно рассматривают электронно- колебательно- вращательные состояния молекулы.
Электронно-возбужденное состояния молекулы могут отдавать энергию возбуждения несколькими путями. Различают химическую дезактивацию (в результате реакций) и физическую. Важнейшими физическими процессами дезактивации являются:
-колебательная релаксация (КР)- τ = 10-12-10-13 с- безизлучательный переход с одного колебательного уровня на другой колебательный уровень;
-флуоресценция (ФЛ)- τ =10-9 с- излучение кванта света в результате энергетического перехода между двумя электронными состояниями одинаковой спиновой мультиплетности;
-фосфоресценция (Ф)- τ =10-2-10-3 с- излучение кванта света в результате энергетического перехода между двумя электронными состояниями различной спиновой мультиплетности;
-внутренняя конверсия (ВК)- τ =10-10-10-13 с- безизлучательный переход между двумя электронными состояниями одинаковой спиновой мультиплетности;
-интеркомбинационная конверсия (ПК) - τ= 10-1 -10-3 с, τ= 10-7с- безизлучательный переход между двумя электронными состояниями различной спиновой мультиплетности.
Все физические процессы дезактивации могут конкурировать между собой и с химическими реакциями.
-
Электронные состояния комплексных соединений
Положения, характеризующие органические молекулы, справедливы и для неорганических комплексных соединений. В комплексе это квартетные и дублетные состояния, а в органической молекуле - синглетные и триплетные.
-
Закономерности, характеризующие спектр люминесценции
Зависимость интенсивности люминесценции (1), выраженной в условных единицах, от длины волн λ называется спектром люминесценции. Спектр люминесценции, как и спектр поглощения, может состоять из одной или нескольких полос. Полосы могут быть широкими или узкими. Каждая полоса характеризуется положением максимума (λmax) и интенсивностью люминесценции I в условных единицах.
К числу закономерностей, определяющих спектр люминесценции, относятся: правило Стокса - Ломмеля; спектр люминесценции и ее максимум всегда сдвинут в сторону длинных волн по сравнению со спектром поглощения.
Смещение максимума люминесценции в длинноволновую область спектра лежит в основе визуального наблюдения эффекта люминесценции при возбуждении невидимыми ультрафиолетовыми лучами.
Графически смещение спектра люминесценции бериллий-моринового комплекса показано на рис.1. По оси ординат отложены значения оптической плотности D и относительной яркости люминесценции в условных единицах 1. По оси абсцисс - длины волн.
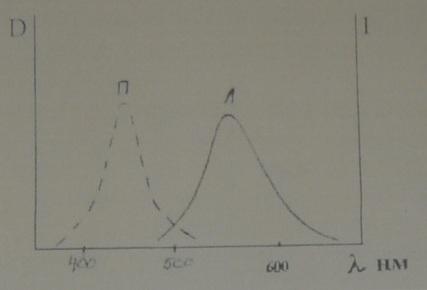
Рис.1 Спектры поглощения П и люминесценции Л бериллий-моринового комплекса.
Согласно квантовым представлениям, правило Стокса означает, что энергия кванта, излучаемого флуоресцирующим веществом - hVf, всегда меньше кванта поглощаемого света - hVa. Экспериментальная проверка правила Стокса - Ломмеля показала, что оно не всегда выполняется.
Правило зеркальной симметрии Лёвшина: спектры поглощения и излучения, изображенные в функции частот, оказываются зеркально симметричными относительно прямой, проходящей перпендикулярно к оси частот через пересечения кривых обоих спектров.
Это правило иллюстрируется рис. 2, на котором представлены спектры поглощения П и люминесценции Л родамина 6Ж в ацетоне. По оси ординат отложены величины, пропорциональные интенсивностям излучения и молекулярным коэффициентам погашения К. По оси абсцисс - значение частот и длин волн, которые связаны между собой соотношением V= C/λ.
Наличие зеркальной симметрии спектров поглощения и излучения указывает на тождество расположения колебательных уравнений в невозбужденной и возбужденном состояниях молекулы.
Рис.2
Спектр поглощения П и спектр люминесценции
Л родамина 6Ж в ацетоне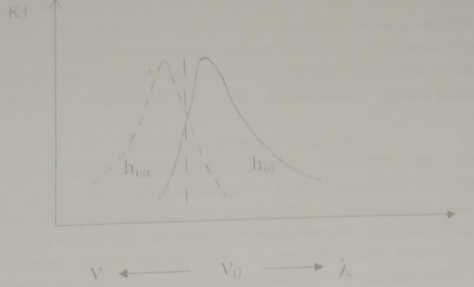
Фотоны hVa и hVf расположены на одинаковом расстоянии справа и слева от Vo Расстояние между ними в энергетической шкале соответствует величине повышения колебательной энергии ΔEv молекулы.
Зеркальная симметрия позволяет определить спектр поглощения или спектр люминесцентного излучения в том случае, когда непосредственное измерение одного из них затруднено.
Независимость спектра люминесценции от длины волны возбуждающего света.
При возбуждении вещества квантами света любой длины волны всегда возникает одни и тот же полный спектр люминесценции с неизменным распределением интенсивности Постоянство спектра люминесценции при изменении частоты возбужденного света указывает на то, что между актом поглощения фотона и люминесцентным свечением происходит перестройка возбужденной молекулы до одинакового исходного состояния.
Качественный анализ
Очень чувствительны люминесцентные качественные реакции, когда добавление некоторых органических реагентов к раствору неорганических веществ вызывает яркую люминесценцию. Например, интенсивную люминесценцию вызывает добавление салициловой кислоты к раствору соли цинка, что может быть использовано для его качественного открытия. Качественный люминесцентный анализ основан на способности исследуемого вещества в соответствующих условиях люминесцировать или, реже, гасить люминесценцию. Возникновение исчезновение люминесценции обычно наблюдается визуально.
Достоинство люминесцентных реакции является их исключительно низкий предел обнаружения.
Большое значение имеет люминесцентный анализ в биологии и в медицине для диагностики заболеваний рака, малярии и др., контроля за качеством лекарственных препаратов, анализа биологически активных веществ - витаминов, антибиотиков и т.д.
В сельском хозяйстве и пищевой промышленности люминесцентный анализ используют для определения жизнеспособности семян, анализа пищевых продуктов и т.д. По цвету люминесценции можно установить сорт муки: чем больше в ней отрубей, тем интенсивнее свечение. Люминесценция позволяет легко обнаружить начальную стадию загнивания различных овощей и фруктов.
Количественный анализ
Количественный люминесцентный анализ основан на использовании соотношения Iл = kс, связывающего интенсивность флуоресценции с концентрацией флуоресцирующего вещества. В практике количественного люминесцентного анализа обычно применяется метод градировочного графика на основе этого уравнения.
Большой интерес вызвало применение люминесцентных индикаторов в титриметрических методах. Люминесцентные индикаторы (α-нафтиламин, акридин и др.) изменяют цвет или интенсивность люминесценции в зависимости от свойств участников реакции, рН раствора или присутствии окислителя. Применение люминесцентных индикаторов позволило решить ряд сложных аналитических задач, связанных, в частности, с анализом мутных и окрашенных сред (фруктовые соки, вина).
Существенно увеличивается интенсивность люминесценции при замораживании растворов. Это явление используется для количественного определения свинца, висмута и сурьмы в виде галогенидных комплексов. Люминесценция наблюдается при замораживании органических веществ и комплексов металлов с органическими лигандами.
Факторы, влияющие на интенсивность люминесценции
