
Вариант задач по кинетики_бе
.pdf
1
2.1.Зависимость константы скорости от температуры.
2.1.1.У р а в н е н и е А р р е н и у с а. Скорость химических реакций обычно сильно зависит от температуры. Так, по правилу Вант - Гоффа для реакций в растворах при повышении температуры на десять градусов скорость увеличивается в 2-3 раза. Математически зависимость константы скорости от температуры выражается
экспоненциальным уравнением Аррениуса k = А exp(- |
E |
|
), |
|
(2.1) |
||||||
R T |
|
||||||||||
|
|
|
|
|
|
|
|
||||
параметры которого называются: А - предэкспонентом, Е - энергией активации. |
|
||||||||||
В логарифмической форме уравнение Аррениуса принимает линейную форму от |
|||||||||||
обратной температуры |
|
|
|
|
|
|
|
||||
ln k = ln B − |
|
E |
, |
(2.2) |
|||||||
RT |
|||||||||||
|
|
|
|
|
|
|
|||||
или в дифференциальном виде |
|
|
|
|
|
|
|
||||
|
d ln k |
E |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|||
|
dT |
RT |
|
|
|
|
|||||
|
|
|
|
|
|
2 . |
|
(2.3) |
|||
Параметры уравнения Аррениуса определяются экспериментально при изучении температурной зависимости константы скорости. Если имеются значения константы скорости при двух температурах, то энергия активации рассчитывается по формуле
E |
RT1T2 ln k 2 / k1 |
|
(2.4) |
||
T2 |
T1 |
||||
|
|
||||
При большем количестве опытных точек, строят график зависимости |
lnk = |
||||
f(1/T), угловой коэффициент наклона которого равен -Е/R в соответствии с уравнением (2.2). Так как температурный интервал экспериментальных данных обычно не превышает нескольких десятков градусов, графическое определение предэкспонента А затруднено из-за необходимости далекой экстраполяции. Поэтому величину А рассчитывают аналитически из уравнения 2.1, используя экспериментальные значения k при разных температурах и найденное значение энергии активации.
П р и м е р 2.1.1
Для реакции йодистого этила с алкоголятом натрия в этиловом спирте
CH3I + C2H5O- = CH3OC2H5 + I-
найдены следующие значения константы скорости второго порядка
t, 0C |
0 |
6 |
12 |
18 |
24 |
k 105, л/(мол с) |
5,00 |
11,8 |
24,5 |
48,8 |
100 |
Определить энергию активации реакции и предэкспоненциальный член уравнения Аррениуса, рассчитать константу скорости при 15 о С.
|
|
|
|
2 |
|
|
|
Решение. Рассчитаем необходимые для построения графика 2.2 величины |
|||||||
|
T, K |
|
273 |
279 |
285 |
291 |
297 |
|
T-1 103, К- 1 |
3,663 |
3,584 |
3,508 |
3,436 |
3,367 |
|
|
ln k |
|
1,609 |
2,468 |
3,199 |
3,888 |
4,605 |
(Обращаем Ваше внимание на то, что при расчете величин 1/T нужна учитывать |
|||||||
третий знак после запятой, так как область изменения аргумента составляет всего 0,3 |
|||||||
единицы и в противном случае точность определения искомой величины не будет |
|||||||
соответствовать точности экспериментальных данных) |
|
|
|||||
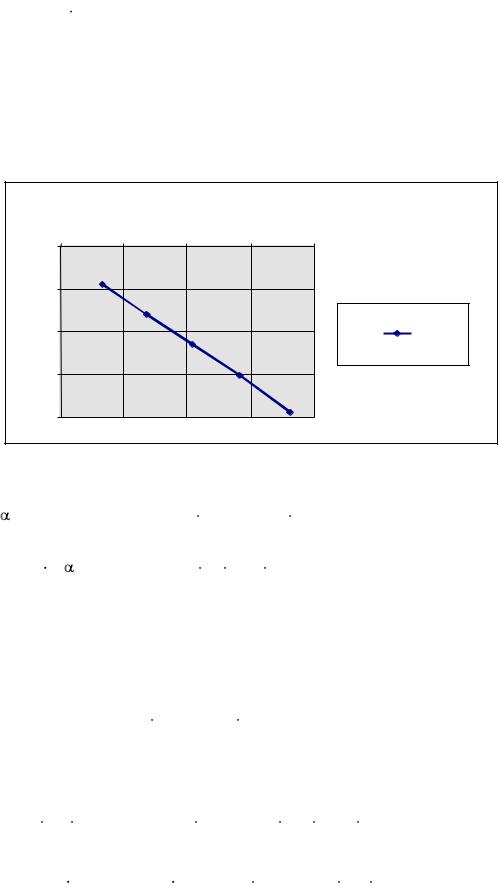
Построим график ln k - 1/T и найдем угловой коэффициент его наклона (рис. 2.1) |
|||||||
|
0,0033 |
0,0034 |
0,0035 |
0,0036 |
0,0037 |
|
|
|
-6 |
|
|
|
|
|
|
|
ln k |
|
|
|
|
y = 26,8326 -10020,76 x: |
|
|
|
|
|
|
r = 0,999716 |
||
|
-7 |
|
|
|
|
|
|
|
-8 |
|
|
|
|
|
ln k |
|
|
|
|
|
|
|
|
|
-9 |
|
|
|
|
|
|
|
-10 |
|
|
|
|
|
|
|
|
|
1/ T |
|
|
|
|
Рис. 2.1. Зависимость логарифма константы скорости реакции от обратной |
|||||||
температуры. |
|
|
|
|
|
|
|
tg |
= -9,74 + 7,237/(3,65 - 3,4) 10-3 = -10,02 |
103 К, такое же значение коэффициента |
|||||
при аргументе в регрессионном уравнении. |
|
|
|
||||
E = - R tg = 8,314 Дж/(моль К) 10,02 103 К = 83306 Дж/моль = |
= 83,3 |
кДж/моль.
Для расчета предэкспонента используем значение k при 24оС (точка хорошо лежит на графике)
lnА = ln k + E/RT = - 6,905 + 10020/297 = - 6,905+33737 =26,83.
Можно использовать также значение свободного члена в регрессионном уравнении. Отсюда А = 4, 50 1011 л/(моль с)
Используя найденные параметры уравнения Аррениуса можно определить константу скорости данной реакции при любой температуре в рабочем интервале, например при 15оС
k15 =4,50 1011 exp[-83300/(8,314 288)]= 4,50 1011 7,786 10-16 = =35,0.10-5 л/(моль.с) или так
ln (k15/k24) = E (T2 -T1) /R  T2 T1 = 83300 (- 9)/ (8,314 288 297 ) = - 1,054
T2 T1 = 83300 (- 9)/ (8,314 288 297 ) = - 1,054

|
3 |
k15/k24 = 0,349 |
k15 = 0,349 10-3 = 3,49 10-4 л/(моль с) |
Вариант 1,
1. Константа скорости второго порядка для реакция нитроэтана со щелочью
СН3СН2NО2 + ОН− = Н2О + СН3СН2NО2−
имеет при 0оК k = 39,1 л/моль*мин. Был приготовлен раствор 0,004 М нитроэтана и 0,005М NаОН, Через какое время прореагирует 90% нитроэтана?
2, Реакция окисления -аллилпалладийиодида иодом в водных растворах описывается следующим стехиометрическим уравнением:
-С3Н5PdI H2O + I2 = C3H5I + PdI2 + H2O
Начальные концентрации комплекса и йода равны 1,0 10-3 и 0,5 10-3 моль/л, За кинетикой реакции следили по изменению концентрации йода, Температура 200С,
Полученные результаты приведены в таблице: |
|
|
|
|
|||
Время , мин |
0 |
5 |
10 |
20 |
30 |
40 |
50 |
[I2] 103, моль/л |
0,500 |
0,334 |
0,237 |
0,130 |
0,077 |
0,047 |
0,029 |
Определите порядок реакции и найдите среднее значение константы скорости реакции,
3.Изучалось гетерогенное разложение аммиака на вольфрамовой проволоке при Т =
1373 К : NН3 = 1/2N2 + 3/2 Н2
Период половины превращения ( 1/2) в зависимости от начального давления аммиака Ро указан в таблице:
Ро, мм рт, ст, |
265 |
130 |
58 |
35 |
1/2 , мин |
7,6 |
3,7 |
1,7 |
1,0 |
Определите порядок реакции и константу скорости,
4.Определите порядок реакции 2СО=СО2+СТВ при 583,20С, если в одном случае общее давление в реакции за 30 мин уменьшилось с 1,049,105 до 0,924,105 Па, а в другом за тот же промежуток времени оно уменьшилось с 0,714,105 до 0,624,105 Па
(V=const),
5.Вычислите порядок реакции пиролиза диборана ( В2Н6 (газ) ) при 10оС из
следующих данных по зависимости |
скорости |
реакции от концентрации |
диборана и найдите константу скорости, |
|
|
[ B2Н6 ] ,102, моль/л , |
2,153 |
0,433 |
г,104, моль/(л,час) |
7,4 |
0,73 |
6. Константа скорости инверсии сахарозы
С12Н22О11 + Н2О = С6Н12О6 + С6Н12О6
глюкоза фруктоза изменяется с ростом температуры следующим образом:

|
|
4 |
|
t, 0C |
20 |
30 |
50 |
k 104, с-1 |
2,758 |
10,98 |
137,4 |
Определите энергию активации и предэкспоненциальный множитель уравнения Аррениуса.
7.При изучении кинетики димеризации бутадиена получено уравнение зависимости константы скорости от температуры:
lgk = 5,062 +0,5 lgТ -5070/Т [л/(моль.с)]
Определите энергию активации и долю активных столкновений при 578 К, если стерический множитель равен 2.3.10-5.
8.Определите порядок реакции распада озона, если механизм его распада можно представить схемой:
O3 + M O2 + O + M O2 + O
+ M O2 + O O3
O3
O3 + O 2O2
2O2
Предполагая концентрацию атомов кислорода во времени стационарной, получите кинетическое уравнение для скорости распада озона. Сравните скорость распада озона со скоростью образования молекулярного кислорода.
9.Кинетика фотохимического хлорирования тетрахлорэтилена в растворе C2Cl4 описывается уравнением
_ |
d[C2Cl 4] |
= k[Cl |
2 |
] |
3/2 |
|
d |
. |
|||
|
|
|
|
Реакции цепная. Получите приведенное выше уравнение, если реакция идет по следующей схеме:
|
k0 |
Cl2 + hν |
2Cl· |
|
k-1 |
Cl· + C2Cl4 |
C2Cl5· |
|
k2 |
C2Cl5· + Cl2 |
C2Cl6+ Cl· |
|
k3 |
C2Cl5· + C2Cl5· |
C2Cl6 + C2Cl4 |
10.
Вариант 2,
1.Для реакции 2NO + 2 H2 = N2 +2 H2O найдено, что порядок по оксиду азота равен 2, а по водороду - первый, При 1000К константа скорости k =6·10-4 л2/(моль2·с),
Чему равна скорость реакции при [NO]= 0,05 M и [Н2] = 0,01 М, Как изменится скорость, если концентрацию оксида азота утроить?
2.В результате реакции формальдегида с пероксидом водорода образуется муравьиная кислота. Реакция второго порядка.
НСНО + Н2О2 = НСООН + Н2О
Если смешать равные объемы молярных растворов НСНО и Н2О2, то через 2 часа при Т = 333,2 К концентрация муравьиной кислоты становится равной 0,215

5
моль/л, Вычислите константу скорости реакции и определите, через сколько времени прореагирует 98% исходных веществ,
3. По мере течения реакции между эквивалентными количествами окиси углерода и хлора, согласно уравнению СО + Сl2 = СОСl2 при 300 К в присутствии катализатора наблюдалось следующее уменьшение общего давления системы:
, мин |
0 |
5 |
10 |
15 |
21 |
Робщ,мм,рт, ст, |
724 |
675 |
654 |
622 |
600 |
Определите порядок реакции (V=const) графическим и аналитическим методом.
4, В реакции А + В = АВ |
получены следующие начальные скорости при различных |
||
начальных концентрациях реагентов : |
|
|
|
[А]0, моль/л |
1,0 |
0,1 |
1,0 |
[В]0, моль/л |
1,0 |
1,0 |
0,0025 |
r0, моль/(л ,с) |
0,025 |
0,0025 |
0,00025 |
Напишите кинетическое уравнение реакции? Определите константу скорости,
5, При 518оС время полупревращения реакции разложения ацетальдегида при начальном давлении 363 мм рт,ст, составляет 410 с, а при исходном давлении 169
мм рт, ст, 1/2 равно 880 с, Определите порядок реакции и константу скорости реакции,
6.Реакция первого порядка имеет энергию активации 125 кДж/моль, а предэкспоненциальный множитель 5·1013 с-1. При какой температуре время полупревращения для данной реакции составит а) 1 мин; б) 30 дней?
7.Рассчитайте константу скорости реакции между йодом и водородом при температуре 5000С, если средний диаметр столкновений составляет 2 10-10 м, а энергия активации 167 кДж/моль. Стерический множитель равен 1.
8.Экспериментально установлено, что порядок реакции разложения перекиси водорода в присутствии ионов Cr2O7-2 в зависимости от температуры изменяется от 0 до 2. Предположительно механизм этого процесса описывается схемой:
2H2O2 + Cr2O7-2 2H2O + Cr2O9-2 k1, k-1
Cr2O9-2 Cr2O7-2 +O2 |
k2 |
Первая стадия этого процесса протекает быстро, а вторая стадия (лимитирующая) -медленно. Найдите кинетическое уравнение реакции и объясните изменение ее порядка с температурой.
9. Реакция между пероксидом водорода и ионом Fe2+ идет по следующей схеме:
Fe2+ + H2O2 = Fe3+ + H2O + 1/2 O2
|
|
k1 |
Fe2+ |
+ H2O2 |
FeOH2+ + HO· |
|
|
k-2 |
Fe2+ |
+ HO· |
FeOH2+, |
|
|
k3 |
HO· + H2O2 |
HO2· + H2O |
|
|
|
k4 |

6
HO2· + Fe3+  Fe2+ + H+ + O2 .
Fe2+ + H+ + O2 .
В ходе реакции образуются активные промежуточные частицы - свободные радикалы НО и НО2 . Используя метод квазистационарных концентраций, по радикалу НО выведите кинетическое уравнение расходования Fe2
и НО2 . Используя метод квазистационарных концентраций, по радикалу НО выведите кинетическое уравнение расходования Fe2
10.
Вариант 3.
1.Найдено, что в реакции SO2Cl2 = SO2 + Cl2 lg[SO2Cl2] линейно убывает со временем, За 240 с концентрация реагента уменьшилась от 0,4 до 0,28 М, Каков порядок реакции и время полупревращения?
2.Фенилдиазохлорид разлагается по уравнению:
С6Н5N2Cl C6H5Cl +N2
В опыте, проводившемся при 323 К, измеряли объемы выделившегося азота, Были получены следующие результаты:
τ, мин |
6 |
9 |
12 |
14 |
18 |
22 |
24 |
26 |
30 |
∞ |
VN2, см3 |
19,3 |
26,0 |
32,6 |
36,0 |
41,3 |
45,0 |
46,5 |
48,3 |
50,4 |
58,3 |
Определите порядок реакции и константу скорости реакции,
3.Нитрование п-нитротолуола (пнт) азотной кислотой в водных растворах серной кислоты протекает по уравнению :
H3CC6H4NO2 + HNO3 = H3CC6H3 (NO2)2 + H2O
При изучении зависимости начальной скорости реакции от концентра-ции
реагентов были получены следующие данные: |
|
|
|
|
Спнт,104, моль/л |
5 |
3 |
2 |
5 |
СHNO3,, моль/л |
0,4 |
0,8 |
0,4 |
0,8 |
r,106 , моль/(л*мин) |
5 |
6 |
2 |
10 |
Определите порядок реакции по каждому реагенту и рассчитайте константу скорости реакции,
4.Пользуясь зависимостью между временем полураспада и давлением, определите
порядок для реакции конверсии пара-водорода в орто-водород при температуре 923оК, Значения давления пара-водорода и время полураспада для пара-орто- превращения водорода следующие:
Ро, мм рт,ст, |
50 |
100 |
200 |
400 |
1/2, с |
648 |
450 |
318 |
222 |
5. Газообразный азометан разлагается по реакции первого порядка:
СН3-N=N-CH3 СН3-CH3 + N2
При температуре 2870С и начальном давлении азометана равным 160 мм.рт.ст. через 100 с общее давление достигло 161,6 мм.рт.ст. Найдите константу скорости реакции
и время полупревращения при указанной температуре.
6.Константа скорости омыления этилацетата щелочью изменяется с ростом температуры следующим образом:

|
7 |
|
|
t, o C |
0 |
20 |
25 |
k, л/(моль мин) |
1,17 |
5,08 |
6,56 |
Определите энергию активации и предэкспоненциальный множитель уравнения Аррениуса.
7.Окисление оксида азота озоном являетс бимолекулярной реакцией с энергией активации 9,6 кДж/моль:
NO + O3 = NO2 + O2.
Газокинетический диаметр молекулы азота равен 3 Å а молекулы озона − 4 Å. Определите теоретическое число молекул, реагирующих в 1 м3 за 1 с при температуре 300 К и давлении 1 атм. Рассчитайте теоретическое значение предэкспонента уравнения Аррениуса для этой реакции по ТАС и сравните его с
экспериментальным значением А = 1,1.109 л/(моль·с). |
Вычислите |
стерический |
|
множитель. Сделайте выводы о характере реакции |
на основании |
полученного |
|
значения стерического множителя. |
|
|
|
8. Для следующей схемы сложной реакции: |
|
|
|
|
k1 |
|
|
A |
= X +C |
|
|
|
k-1 |
|
|
|
k2 |
|
|
X +C |
→ Пр |
|
|
где Х промежуточная высокореакционная частица
Используя метод квазистационарных концентраций по Х выведите кинетическое уравнение реакции по реагенту А.
9.Кинетика термического распада дихлорэтана в газовой фазе описывается уравнением
_ d[C2H4Cl2] |
= |
k[C2 H 4 Cl2 |
]. |
|
d |
||||
|
Согласуется ли вышеприведенное уравнение скорости со следующей схемой цепного механизма реакции?
k0
C2H4Cl2  C2H4Cl· + Cl·
C2H4Cl· + Cl·
k-1
Cl· + C2H4Cl2  C2H3Cl2· + H· , k2
C2H3Cl2· + H· , k2
C2H3Cl2·  C2H3Cl· + Cl· k3
C2H3Cl· + Cl· k3
C2H3Cl2· + стенка |
C2H3Cl2· адс. |
Используя метод квазистационарных концентраций выведите кинетическое уравнение реакции.
10.

8
Вариант 4.
1. Реакция иодирования -фенилпропиоловой кислоты образованием , - дийодкоричной кислоты:
С6Н5С=С-СООН +I2 C6H5I=ICOOH
подчиняется кинетическому уравнению второго порядка, Исходные величины были взяты в эквивалентных количествах, Кинетику реакции изучали, определяя концентрацию иода титрованием проб тиосульфатом, В таблице приводятся данные по кинетике реакции при 24,8оС, Определите среднее значение константы скорости реакции,
, мин |
0 |
114 |
273 |
405 |
662 |
1388 |
[I2], моль/л |
0,0251 |
0,0213 |
0,0177 |
0,0155 |
0,0124 |
0,0079 |
2. Для реакции гидролиза метилнитрата водой:
Н3СОNO2 +H2O = H3COH + HNO3
проходящей в избытке воды при температуре 90,5оС и при начальной концентрации метилнитрата 0,02153 моль/л, были получены следующие экспериментальные данные:
, мин |
0 |
130 |
240 |
360 |
480 |
600 |
[HNO3],103,моль/л |
0,0 |
1,75 |
3,48 |
4,85 |
6,27 |
7,57 |
, мин |
750 |
920 |
1117 |
1350 |
1695 |
|
[HNO3],103,моль/л |
8,99 |
10,49 |
11,97 |
13,53 |
14,97 |
21,53 |
Определите порядок реакции, рассчитайте среднее значение константы скорости реакции при данной температуре,
3. Термическая диссоциация окиси этилена протекает по уравнению:
(СН2-СН2)О(г) CH4 + CO
При температуре 687,70С и постоянном объеме общее давление реакционной смеси, измеренное в мм,рт,ст , изменяется со временем следующим образом:
Робщ, мм рт,ст, |
116,51 |
120,56 |
125,72 |
128,74 |
133,23 |
141,37 |
, мин |
0 |
3 |
7 |
9 |
12 |
18 |
4.Термическое разложение диоксана изучалось при температуре 504ОC, Получена следующая зависимость начальной скорости реакции от давления диоксана в начале реакции :
rо , мм рт,ст,/мин |
42,5 |
14,7 |
Ро, мм рт,ст, |
800 |
400 |
Определите порядок и константу скорости реакции,
5.Реакция нитрования п-нитротолуола азотной кислотой в водном растворе серной кислоты протекает по уравнению :
п-NO2-C6H4(CH3) + HNO3 = 2,4-(NO2)2C6H3(CH3) + H2O

9
Реакция проводилась при температуре 25оС в 94% Н2SО4 и при равных начальных концентрациях реагентов, Время полупревращения изменялось при изменении начальной концентрации п-нитротолуола следующим образом:
Со, 105, моль/л |
7,22 |
5,37 |
2,8 |
1/2, мин, |
14,5 |
19,4 |
37,5 |
Определите порядок реакции и рассчитайте константу скорости реакции.
6.Для реакции кислотного распада -аллилпалладийбромида, протекающей в растворе бромистоводородной кислоты и характеризующейся следующим стехиометрическим уравнением:
-С3Н5PdBr + HBr = C3H6 + PdBr2
изучена температурная зависимость константы скорости второго порядка:
t, 0C |
30 |
42 |
52 |
60 |
k2 106, л/(моль с) |
0.795 |
2.51 |
5.01 |
10.0 |
Графическим методом определите энергию активации и предэкспоненциальный множитель A.
7.Определите стерический фактор реакции пара-орто-превращения водорода по реакции H + p-H2 = o-H2 + H, если константа скорости этой реакции при 270С равна 7,3 104 л/(моль с), а энергия активации – 34,3 кДж/моль. Газокинетический диаметр молекул водорода 2,7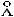 , а атомов водорода - 1,35
, а атомов водорода - 1,35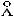 .
.
8.Для следующей схемы сложной реакции:
k1
A+C = X +C
k-1
k2
X +A → Пр +D
где Х - промежуточная высокореакционная частица.
Используя метод квазистационарных концентраций по Х и Y выведите кинетическое уравнение реакции по реагенту А.
9.Для гомогенного пиролиза метана 2CH4 = C2H6 + H2 предложен следующий механизм:
|
k0 |
CH4 |
CH3· + H·, |
|
k-1 |
CH3· + CH4 |
C2H6 + H·, |
|
k2 |
H· + CH4 |
CH3· + H2 |
|
k3 |
CH3· + H ·+ M |
CH4 + M |
М - некоторая молекула (возможно, CH4 или C2H6), которая отводит энергию рекомбинации. На основе принципа стационарного состояния, выведите уравнение для скорости образования C2H6.

10
Вариант 5,
1. Реакция амина и иодистого алкила протекает по уравнению:
(С2Н5)3N + RI [(C2H5)3NR]+I-
[х]
Скорость реакции в нитробензоле определялась при 25оС, причем найдено, что
, с |
1200 |
1800 |
2400 |
3600 |
4500 |
5400 |
х, моль/л |
0,00876 |
0,01066 |
0,01208 |
0,01392 |
0,01476 |
0,01538 |
Начальные концентрации амина и иодистого алкила равны 0,0198 моль/л, Реакция второго порядка, Определите константу скорости,
2.Если время полупревращения радиоактивного распада радия 1590 лет, то какова константа скорости реакции? (Распад идѐт как реакция первого порядка,)
3.Реакция окисления -аллилпалладийиодида иодом в водных растворах описывается следующим стехиометрическим уравнением:
-С3Н5PdI H2O + I2 = C3H5I + PdI2 + H2O
Начальные концентрации комплекса и иода равны 1,10 10-3 и 0,65 10-3 моль/л, За кинетикой реакции следили по изменению концентрации йода, Температура 250С, Полученные результаты приведены в таблице:
Время , мин |
0 |
5 |
10 |
20 |
30 |
40 |
50 |
[I2] 103, моль/л |
0,650 |
0,387 |
0,255 |
0,128 |
0,071 |
0,041 |
0,024 |
Покажите, что реакция имеет первый порядок по каждому из реагентов и найдите среднее значение константы скорости реакции,
4. Кинетика реакции димеризации бутадиена
2 С4Н6 = С8Н12
Определите порядок реакции и константу скорости по изменению общего давления (Р) в реакции при 326оС:
, мин |
0 |
3,25 |
12,18 |
17,30 |
33,0 |
Робщ, |
632,0 |
618,5 |
584,2 |
566,1 |
527,8 |
мм, рт,ст, |
|
|
|
|
|
, мин |
42,50 |
55,08 |
90,05 |
119,00 |
259,50 |
Робщ, |
508,8 |
490,2 |
453,3 |
432,8 |
381,0 |
мм, рт,ст, Определите порядок реакции и константу скорости реакции при данной
температуре.
5.Изучалась зависимость скорости распада диоксида азота от концентрации реагента
2NO2 = 2NO +O2
Определите вид кинетического уравнения этой реакции и рассчитайте значение константы скорости по следующим данным:
