
Лабораторный практикум по ОХТ
.pdf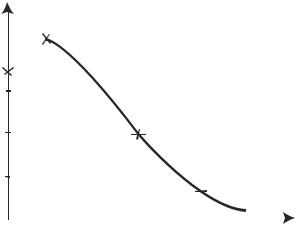
31
платины из-за летучести образующихся на ее поверхности оксидов и ее эрозии составляют при 900-950°С и 0,8 МПа 250-400 мг на 1 т 100 % HNO3 . Часть платины осаждается на стенках коммуникаций и может быть собрана и регенерирована (до 50-70 % Pt). Потери платины могут быть уменьшены за счет добавок других металлов 8-ой группы (Pd, Rh, Ru).
Время контактирования (рис.2.1.5). Реакция окисления аммиака происходит во внешнедиффузионной области, и поэтому увеличение объемной скорости оказывает положительное влияние на интенсивность процесса. С повышением, до определенного предела, объемной скорости поток газовой смеси становится более турбулентным, что увеличивает скорость диффузии исходных веществ к поверхности катализатора. Наряду с этим уменьшается время соприкосновения газовой смеси с горячими стенками аппаратов, что снижает возможность окисления аммиака до азота. При дальнейшем росте объемной скорости (уменьшении времени контактирования τ ) возможен проскок аммиака, который за контактной зоной превращается в элементарный азот при окислении кислородом. Не исключена также возможность образования азота при взаимодействии аммиака с оксидом азота (II).
В заводских условиях в зависимости от качества катализатора и точности соблюдения заданного технологического режима достигается значительная селективность процесса, и выход оксида азота (II) составляет 9298%. При оптимальных условиях проведения процесса и правильном подборе конструкционных материалов побочные реакции (2.1.3), (2.1.5), (2.1.6) не имеют существенного значения.
,% NO
90 
70
50
30 |
|
|
|
|
|
|
|
|
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5,0 |
7,5 |
|||||
2,5 |
|||||||||
|
|
|
|
τ .10 4 сек |
|
|
|
||
Рис.2.1.5. Зависимость практического выхода оксида азота(II) от времени контактирования
32
2.1.5. Схема лабораторной установки
Схема представлена на рис 2.1.6. Газообразный аммиак из баллона 1 через ротаметр 2 поступает в смеситель 3. Ротаметр 2 не калиброван и является лишь индикаторным прибором, регистрирующим заданный расход аммиака (h мм). Расход аммиака регулируют вентилем А. Воздух подают с помощью воздуходувки 4, очищают от масла в фильтре 5, заполненном стеклянной ватой, затем смешивается с аммиаком в смесителе 3. Расход воздуха замеряют ротаметром 6 и регулируют вентилем Б. Аммиачно-воздушная смесь поступает в верхнюю часть контактного аппарата 7 и проходит через комбинированный катализатор (одну платиновую сетку и слой оксидного катализатора). Полученные нитрозные газы по нижней трубке направляют на нейтрализацию.
Контактный аппарат состоит из трех частей: верхнего стального конуса, футерованного алюминием; средней цилиндрической части и нижнего конуса, изготовленного из хромоникелевой стали. С целью снижения потерь тепла аппарат снаружи покрыт теплоизоляцией. Между фланцами верхнего конуса и цилиндрической частью зажат фланец катализаторной корзины 8 для таблеток неплатинового катализатора. Над корзиной укреплена платиновая сетка. Для измерения температуры в зоне катализатора в качестве датчика используют термопару 9. В верхний конус контактного аппарата вмонтирована платиновая спираль 10, которая разогревается электрическим током от сети через ЛАТР: сила тока контролируется амперметром. Аппарат имеет смотровое стекло 11 для наблюдения за разогреванием катализатора. Трубка с краном В служит для отбора аммиачно-воздушной смеси, поступающей в контактный аппарат, трубка с краном Г - для отбора нитрозных газов. Трубка с краном Д необходима для слива слабой азотной кислоты, образующейся при частичной конденсации влажных нитрозных газов.
2.1.6.Порядок проведения опыта
1.Подготовка колб для отбора газовых проб.
1.1Круглодонные колбы с пришлифованными пробками должны быть вымыты. Горловины колб и шлифы очищают от остатков смазки фильтровальной бумагой, наносят на шлиф пробки и горловину вакуумную смазку и тщательно притирают (шлифы после смазки и притирания должны быть совершенно прозрачными).
1.2.В колбу, предназначенную для анализа аммиачно-воздушной смеси, наливают из бюретки 25 мл 0.1 н раствора серной кислоты и 3
капли индикатора метилового красного. В другую колбу,

33
предназначенную для анализа нитрозных газов, наливают 25 мл 0,1 н раствора гидроксида натрия и добавляют три капли того же индикатора. Затем пробки на колбах вновь притирают.
1.3.Колбы помещают поочередно в защитное устройство из металлической сетки и откачивают воздух вакуумным насосом до момента закипания жидкости. После этого поворачивают пробку так, чтобы отверстие в ней не совпадало с отверстием в горлышке колбы.
1.4.Взвешивают колбы на электронных весах.
|
|
|
|
|
|
|
|
|
|
|
|
A |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH3 |
1 |
|
2 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
12
Б
3
|
B |
11 |
10 |
|
|
7 |
8 |
9 |
Г |
|
5
Д 
4 |
воздух |
|
Рис.2.1.6. Схема лабораторной установки для окисления аммиака. 1 – баллон; 2,6 – ротаметры; 3 – смеситель; 4 – воздуходувка; 5 – фильтр; 7
– контактный аппарат: 8 – катализаторная корзина; 9 – термопара; 10 – спираль; 11 – смотровое окно; 12 – колба для отбора пробы газа
2.Техника проведения эксперимента.
2.1.Включают воздуходувку 4 и устанавливают вентилем Б заданный расход воздуха.
2.2.Осторожно поворачивая вентиль А, устанавливают заданный расход аммиака. Во избежание получения взрывчатой смеси содержание аммиака в аммиачно-воздушной смеси не должно превышать 11% объем. (не более 40 дел.)
2.3.Для начала реакции необходимо разогреть катализатор, для чего включают платиновую спираль 10.
34
2.4. При достижении в контактном аппарате температуры 300° С выключают ток, проходящий через спираль. В дальнейшем температура в контактном аппарате будет поддерживаться за счет тепла выделяющегося при реакции.
После установления постоянной температуры в контактном аппарате отбирают пробы аммиачно-воздушной смеси и смеси нитрозных газов. Эта операция выполняется двумя студентами следующим образом:
1.Проводят отдувку нитрозных газов для чего открывают кран Г и в течение нескольких секунд выпускают газ в выхлопную линию.
2.Присоединяют подготовленную колбу с кислотой к газоотборной трубке с краном В, а со щелочью к газоотборной трубке с краном Г.
3.Открывают краны В и Г.
4.Осторожно поворачивают пробки так, чтобы отверстия на них близко подошли к отросткам на горловинах колб.
5.Одновременно по счету « раз» дополнительным поворотом пробок обеспечивают поступление газа в колбы.
6.Через 3-4 с поворачивают пробки в первоначальное положение, прекращая таким образом доступ газа в колбы, перекрывают краны В и Г
иотсоединяют колбы.
7.Прекращают подачу аммиака, затем после полного охлаждения контактного аппарата выключают воздуходувку.
8.Определяют концентрации аммиака в аммиачно-воздушной смеси и оксида азота (II) в нитрозных газах (см. 6. Контроль процесса). Если нужно провести опыт при других условиях, то изменяют расход воздуха или аммиака и вновь отбирают пробы газовых смесей на анализ после установления постоянной температуры в реакторе.
Экспериментальные и расчетные данные записывают по прилагаемой форме.
Экспериментальные и расчетные данные |
|
Дата…………………………………………………………………………… |
|
Расход воздуха при условиях лаборатории………………………. |
л/мин |
Перепад давления в расходомере для воздуха…………………….. |
мм |
Расход аммиака при условиях лаборатории (расч. после |
|
анализа)………………………. …………………………………………. |
л/мин |
Перепад давления в расходомере для аммиака……………………. |
мм |
Температура в контактном аппарате…………………………………... ° |
С |
Данные о катализаторах: |
|
платиновый: |
|
число сеток………………………………………………………………... |
м2 |
рабочая площадь сетки………………………………………………. |
|
диаметр нити сетки………………………………………………….. |
мм |
35 |
|
|
число петель на 1 см2…………………………………………………… |
|
|
неплатиновый: |
|
|
объем катализатора………………………………………………… |
|
мл |
доля свободного объема……………………………………………….. |
оС |
|
Температура в лаборатории…………………………………………….. |
|
|
Барометрическое давление……………… ………………. |
мм. рт. ст. |
|
Время контактирования: |
|
|
для платинового катализатора ………………………………………… |
с |
|
для неплатинового катализатора……………………………………… |
с |
|
Объемное отношение кислорода к аммиаку…………………………….. |
|
|
Практический выход оксида азота (II)…………………………………. % |
|
|
Контроль процесса
После отбора газовых проб колбы взвешивают. Для полноты поглощения круговыми движениями непрерывно перемешивают содержимое колб в течение 40 мин. Затем открывают пробки, смывают с них дистиллированной водой капли раствора и производят титрование. В колбе с пробой аммиачно-воздушной смеси оттитровывают избыток кислоты 0,1 н раствором щелочи. В колбе с пробой нитрозных газов оттитровывают избыток щелочи 0.1 н раствором кислоты.
Результаты анализа газовых фаз заносят в табл.2.1.1.
|
|
|
Таблица 2.1.1 |
|
Анализ газовых фаз |
|
|
|
|
|
|
|
|
|
|
Определение |
Определение |
|
|
|
содержания NH3 |
содержания NО |
|
|
|
в исходном газе |
в нитрозных газах |
|
|
|
|
|
|
|
№ колбы |
|
|
|
|
|
|
|
|
|
Масса колб, г: |
|
|
|
|
после отбора пробы |
|
|
|
|
|
|
|
|
|
до отбора пробы |
|
|
|
|
Навеска, г |
|
|
|
|
|
|
|
|
|
Количество раствора NaOH, мл |
|
|
|
|
исходное |
|
|
|
|
|
|
|
|
|
на обратное титрование |
|
|
|
|
Количество раствора H2SO4 мл: |
|
|
|
|
исходное |
|
|
|
|
|
|
|
|
|
на обратное титрование |
|
|
|
|
|
|
|
|
|
|
C NH 3 = % масс. |
C NO = |
% масс. |
|
36
На основании полученных аналитических данных рассчитывают концентрацию аммиака в аммиачно-воздушной смеси и оксида азота (II) в нитрозных газах:
|
|
|
C NH 3 |
= |
(a |
1 N |
1 |
- b2 N 2 )× 17 × 100 |
||||
|
|
|
|
|
|
1000 |
× |
, % масс. |
||||
|
|
|
|
|
|
|
|
|
g 1 |
|||
|
|
|
C NO |
= |
(a |
2 N |
2 |
- b1 N |
1 |
)× 30 × 100 |
, % масс. |
|
|
|
|
|
|
|
1000 |
|
|
||||
|
|
|
|
|
|
|
|
|
× g 2 |
|||
где |
N 1 |
и N 2 |
- нормальности кислоты и щелочи соответственно |
|||||||||
|
g1 |
и g2 |
- |
навески проб аммиачно-воздушной смеси и |
||||||||
|
|
|
|
нитрозных газов, соответственно, г; |
||||||||
|
a1 |
и a2 |
- |
количества кислоты или щелочи, соответственно, |
||||||||
взятые для поглощения, мл.
b1 и b2 - количества кислоты или щелочи, соответственно, пошедшие на обратное титрование, мл.
На основе полученных данных рассчитывают выход оксида азота(II) по аммиаку, который, с учетом допущения о 100 % степени превращения аммиака, совпадает с селективностью):
|
C NO |
× |
M NH |
3 |
|
|
η NONH 3 = |
M NO |
|
|
× 100 (%) |
||
C NH 3 |
|
|||||
|
|
|
|
|||
где M NO и M NH 3 - молекулярные массы оксида азота (II) и аммиака.
Технологические расчеты
Определяют содержание аммиака и воздуха в аммиачновоздушной смеси в объемных процентах. Для этого пользуются формулой:
37
|
|
|
|
|
|
C NH 3 |
× 100 |
|
||||
|
|
|
СNH 3 объем. |
= |
|
M NH 3 |
(%) |
|||||
|
|
|
|
|
|
|
||||||
|
|
|
C NH |
|
|
+ |
C |
|
||||
|
|
|
|
|
3 |
|
в |
|
||||
|
|
|
|
|
M NH 3 |
M в |
||||||
|
|
|
|
|
|
|||||||
где C NH 3 |
, Cв |
- |
концентрации |
аммиака |
|
и воздуха, % масс., |
||||||
M NH 3 |
, M в |
- |
молекулярные массы аммиака и воздуха. |
|||||||||
2.1.7.Задание
1.Провести опыт при заданных условиях с записью всех данных по прилагаемой форме.
2.Сделать анализ газа до и после контактирования.
3.Рассчитать содержание аммиака и воздуха в аммиачновоздушной смеси в объемных процентах и расход аммиака в л/мин при условиях лаборатории.
4.На основании экспериментальных данных рассчитать выход оксида азота (II), объемное отношение кислорода к аммиаку, время контактирования для платинового и неплатинового катализаторов.
2.1.8.Техника безопасности
Сцелью исключения образования взрывоопасных смесей аммиака с воздухом система перед началом работы должна быть продута воздухом.
По этой же причине режим работы, заданный преподавателем, должен строго соблюдаться.
Эвакуирование воздуха из колб во избежание взрыва проводить
сиспользованием специального устройства.
Библиографический список
1.Караваев М.М., Засорин А.П., Клещев Н.Ф. Каталитическое окисление аммиака. -М.: Химия, 1983. -232 с.
2.Кутепов A.M.. Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. - М.: ИКЦ “Академкнига” ., 2003. -528 с.
38
2.2.Электрохимическое получение гидроксида натрия, хлора
иводорода диафрагменным методом
2.2.1.Цель работы. Знакомство студентов с основными закономерностями протекания электролиза в диафрагменной ванне непрерывного действия и особенностями расчета основных технологических показателей электрохимического процесса.
2.2.2. Введение
Основным промышленным способом одновременного получения гидроксида натрия, хлора и водорода является электролиз водного раствора хлорида натрия. Существуют два параллельных производства гидроксида натрия: с использованием жидкого ртутного катода (амальгамный метод) и с твёрдым катодом (диафрагменный метод). Последний реализуется в проточных электролитических ваннах с фильтрующей диафрагмой, разделяющей анодное и катодное пространство.
Электролит, находящийся в катодном пространстве называют католитом, в анодном – соответственно анолитом.
Диафрагменный способ прост в аппаратурном оформлении, относительно дешев и не использует ртуть, пары которой опасны для здоровья человека. Однако, необходимо отметить, что гидроксид натрия, получаемый при использовании электролизёра диафрагменного типа, не обладает достаточной чистотой и не может быть использован, например, в производстве искусственного волокна или целлюлозы.
2.2.3. Теоретические основы процесса
Процесс электрохимического получения гидроксида натрия, хлора и водорода, как и любой другой химико-технологический процесс, может быть проанализирован с термодинамической и кинетической точки зрения.
Электродные реакции и термодинамика процесса электролиза водного раствора хлорида натрия в диафрагменной ванне.
Электролиз концентрированного раствора хлорида натрия можно охарактеризовать как сложный гетерогенный процесс, протекающий на границе раздела фаз: твердый электрод – жидкий электролит – газ.
Процесс может быть описан суммарным уравнением:
2NaCl + 2Н2О = |
2NaOH + H2 + |
Cl2 |
(2.2.1) |
электролит |
катодный |
анодный |
|
|
продукт |
продукт |
|
39
В реальных условиях получения гидроксида натрия в ванне диафрагменного типа протекают следующие основные электродные реакции:
на катоде выделение водорода (процесс восстановления):
К ½ 2Н2О + 2е- = Н2 + 2ОН-, |
(2.2.2) |
на аноде - хлора (процесс окисления):
А ½ 2Cl- - 2e- = Cl2 |
(2.2.3) |
Вероятность протекания различных электродных реакций на катоде и аноде при проведении процесса в стандартных условиях (25ОС, Р = 1 атм., активность ионов равна 1) можно оценить на основании величины стандартного электродного потенциала (ЕО). На катоде в первую очередь протекают те процессы, стандартный электродный потенциал которых наиболее электроположителен, на аноде реализуются процессы с наиболее электроотрицательным значением ЕО. Стандартные потенциалы электродных реакций, протекание которых принципиально возможно при электролизе раствора хлорида натрия, приведены в табл. 2.2.1.
Таблица 2.2.1. Электродные реакции и потенциалы разряда ионов
№ |
|
Потенциал разряда, В |
|||
п/п |
Электродная реакция |
Стандартный, |
Равновесный |
В условиях |
|
|
|
ЕО |
|
ЕP |
электролиза, Е |
|
|
|
|
|
|
1. |
2Cl- - 2e- = Cl2 |
+ 1,36 |
|
+ 1,32 |
+ 1,57 |
2. |
4OH- - 4e- = O2 + 2H2O |
+ 0,40 |
|
+ 0,82 |
+ 1,91 |
|
(в нейтр. и кислых р-рах |
|
|
|
|
|
2Н2О – 4е- =О2 + 4Н+ ) |
|
|
|
|
3. |
Na+ + e- = Na |
- 2,71 |
|
- 2,72 |
- 2,72 |
4. |
2H3O+ + 2e- = H2 +2H2O |
0,00 |
|
- 0,41 *) |
- 1,13 |
|
(в нейтр. и щелоч.р-рах |
|
|
|
|
|
2Н2О + 2е- =Н2 + 2ОН- ) |
|
|
|
|
|
|
|
|
|
|
*) При выделении водорода из щелочного раствора E p |
+ = - 0,83 В |
|
|||
|
|
|
H |
|
|
Анализируя данные табл. 2.2.1 можно сделать вывод, что при стандартных условиях (электрод Pt) на катоде наиболее вероятным является выделение водорода, а на аноде – кислорода в результате разрядки гидроксоаниона. Выделение металлического натрия из водного раствора на твердом электроде невозможно, поскольку эта реакция
40
(табл. 2.2.1, реакция 3) имеет большой отрицательный потенциал. В кислой среде возможно совместное выделение хлора и кислорода, т.к. их потенциалы электродных реакций близки между собой.
В условиях, отличных от стандартных, электродный потенциал называют равновесным (ЕP) и рассчитывают по уравнению Нернста:
|
E P = E0 |
+ |
RT |
ln П×aiβi = E0 + |
RT |
ln |
[Ox] |
|
|
(2.2.4) |
|
nF |
|
[Red ] |
|
||||||
|
|
|
i |
nF |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
где ЕО – величина стандартного электродного потенциала, В; |
||||||||||
R – |
газовая постоянная, равная 8,315 Дж/моль·K; |
|
|
|||||||
Т – |
температура, К; |
|
|
|
|
|
|
|
||
n – |
число электронов, участвующих в электродной реакции; |
|||||||||
F – |
число Фарадея, равное 96500 кулонов (или 26,8 А×ч) на моль; |
|||||||||
П×aiβi – |
произведение активностей |
или |
концентраций |
(давлений) |
||||||
i |
|
|
|
|
|
|
|
|
|
|
|
веществ, участвующих в электродной реакции, равных |
|||||||||
|
стехиометрическим коэффициентам (с учетом знака βi ), по |
|||||||||
[ Ox ] − |
форме совпадающее с константой равновесия; |
|
|
|||||||
концентрация окисленной формы вещества; |
|
|
||||||||
[Re d ] − концентрация восстановленной формы вещества |
|
|||||||||
Второе слагаемое уравнения (2.2.4) учитывает отклонение от |
||||||||||
стандартных условий температуры и активности ионов. |
|
|
||||||||
Равновесный |
|
потенциал |
электрода |
характеризует |
||||||
термодинамическое равновесие, которое устанавливается на электроде без протекания тока. Таким образом, термодинамический анализ электрохимических потенциалов можно осуществлять на основании величины равновесных электродных потенциалов. В случае выделения на катоде водорода (табл. 2.2.1, реакция 4) равновесный электродный потенциал равен:
|
|
|
|
|
|
|
RT |
|
2 |
|
|
|
|
|
|
= E 0 |
|
|
+ |
aH |
O |
+ |
(2.2.5) |
||
E P |
+ |
|
+ |
|
|
ln |
3 |
|
|
|||
/ H 2 |
/ H 2 |
|
|
|
|
|||||||
H |
3 O |
H |
3 O |
|
2F |
pH 2 |
|
|
||||
|
|
|
|
|
|
|
|
|
||||
При выделении хлора на аноде (табл. 1, реакция 1):
E P |
− = E 0 |
|
− + |
RT |
ln |
pCl |
2 |
(2.2.6) |
|
2F |
2 |
|
|||||
Cl 2 / Cl |
Cl 2 |
/ Cl |
|
|
|
|
||
|
|
|
|
|
aCl − |
|
||
