
II_exp_labs_physchem
.pdf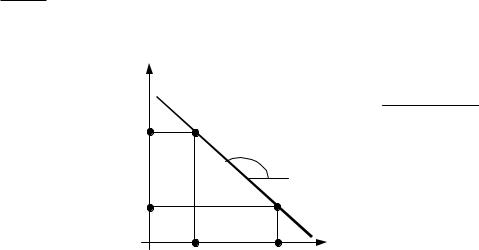
II.2.3. Обработка экспериментальных данных
Для расчета энтальпии испарения строят график, откладывая на оси абсцисс 1/T, а на оси ординат – ln p. Проводят проверку выполнимости уравнения Клапейрона-Клаузиуса (см. (II.8) в [2]): если уравнение выполняется, то график должен получиться линейным (зависимость II.10 в [2]). Проведя через нанесенные экспериментальные точки прямую (следует провести обработку по методу наименьших квадратов - МНК), находят тангенс угла наклона этой прямой к оси абсцисс (по аналогии с рис. II.4). При измерении длин катетов необходимо учитывать масштабы по осям координат. По величине tgα можно найти энтальпию испарения ∆vH°:
tgα = − ∆vRH°, где R=8,314 Дж/(моль.К). Откуда ∆vH° = − R.tgα , Дж/моль.
lnp |
tgα = – ∆v H° / R |
= |
ln p2 |
−ln p1 |
|
|
|||||
lnp2 |
1/ T2 |
−1/ T1 |
|||
|
|
||||
α |
|
|
|
||
|
|
|
|
||
lnp1 |
|
|
|
|
|
|
1/ T |
|
|
||
1/Т2 |
1/Т1 |
|
|
|
|
Рис.II.4. Графическое определение теплоты |
|
||||
испарения жидкости |
|
|
|
||
Энтальпию испарения жидкости, найденную экспериментально ∆vH°эксп., следует сравнить с теоретическим значением, рассчитанным по
справочным данным [1]: ∆vH°справ. = ∆fH°(пар) − ∆fH°(ж), и найти относительную погрешность эксперимента:
ε = |
∆vH°эксп. − ∆vH°справ. |
|
100% . |
(II.4) |
|
|
|
||||
∆vH°справ. |
|||||
|
|
|
|||
Энтропию испарения жидкости находят по формуле (II.7) в [2], в которой энтальпия фазового перехода (индекс tr) – найденная энтальпия испарения (индекс v) ∆trН° = ∆vH°, а температура фазового перехода – температура кипения исследуемой жидкости при атмосферном давлении.
29

Как и для энтальпии испарения, находят относительную погрешность экспериментального определения энтропии испарения исследуемой жидкости, по формуле аналогичной (II.5).
При защите работы следует сделать выводы:
1.О выполнимости уравнения Клапейрона-Клаузиуса.
2.О значениях термодинамических характеристик (о чем говорят их абсолютные значения и чем объясняются их знаки?) и погрешностях их определения.
3.Сравнить термодинамические характеристики исследуемой жидкости со справочными характеристиками других жидкостей, например, ацетона и метанола, и если они отличаются, то объяснить причины этих различий. Сравнить энтропии испарения со значением, определяемым правилом Трутона.
II.3. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА РАСТВОРИМОСТЬ ТВЕРДОГО ВЕЩЕСТВА
Цель работы: определение растворимости твердого вещества в воде, изучение влияния температуры на растворимость и расчет энтальпии растворения по уравнению Вант-Гоффа.
Реактивы: дистиллированная вода, Na2B4O7*10Н2О (бура) или Н2С2О4*2Н2О (щавелевая кислота), растворы HCl и KOH.
Оборудование: ультратермостаты, магнитные мешалки, термостатированные сосуды для растворения, конические колбы для титрования, пипетки, бюретки, мерный цилиндр, термометры
Порядок выполнения работы:
Между насыщенным раствором и твердой фазой устанавливается равновесие. Если вещество X в растворенном состоянии не диссоциирует (или почти не диссоциирует), то равновесие можно охарактеризовать схемой:
Bтв  Bраств
Bраств
Закон действующих масс (II.2) в этом случае, выраженный через КС, будет иметь вид: КС = ср-ра, т.к. твердое вещество по отношению к раствору является конденсированной фазой и в явном виде в выражение КС не входит. И тогда уравнение изобары Вант-Гоффа (II.5) принимает вид:
30
|
C(B)2 |
∆раствH° |
1 |
1 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
ln C(B) |
= |
R |
|
− T |
, |
(II.5) |
|||||
T |
|
||||||||||
|
|
1 |
|
|
|
1 |
2 |
|
|
|
|
где C(B)1 – равновесная концентрация вещества B при температуре Т1, C(B)2 – при Т2, ∆раствН° - стандартная энтальпия (теплота) растворения.
Так как в уравнение (II.6) входит отношение концентраций под знаком логарифма, то безразлично, в каких единицах выражать концентрацию вещества.
Как следует из формулы (II.6), для расчета энтальпии растворения ∆раствН° надо знать концентрацию вещества B в насыщенных растворах при двух температурах.
Для эксперимента используются две установки, состоящие из термостатируемого сосуда с магнитной мешалкой. Термостатирующей жидкостью служит вода, поступающая в рубашку сосуда из ультратермостата. Необходимую температуру в ультратермостатах (обычно 25 и 35 °С) задают с помощью контактного термометра, а за постоянством температуры наблюдают по контрольному ртутному термометру.
1. В сосуд с термостатируемой рубашкой наливают мерным цилиндром указанное преподавателем количество дистиллированной воды (обычно 25 мл) и включают мешалку. Затем высыпают в сосуд исследуемое слабо диссоциирующее вещество (дигидрат щавелевой кислоты (Н2С2О4 2Н2О) или декагидрат тетрабората натрия (Na2B4O7 10H2O) и т.д.). Масса вещества указывается преподавателем в граммах и отвешивается на технических весах (по объему она составляет 1-1,5 чайных ложки). Принципиально важно, чтобы вещество было взято в избытке и растворилось не полностью. Только при наличии твердой фазы можно гарантировать, что раствор насыщенный. Для достижения равновесия необходимо обеспечить перемешивание в стаканах при постоянной температуре в течение 1,5-2 часов. Заданное значение температуры в ультратермостате и температура раствора могут не совпадать. Поэтому перед отбором проб температуру раствора в стакане замеряют переносным термометром, записывают в лабораторный журнал и используют в расчетах.
2. Перед отбором пробы перемешивание в стаканах прекращают, а после отбора - возобновляют. Пробу берут пипеткой на 5 мл и выливают в предварительно взвешенную на аналитических весах колбу с пробкой. При отборе пробы нужно следить, чтобы в пипетку не попали кристаллики не растворившегося вещества. Для этого на нижний конец пипетки присоединяют с помощью кусочка резинового шланга наконечник, состоящий из стеклянной трубочки с ватным тампоном. Перед выливанием
31

пробы из пипетки в колбу для титрования следует снять с нее наконечник, закрыв пальцем верхний конец пипетки. Взвешивают колбу с раствором и по разности определяют массу раствора. Титрованием устанавливают содержание растворенного вещества в пробе (раствор щавелевой кислоты титруют щелочью, а тетрабората натрия – кислотой).
3. Через 15-20 минут надо взять новую пробу, чтобы убедиться, что концентрация раствора заметно не изменилась и, следовательно, достигнуто состояние равновесия в системе раствор – твердая фаза, и раствор действительно насыщенный.
Результаты опытов сводят в табл.II.5.
Таблица II.5
Результаты измерений
|
Масса |
|
Масса колбы с |
|
Масса |
V, |
mпр , |
Масса |
|
С, г на 100 г |
|
Т, |
пустой |
|
раствором, |
|
раствора |
воды mв, |
|
воды |
|
||
К |
колбы, г |
|
г |
|
mp, |
мл |
г |
г |
|
|
|
|
|
|
|
|
г |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
… |
|
… |
|
… |
|
|
… |
|
… |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Расчет растворимости проводят по формуле: |
|
|
|
|
||||||
|
|
|
mпр = V С М(fэквB) /1000, |
|
|
(II.6), |
|||||
где mпр – масса растворенного вещества в пробе, [г];
V – объем раствора титранта, израсходованного на титрование, [мл]; С –концентрация раствора титранта С(HCl) или С(NaOH), [моль/л];
М(fэквB) – молярная масса эквивалента М(1/2Na2B4O7 10H2O) или М(1/2Н2С2О4 2Н2О).
Для того чтобы иметь возможность сопоставить количества растворенного вещества при разных температурах, их необходимо пересчитать на одно и то же количество воды. Руководствуясь тем, что в справочниках принято выражать растворимость в граммах на 100 г воды, проводят пересчет по формуле:
C = |
mпр |
100, |
(II.7) |
|
|||
|
mв |
|
|
где С - концентрация растворенного вещества в граммах на 100 г воды, mв - масса воды в пробе, определяемая как разность между массой
раствора и растворенного вещества mв.= mp - mпр.
Расчет энтальпии растворения проводят по формуле (II.6).
32
∆H 0 = |
RT1T2 |
ln |
C2 |
||
|
|
||||
|
T |
− T |
|
C |
1 |
|
2 |
1 |
|
|
|
Для защиты работы студенту необходимо знать ответы на следующие вопросы:
1.Достигнута ли цель работы?
2.Как оценить влияние температуры на растворимость исследованного твердого вещества?
3.Как объяснить знак энтальпии растворения данного твердого вещества, и как значение энтальпии связано с прочностью кристаллической решетки?
Тема III. ГЕТЕРОГЕННОЕ РАВНОВЕСИЕ
III.1. ПОСТРОЕНИЕ ДИАГРАММ ПЛАВКОСТИ
Цель работы: построение диаграмм плавкости по кривым охлаждения, анализ кривых охлаждения чистых веществ и смесей, проведение полного анализа диаграммы и расчет степеней свободы в точках, заданных преподавателем.
Реактивы: Набор сосудов Степанова со смесями двухкомпонентной системы известных составов.
Оборудование: КСП-4, электрическая плитка, глицериновая баня - химический стакан со штативом для сосудов Степанова, воздушная баня (пустой химический стакан со штативом для сосудов Степанова), запасной химический стакан, штатив.
Порядок выполнения работы:
Для заданной преподавателем системы студенты получают набор сосудов Степанова со смесями известных составов.
Для плавления смесей используется глицериновая баня - химический стакан с глицерином, в котором находится штатив для сосудов Степанова. Баня нагревается с помощью электроплитки.
Четыре сосуда Степанова устанавливаются в штатив глицериновой бани и включается обогрев. Первый сосуд с расплавленной смесью аккуратно вынимается из нее, переносится в воздушную баню (обычный пустой химический стакан) и за отросток закрепляется в штативе. После этого в карман сосуда Степанова опускается термопара и на самописце включается тумблер «Диаграмма». Запись кривой охлаждения - термограммы проводится до полной кристаллизации образца. Таким образом проводится запись термограмм всех (6-8) образцов. Порядок записи образцов произвольный. Внимание! Если смеси, находящиеся в
33
