
II_exp_labs_physchem
.pdf
Тема II. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
II.1. ОПРЕДЕЛЕНИЕ КОНСТАНТ РАВНОВЕСИЯ РЕАКЦИИ КОМПЛЕКСООБРАЗОВАНИЯ
Цель работы: определение констант равновесия реакции комплексообразования в растворе, изучение зависимости ее от температуры и определение термодинамических характеристик реакции комплексообразования.
Реактивы: дистиллированная вода, раствор Co(SCN)2 0,001 г/мл , раствор KSCN 0,05 г/мл, ацетон,
Оборудование: фотоэлектрический спектрофотометр, мерные колбы на 25 мл, пипетки, кюветы, термостат,
Порядок выполнения работы:
Многие металлы образуют в растворах комплексные ионы, прочность которых характеризуют константой устойчивости. В случае образования моноядерного комплекса уравнение реакции имеет вид
Мх++nR-↔MR (nx −n) +
где М - металл-комплексообразователь, R - лиганд,
n - число лигандов в комплексном ионе.
Константа равновесия KC, называемая в данном случае также константой устойчивости комплекса βn, равна:
K C = |
[M R(nx −n) + ] |
= βn |
(II.1) |
[M x + ][R − ]n |
Для определения константы устойчивости мало прочных комплексов можно применить графический метод Бента и Френча. После логарифмирования обеих частей уравнения (II.1) получим следующее выражение:
ln |
[M R ( x −n ) + ] |
= |
ln β |
|
+ n ln[R − ] |
|
(II.2) |
||||
[M x + ] |
n |
|
|||||||||
|
|
|
|
|
|
|
|
|
|||
Последнее уравнение |
может |
|
быть |
представлено прямой |
при |
||||||
использовании в качестве переменных |
|
|
[M R ( x −n ) + ] |
и ln[R − ] |
|
||||||
|
ln |
|
|
|
|||||||
|
|
[M x + ] |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
В этом случае отрезок, отсекаемый прямой на оси ординат, равен lnβn, что позволяет вычислить константу устойчивости.
Равновесие реакции комплексообразования исследуют на примере реакции кобальта (11) с тиоцианатом в водно-ацетоновых растворах
Co2+ + 4SCN- ↔ Co(SCN) 24−
19
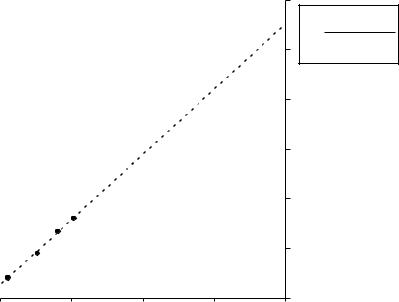
Комплексный ион Co(SCN) 24− образуется в заметных количествах при большом избытке тиоционат-ионов в растворе. Этот комплексный ион окрашен в голубой цвет, поэтому для определения его концентрации можно измерять оптическую плотность раствора с помощью фотоэлектрического спектрофотометра.
Спектрофотометрический метод анализа основан на избирательном поглощении излучения определенной длины волны раствором.
ln D i D o −D i
ln[SCN−]
Рис. II.1. Графическое определение константы равновесия реакции комплексообразования
При обработке результатов измерений используют закон Ламберта-Бера
|
|
I0 |
D = ε c l |
(II.2) |
где оптическая плотность |
D = ln |
, |
|
|
I |
|
|||
|
|
|
|
I0 - интенсивность падающего потока излучения,
I -интенсивность потока излучения, прошедшего через вещество, l - толщина поглощающего слоя,
с - концентрация, ε - коэффициент погашения, основная характеристика поглощения
света раствором при данной длине волны.
При с=1 моль/л и l=1см ε = D, т.е. коэффициент поглощения - это оптическая плотность раствора с концентрацией 1 моль/л, помещенного в
20

кювету с l=1 см. Для Co(SCN) 24− при длине волны 620 нм коэффициент
погашения ε составляет 1,9.103 л/(моль.см).
В практической работе измеряют оптические плотности растворов Di, пропорциональные концентрациям комплексного иона Co(SCN) 24− , и оптическую плотность D0 раствора, в котором весь металл связан в комплекс. При обработке опытных данных используют уравнение (II.2) в следующей форме:
ln |
|
D i |
= ln βn + n ln[R − ] , |
(II.3) |
D 0 |
|
|||
|
− D i |
|
||
где n=4. Для расчета константы устойчивости следует построить график с использованием переменных ln D 0D−i D i по оси ординат и ln[R-] по оси
абсцисс. При построении графика следует учитывать, что лиганд во всех опытах берется в избытке поэтому частичное связывание лиганда в ионах комплекса практически не уменьшает величину [R-].
Константы устойчивости зависят от температуры, поэтому спектрофотометрические измерения проводят с использованием термостатированных кювет.
II.1.1. Приготовление серии растворов
Исходные растворы - KSCN и Co(SCN)2 с содержанием кобальта 0,001 г/мл и KSCN c содержанием соли 0,05 г/мл надо получить у лаборанта. Серия рабочих растворов готовится четырьмя студентами таким образом, чтобы концентрация комплексообразователя - кобальта во всех растворах оставалась неизменной, а количество лиганда было различным. В одном из растворов концентрация лигандов должна быть достаточно большой для полного подавления диссоциации Co(SCN) 24− . Необходимые количества исходных растворов комплексообразователя и лиганда задаются преподавателем. Заданные количества растворов Co(SCN)2 и KSCN вносят пипеткой в колбу объемом 25 мл, затем добавляют воду в таком количестве, чтобы суммарный объем составил 10 мл.
Раствор доводят до метки ацетоном и перемешивают. Образование комплексов легко заметить по появлению голубой окраски растворов, интенсивность которой увеличивается по мере увеличения количества лиганда в растворе.
21
II.1.2. Определение константы устойчивости
Необходимые измерения оптической плотности проводят на фотоэлектроколориметре с красным светофильтром (длина волны света 610-620 нм). Раствором сравнения, по которому устанавливают нуль оптической плотности, служит смесь 10 мл воды и 15 мл ацетона. Кювету, в которой измеряют оптическую плотность раствора, следует предварительно ополоснуть исследуемым раствором.
Кюветы с чистым растворителем и исследуемым раствором помещают в термостатируемый кюветодержатель. Термостатирующей жидкостью служит вода, подаваемая из ультратермостата. Постоянная температура устанавливается и поддерживается регулировочным контактным термометром, ее отсчитывают по контрольному термометру. Каждый из четырех студентов проводит самостоятельно измерение оптической плотности всей приготовленной серии растворов при одной заданной преподавателем температуре. Данные опыта записывают в
таблицу; |
константу |
устойчивости |
находят |
из графика зависимости |
||||||||
ln[D i |
(D 0 |
− D i )] от ln[SCN − ]. |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
№№ |
|
Колич. |
[SCN-], |
|
ln[SKN-] |
Di |
Do - Di |
|
Di /(Do -Di) |
lnDi/(Do - Di) |
T,K |
|
р-ров |
р-ра |
моль/л |
|
|
|
|
|
|
|
|
||
|
|
KSCN, |
|
|
|
|
|
|
|
|
|
|
|
|
|
мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
II.1.3. Изучение зависимости константы устойчивости комплекса от температуры
Измерение оптической плотности приготовленных растворов следует начать при комнатной температуре ( 20°С); необходимо убедиться, что измеренное значение оптической плотности остается постоянным в течение 2-3 минут. Затем установить с помощью контактного термометра температуру на 5-10° выше и дождаться постоянства температуры на контрольном термометре. При температуре выше комнатной растворы в кюветах нужно выдерживать перед измерением оптической плотности не менее 6-7 минут. Каждый раз нужно убедиться в постоянстве значения оптической плотности. Температура при которой проводят измерения не должна превышать 50°С.
Каждый из студентов определяет значение βn при одной температуре. Теплоту реакции комплексообразования рассчитывают по уравнению Вант-Гоффа
22

|
|
βn (T2 ) |
∆rH |
o |
1 |
|
1 |
|
||||||
|
|
|
|
|
|
|||||||||
|
ln β |
|
(T ) = |
R |
|
|
|
− |
|
|
||||
n |
|
T |
T |
|||||||||||
|
|
|
1 |
|
|
|
|
1 |
|
2 |
|
|||
или по графику ln βn − 1 T , вычислив |
угловой |
коэффициент линейной |
||||||||||||
зависимости tgϕ = ∆ (ln βn ) |
∆(1 T) |
по данным не менее четырех опытов, |
||||||||||||
результаты которых заносят в таблицу: |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
t0, C |
|
|
T, K |
|
|
|
1/T, K-1 |
|
lnβn |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
.
Изменение энергии Гиббса при образовании комплексного иона связано с константой устойчивости и может быть рассчитано по уравнению:
∆rGo = −RT lnβn
Для расчета изменения энтропии при комплексообразовании можно воспользоваться уравнениями:
∆rGo = ∆rHo −T∆rSo,
∆rSo = (∆rHo −∆rGo )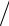 T .
T .
Для защиты работы студент должен:
-графически определить величину константы устойчивости комплекса при разных температурах,
-по значениям полученных констант при разных температурах рассчитать теплоту комплексообразования,
-провести расчет термодинамических характеристик реакции комплексообразования.
II.2. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА РАВНОВЕСИЕ В СИСТЕМЕ ЖИДКОСТЬ - ПАР
Цель работы: изучение температурной зависимости давления (упругости) насыщенного пара статическим методом и определение теплоты испарения на основании этой температурной зависимости.
Реактивы: гексан или гептан.
Оборудование: установка №1 или установка №2. (см. описания ниже).
23

Порядок выполнения работы:
Равновесие в системе "жидкость – пар" является частным случаем термодинамического равновесия, при котором одно и то же соединение находится в двух различных фазах:
Для равновесий ж |
|
|
Н2О (ж) |
|
|
|
|
Н2О (пар) . |
||||
|
|
|||||||||||
|
|
|
||||||||||
|
|
|
п или тв |
|
|
|
|
п закон действующих масс |
||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
||||||
записывается как для систем с конденсированной фазой K p = pH2O(пар)
(см. теоретическую часть).
Экспериментальная часть работы заключается в определении зависимости температуры кипения жидкости от давления в системе
Ткип=f(p).
Измерение давления пара проводят статическим методом. Этот метод основан на измерении температуры кипения жидкости при фиксированном внешнем давлении. Измеряя внешнее давление над кипящей жидкостью, тем самым определяют и давление насыщенного пара при данной температуре, поскольку кипение - это испарение в условиях, когда внешнее давление равно давлению пара, равновесного с жидкостью. Внешним давлением в данном случае называют давление воздуха над жидкостью в системе, изолированной от атмосферы.
Лабораторная работа может выполняться на одной из двух установок, различающихся прибором для измерения давления в системе и способом нагрева. На установке №1 (рис.II.2) используется ртутный манометр 4 и водяная баня 8, на установке №2 (рис.II.3) – вакуумметр 4 и песчаная баня 8. Обе установки содержат круглодонную двугорлую колбу 6 с исследуемой жидкостью, снабженную термометром 3 и обратным холодильником 5. Термометр установлен так, чтобы шарик ртути находился в парах над жидкостью. Холодильник посредством тройника соединен с прибором для измерения давления 4 и с вакуумным насосом. Между насосом и холодильником имеется предохранительная склянка 7, а на установке №1 еще и резервуар 9, который служит для поддержания постоянного давления в системе. Кран 1 соединяет систему с атмосферой, а кран 2 служит для изменения давления в системе.
II.2.1. Работа на установке №1
1.В холодильник 5 пустить воду. Вода должна стекать в слив слабой струей.
2.Под колбу поставить водяную баню, налив в нее такое количество воды, чтобы ее уровень был выше уровня жидкости в колбе (см.
рис.II.2).
24

3.Открыть кран 2, при этом кран 1 должен быть закрыт. Положения крана:
ОТКРЫТО |
ЗАКРЫТО |
|
|
|
|
1. |
Кран, соединяющий систему с |
5. |
Обратный холодильник; |
|
атмосферой; |
6. |
Колба с исследуемой |
2. |
Кран, с помощью которого |
|
жидкостью; |
|
изменяется давление в системе; |
7. |
Предохранительная склянка; |
3. |
Термометр; |
8. |
Водяная баня; |
4. |
Ртутный манометр; |
9. |
Резервуар. |
Рис.II.2. Cхема установки №1
4.Включить вакуумный насос тумблером с меткой "НАСОС". Создать в системе разряжение около 500 мм рт.ст., т.е. в момент, когда показание верхней шкалы манометра достигнет величины 150-170 мм, перекрыть кран 2. После этого осторожно открыть кран 1, соединяя прибор с атмосферой, и затем отключить насос.
5.Приступить к измерениям. Для этого баню 8 осторожно нагреть (включить тумблер "БАНЯ") до начала кипения исследуемой жидкости
25
и до установления равновесия в системе. Критерий равновесия - постоянство температуры кипения (tкип) при медленном, равномерном падении капель из обратного холодильника (1 капля в секунду). Внимание! Смесь не перегревать! Нагреватель обязательно следует выключить уже после появления первых капель, для уменьшения интенсивности кипения можно отставить баню.
6.Отрегулировав интенсивность кипения, и, убедившись в постоянстве показаний термометра 3 в течение 1-2 минут, записать в таблицу
значения tкип и показания манометра h1 и h2 (следует учитывать знак hi, например, h2<0).
7.Аккуратно открывая кран 2 (кран 1 - открыт), уменьшить разряжение в системе на 40-50 мм рт.ст. (на 20-25 мм по верхней шкале) и закрыть кран 2. Кипение жидкости в колбе при этом прекращается.
8.Снова нагреть баню до начала кипения и в указанном порядке п.5-7 произвести отсчеты давления и температуры. Снять 8-10 замеров (последний замер производится с открытыми кранами 1 и 2, т.е. при атмосферном давлении).
9.По окончании работы выключить нагрев бани, баню отставить и только после этого выключить охлаждение обратного холодильника (закрыть воду).
10.Давление пара исследуемой жидкости p при данной температуре
определяют как разность между атмосферным давлением (pа), которое определяют по барометру, и показаниям манометра. Результаты измерений сводят в табл.II.4а:
Таблица II.4a
Результаты измерений на установке №1
|
Температура |
|
1 |
, |
Показания манометра |
|
Давление |
|
|
|
|||||||
|
кипения жидкости |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
T |
|
|
|
|
|
|
|
|
|
|
||||||
|
t, 0C |
|
T, K |
|
K-1 |
Верхний |
|
Нижний |
|
Разность |
|
насыщен- |
|
lnp |
|
||
|
|
|
|
|
|
|
|
уровень |
|
уровень |
|
уровней |
|
ного пара |
|
|
|
|
|
|
|
|
|
|
|
ртути h1, |
|
ртути h2, |
|
∆h=h1-h2, |
|
p = pа - ∆h, |
|
|
|
|
|
|
|
|
|
|
|
мм рт. ст. |
|
мм рт. ст. |
|
мм рт. ст. |
|
мм рт. ст. |
|
|
|
|
… |
|
… |
|
… |
|
… |
|
… |
|
… |
|
… |
|
… |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
26
II.2.2. Работа на установке №2
1.В холодильник 5 пустить воду. Вода должна стекать в слив слабой струей.
2.Включить электроплитку для нагрева песчаной бани 8 (тумблер
"БАНЯ").
3.Открыть кран 2, при этом кран 1 должен быть закрыт. Положения крана:
ОТКРЫТО |
ЗАКРЫТО |
|
|
|
1. |
Кран, соединяющий систему с |
4. Вакуумметр |
|
атмосферой; |
5. Обратный холодильник; |
2. |
Кран, с помощью которого |
6. Колба с исследуемой жидкостью; |
|
изменяется давление в системе; |
7. Предохранительная склянка; |
3. |
Термометр; |
8. Песчаная баня. |
Рис.II.3. Схема установки №2
27
4.Включить вакуумный насос тумблером с меткой "НАСОС". Создать в системе разряжение: в момент, когда показания по шкале вакуумметра составят 65-70 делений, закрыть кран 2 и выключить вакуумный насос. Медленно открыть кран 1 для сообщения с атмосферой.
5.Приступить к измерениям. Нагреть жидкость в колбе до начала кипения и, затем, до установления равновесия в системе. Критерий равновесия -
постоянство температуры кипения (tкип) при медленном, равномерном падении капель из обратного холодильника (1 капля в секунду).
Внимание! Жидкость не перегревать! Для уменьшения интенсивности кипения необходимо уменьшить нагрев (баню отставить, выключить нагрев).
6.Убедившись в постоянстве показаний термометра 3 в течение 1-2 минут,
записать в таблицу значения tкип и разряжения ∆p по вакуумметру в делениях шкалы
7.Снова нагреть баню до начала кипения и в указанном порядке п.5-7 произвести отсчеты давления и температуры. Снять 10-12 замеров (последний замер производится с открытыми кранами 1 и 2 при атмосферном давлении).
8.По окончании работы выключить нагрев бани, баню отставить и только после этого выключить охлаждение обратного холодильника (закрыть воду).
9.Давление в системе рассчитывается по следующему уравнению:
p = 100 - ∆p (делений шкалы).
Результаты измерений сводятся в табл.II.4б:
Таблица II.4б
Результаты измерений на установке №2
Температура |
|
|
|
|
Показания |
Давление |
|
|
||
кипения жидкости |
|
1/Т |
|
|
вакуумметра |
насыщенного |
|
lnp |
||
|
|
|
|
|
|
|
|
|
|
|
t, 0С |
|
T, К |
|
|
|
|
∆p (дел. шкалы) |
пара p = 100 - ∆p |
|
|
|
|
|
|
|
|
|
|
(дел. шкалы) |
|
|
... |
|
... |
|
... |
|
... |
|
... |
|
... |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
28
