
- •1.Биосфера деген не? Биосфераның құрылымы қандай?
- •2.Биосфераны құрайтын заттарды атаңдар
- •3.Өмірдің шегі немен анықталады? Тірі зат қандай қасиеттермен сипатталады?
- •4.Экзосфера, термосфера, құрылысы туралы түсініктер. Атмосфераның рөлін сипаттаңыз
- •5.Биосферада тірі заттың шоғырлануының формалары қандай?
- •6.Биосфераның космостық рөлі
- •7.Биосфераны қорғау үшін не себептен биологиялық ір түрлікті ұстап тұру керек?
- •8.Жердің негізгі кабаттарының пайда болуы: литосфера, гидросфера, атмосфера
- •9.Атмосфераның пайда болуын ерекшеліктері
- •10.Стратосфера, тропосфера құрылысы туралы түсініктер атмосфераның рөлін сипаттаңыз.
- •11.Тропосферадағы құрғақ ауаның химиялық құрамы
- •12.Адамның өмір сүруіне қауіп төндіретін табиғи құбылыс
- •13. Жердің тіршілік қабаты – биосфераның тіршілік қызметін қамтамасыз етудегі атмосфераның рөлін сипаттаңыз.
- •14.Қоршаған орта химиясы құрылымы :литосферадағы физика-химиялық процестер
- •15.Қоршаған орта химиясы құрылымы :гидросферадағы физика-химиялық процестер
- •16.Қоршаған орта химиясы құрылымы :атмосферадағы физика-химиялық процестер.
- •17.Жасыл химия мен қоршаған орта туралы ғылым арасындағы айырмашылық неде?
- •18.Биосфера мен адам тіршілік қызметіндегі гидросфераның (Жердің сулы қабаты) рөлі қандай?
- •19.Табиғаттағы зат айналымы қандай рөл атқарады?
- •22.Атмосфераның химиялық ластануының негізгі көздерін атаңыз және олармен күресу жолдарын көрсетіңіз
- •24. Бензол – автокөлік жанармайынан бөлінетін ластаушы компонент күрделі экологиялық мәселеге әкеледі
- •25. Атмофераға газдар мына түрлі табиғи жолдармен түседі: 1) магманың жер тереңдігіндегі балқыған масса гассыздануы; 2)организмдердің тіршілік өмірі; Мысал келтріп түсіндір
- •28. Ауаның химиялық құрамы. Атмосфераның фотосинтездің нәтижесі маңызы
- •29. Қо жағдайын бақылауда биологиялық мониторинг тиімді әдіс ретінде
- •31. Ионосфера деп нені атайды? Сипатта
- •32. Атмосфераның қазіргі кездегі химиялық компоненттері азот (n2) оттек () түсуінің табиги жэне антропогенд негізгі көздеріАзот (n2) және оның қосылыстары
- •34. Атмосферадағы су буларының негізгі көздері
- •35. Күкірт диоксидінің атмосфераға түсуінің негізгі көздері
- •38. Атмосфераға химиялық элементтердің (газ күйінде ) келуінің табиғи жолдары.
- •39. Атмосфералық озон. Стратосферадағы озон. Озонның ауа райы мен климатқа әсері. “Озон тесіктерінің”пайда болу мәселелері, антропогенді (химиялық) және метеорлогиялық гипотезалар
- •41. Қышқылдық жаңбырлар және фотохимиялық түтінді-тұман түзілу
- •42.Атмосферадағы физика-химиялық процесстері , Атмосфераның ластануымен байланысты жаһандық экологиялық проблемалар
- •1 Сурет Қышқыл жаңбырдың әлемдік нысандарға әсері
- •43.Көмірқышқыл газы (co2 )жэне баска парник газдары Парниктік эффек дегеніміз не? Оның табиғаттағы және адам өміріндегі рөлі қандай?
- •44.Қышқыл жаңбыр қандай қауіптілік туғызады? Ауа газдарды катты заттардан тазалау процессы
- •47.Автотранспорт және телеэнергетика атмосфераның ластануының көзі
- •48.Қышқылды жауынмен күресу шаралары.
- •50.Атмосфераның химиялық құрамын анықтау Ауа газдарды күкірт диоксидінең тазалау схемасы
- •51.Ауа тозаңдануын анықтау Ауаны тау- химиялык өнеркасіп газдарынан қоргау
- •53. Атмосфераны химиялық ластанудан қорғау. Шрк түсінігі, ластанған атмосфералық ауаны тазарту түрлері және тиімділігі
- •58. Атмосфера құрамы биіктікке байланысты едәуір өзгереді Мысал келтріп түсурдір. 58. Атмосфера құрамы биіктікке байланысты едәуір өзгереді Мысал келтріп түсурдір
- •60. Фотохимиялық процестің нәтижесінде түзілген озон (o3) арман карай ыдырау реакциясына тусеме сол процестің реакциясын жаз
50.Атмосфераның химиялық құрамын анықтау Ауа газдарды күкірт диоксидінең тазалау схемасы
Атмосферадағы химиялық элементтер мен газдардың шамамен алғандағы құрамы.
|
Элементтер және газдар |
Атмосфераның төменгі қабатының құрамы, % | |
|
Көлемі |
Массасы | |
|
Азот |
78,084 |
75,5 |
|
Оттек |
20,946 |
23,14 |
|
Аргон |
0,934 |
1,28 |
|
Неон |
0,0018 |
0,0012 |
|
Гелий |
0,000524 |
0,00007 |
|
Криптон |
0,000114 |
0,0003 |
|
Сутек |
0,00005 |
0,000005 |
|
Көмірқышқыл газ (орташа) |
0,034 |
0,0466 |
|
Су буы: |
|
|
|
поляр ендігінде
|
0,2 |
- |
|
Экваторда |
2,6 |
- |
|
Озон: |
|
|
|
тропосферада
|
0,000001 |
- |
|
Стратосферада |
0,001-0,0001 |
- |
|
Метан |
0,00016 |
0,00009 |
|
Азот тотығы |
0,000001 |
0,000000, |
|
Көміртек тотығы |
Мына бір бөлігі, ауада: Қалаларда-0,000008 дейін. |
0,0000078 |
Бұл қосылыстардың молекулалары атмосфераның жоғарғы қабаттарында фотолизге ұшырайды. Хлор атомдары NO-молекуласы сияқты, озон ыдырауының катализаторы болып « озон тесіктері» пайда болуына ықпал жасайды. Планетаның «озондық қабатын» сақтау қазіргі заманның ең маңызды проблемалары.
Оның үстіне оттек стратосферада фотохимиялық реакцияға түсіп, жерді ультракүлгін сәулелерден қорғайтын озонды түзеді. Бұл озон экраны жоғары организмдердің құрғақ континенттерге қоныстануына ықпал жасайды. Жалпы алғанда, Жер кездейсоқ түрде басқарылатын геохимиялық жүйе емес, ол біртұтас тірі организм.
51.Ауа тозаңдануын анықтау Ауаны тау- химиялык өнеркасіп газдарынан қоргау
Ең күшті геохимиялық көздер болып немесе тасымалданатын шаңдар және теңіз шашырандылары болуы мүмкін олар атмосфераға қатты заттардың орасан көп мөлшерін әкеледі.
Шаң – негізінен аридтық (аридный) аймақтардың топырағы. Егер бұл шаңдардың беттік қабаттары өте жұқа болатын болса, онда олар көп жерлерге тарап, материалдардың қайта бөлінуінде маңызды рөл атқарады. Дегенмен шаңдардың атмосферадағы химялық әсері онша емес, себебі олардың химялық белсенділігі әлсіз. Оған қарағанда тұз бөлшектерін желдің әсерінен тасымалдайтын теңіз шашырандыларының атмосферадағы химялық реакцияға қабілеті керісінше жоғары. Океаннан бөлінген тұз бөлшектері ылғалданғыш сондықтан ылғал ортада NaCI-дың ұсақ кристалдары суды сіңіріліп, концентрлі тамшы ерітінділер немесе аэрозольдар түзеді. Нәтижесінде бұл процесс бұлттар түзілуіне қатысады. Тамшылар сонымен бірге атмосфераға өтіп химиялық реакциялар жүретін орын бола алады. Егер тамшыларда күшті қышқылдар, мысалы азот (HNO3) немесе күкірт (H2SO4) қышқылдары еріген болса, олардан тұз қышқылы (HCI) түзілуі мүмкін. Бұл процессті атмосферадағы тұз қышқылының (HCI) көзі деп есептейді:
H2SO4 + NaCI = HCI + NaHSO4
Метеорларда бөлшектерді атмосфераға тасымалдайды. Бұл шаңмен немесе орман өрттерімен немесе желмен салыстырғанда онша үлкен көз емес, біраұ метеорлар газдардың тығыздығы аз болатын атмосфераның жоғарғы қабаттарында үлкен рөл атқарады. Мұнда метеорлармен әкелінген металдар көптеген химялық реакцияларға түседі.
Вулкандар шаңның ең үлкен көзі, күшті атылу кезінде шаңдар стратосфераға дейнде жетеді. Вулкан бөлшектері глобальды температураға күн сәулесін ұстап қалуы арқылы әсер етеді. Жоғары биіктіктерде химиялық процестерге де бөгет жасауы мүмкін.
Вулкандар тең шаңның ғана емес, күкірт диоксиді (SO2) ,CO2, HCI және фторсутек (HF) сияқты газдардың да үлкен көзі бола алады. Бұл газдар страфосферада реакцияға түсіп басқа бөлшектерді береді, бұл бөлшектердің ең маңыздысы H2SO4. Бұл қышқыл вулкан көздерінен жанама жолдармен де түзіледі. Вулкандар бөлшектердің уақыт жағынан да, кеңістік жағынанда тым тұрақсыс көзі. Күшті вулкан атқылаулар сирек кездеседі. Кейде бірнеше жылдар бойы күшті атқылаулар болмай бір кезде ондаған жылдар бөлінбеген көп заттар бір атқылаудың нәтижесінде бөлінеді.
Атқылаулар вулкандар әрекет етіп тұрған ерекше аймақтарда болады.Заттардың көп мөлшері стротосфераның жоғарғы қабатына жететін күшті атқылаудан басқа, вулкан жарықтарынан газдардың аздаған мөлшері бөлінеді ол газдар көп уақыт бойы атмосфераның төменгі қабаттарына біртіндеп шығады. Вулкандық көздердің осындай екі түрінің арасындағы қатынас дәл белгілі емес, десекте SO2 газы үшін бұл қатынас 50:50.
Жыныстардың радиоактивті элементтері – калий және ауыр элементтер радий,уран және торийда газдар бөледі.
Аргон калийдің ыдырау нәтижесінде, ал радон (радиоактивтрадиоактивті газ, жартылай ыдырау периоды 3,8 күн) радий ыдырауынан пайда болады. Уран-торий ыдырауларынан гелийдің ядросы болып есептелетін
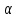 –бөлшектері
түзіледі.
Бұл ядролар электрон қосып алғансоң,
гелий атмосфераға түседі.
–бөлшектері
түзіледі.
Бұл ядролар электрон қосып алғансоң,
гелий атмосфераға түседі.
Гелий атмосферада жаналмайды, ол жеңіл болғандықтан космосқа шығып кетеді. Сөйтіп гелийдің конентрациясы оның жер бетінде радиоактивті түзілуімен атмосфераның жоғарғы қабаттарынан кетуі арасындағы қатынасымен (баланс) анықталады.
52. Атмосферадағы ауыр металдарды анықтау. ауыр металдар [ – тығыздығы темірдіңтығыздығынан (7,874 г/см3) артық болатын түстіметалдартобы. Оларғамырыш,қорғасын,қалайы,марганец,висмут,мыс,сынап,сүрме,никель,кадмийжатады. Ауыр металдардың көптеген қосылыстары, әсіресе, тұздарыорганизмүшін зиянды. Олар тағам,су,ауаарқылы ағзаға түскенде ыдырамайды, кейбір органдарды (бүйрек,бауыр,буын, т.б.) жиналып, денсаулыққа қауіп төндіреді. Сондықтан Ауыр металдардың қоршаған ортадағы мөлшері белгіленген шамадан аспауы керек. Мырыш қосылыстары – мырыш элементі түзетін химиялық қосылыстар. Мырыштың оттекті қосылыстарының маңыздысы мырыш (ІІ) оксиді ZnO – түссіз кристалл, балқу t 1975ӘС. Су, спирт, эфирде ерімейді, ал қышқылдарда, сілтілерде ериді. Табиғатта “цинкит” деген атпен белгілі. ZnO – мырыш буларын ауада немесе оттекте жағу және табиғи ZnS-ті күйдіру арқылы алынады. Ол бояғыштарда ақ пигмент (мырыш әгі), электроникада шала өткізгіш материал ретінде, тағы басқа мақсаттарда қолданылады. Мырыш гидроксиді Zn(OH)2 – мырыштың ерігіш тұздары мен сілтілер арасындағы реакцияда түзіледі. Ол ақ түсті тұнба, қышқылдар және сілтілерде ериді. Аммиак ерітіндісінде еріп, кешенді қосылыстар түзеді. Мырыш тұздарының маңыздылары: ZnS, ZnCl2, ZnSO4, Zn(СН3CОО)2. Мырыш сульфиді ZnS – түссіз кристалл, балқу t 1775ӘС, суда ерімейді, қышқылдар әсерінен ыдырайды, литопон деген ақ бояу құрамына кіреді.Қорғасын қосылыстары – қорғасынэлементі түзетін химиялық қосылыстар. Қорғасын қосылыстары 2, 4 валентті, 4 валентті қосылыстары тұрақсыз келеді. Қорғасынның PbO, PbO2, Pb3O4оксидтерібелгілі. Қорғасын (ІІ) оксиді PbO сарғылт-қызыл (балқу температурасы 886ӘС) және сары (балқу температурасы 600ӘС) екі модификацияда кездесетінкристалл, қайнау температурасы 1473ӘС. Суда ерімейді, ауада 400 – 500ӘС-қа дейін қыздырғанда қорғасынжосасыдеп аталатын шымқай қызыл түсті Pb3O4-ке айналады. Ол бояу ретінде қолданылады. Қорғасын (ІV) оксиді PbO2 қара-қоңыр кристалл, модификациялары тетрагональ (ыдырау температурасы 220ӘС) және ромбы (ыдырау t 280ӘС) түрінде кездеседі. Суда ерімейді, қышқылдарда нашар ериді, күшті тотықтырғыш. Pb (ІІ) қосылыстарын гипохлоритпен тотықтыру, Pb3O4-ті концентрленген азот қышқылымен әрекеттестіру, құрамында Pb (ІІ) бар ерітіндіде анодтық тотықтыру арқылы алады.Аналитикалық химиядақорғасынды идентификациялауда қолданады. Қорғасын қышқылдармен әрекеттесіп тұз түзеді. Қорғасын (ІІ) сульфаты PbSO4 суда ерімейтін кристалл зат, тығызд. 6,20 г/см3, балқу t 1770ӘС (ыдыраумен). Табиғаттаанглезитминералы түрінде кездеседі. Ол құрамында Pb2+,иондарыбар ерітінділерді тұндыру және қорғасын сульфидін (PbS) тотықтыру арқылы алынады.
