
- •А.М.Даниленко
- •Глава 2. Химическая термодинамика.
- •Внешняя среда
- •I закон термодинамики.
- •Глава 3. Химическая кинетика и равновесие.
- •Глава 4. Растворы
- •Поскольку растворение - процесс самопроизвольный, то
- •Глава 5. Электрохимия.
- •Возникновение скачка потенциала на границе металл - раствор электролита.
- •Активный металл Пассивный металл
- •Глава 6. Дисперсные системы
- •Классификация диперсных систем
- •Методы получения дисперсных систем.
- •Строение частиц лиофобных золей.
- •Глава 7. Жесткость природных вод.
- •Методы осаждения Методы ионного обмена
- •Метод методы
- •Метод известкования Содово-известковый метод
Строение частиц лиофобных золей.
Золи - типичные коллоидные системы, ярко проявляют свойства, присущие веществу в коллоидном состоянии. Рассмотрим процесс образования золя и строение частиц дисперсной фазы на примере на примере - гидрозоля гидроксида железа. Этот гидрозоль образуется при кипячении водного раствора FeCl3. В результате гидролиза соли FeCl3
FeCl3 + 3H2O Fe(OH)3тв + 3HCl
образуются кристаллические агрегаты, состоящие из большого числа (m) ФЕ - [Fe(OH)3]m . На поверхности агрегата адсорбируются ионы из раствора (потенциалоопределяющие ионы) В первую очередь адсорбируются ионы способные достраивать кристаллическую решетку (Fe+3 и OH–). В данном примере - ионы Fe+3, поскольку присутствуют в растворе в большем количестве, чем OH– . В результате адсорбции агрегаты приобретают положительный заряд. Наличие одноименных зарядов на агрегатах препятствует их объединению и росту кристаллов Fe(OH)3 . Кристаллический агрегат вместе с потенциалоопределяющими ионами составляют ядро.
К заряженному ядру притягиваются ионы противоположного заряда - противоионы. Для рассматриваемой системы противоионами будут ионы Сl–. Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов. За этим слоем следует диффузный слой противоионов. Между ионами адсорбционного и диффузного слоев устанавливается подвижное равновесие. Противоионы диффузного слоя ориентируют полярные молекулы растворителя, создавая дополнительную сольватную оболочку.
Ядро вместе с противоионами адсорбционного слоя составляют коллоидную частицу или гранулу. Коллоидная частица совместно с противоионами диффузного слоя называется
мицеллой. Следует иметь в виду, что коллоидная частица всегда заряжена, знак заряда соответствует знаку потенциалоопределяющих ионов; мицелла в отличие от гранулы электронейтральна. Строение мицеллы гидрозоля гидроксида железа отражает схема:
![]() 3x+
3xСl-
3x+
3xСl-









агрегат потенциало адсорбционный диффузный
определяющие cлой противоионов слой
ионы

 ядро
ядро

 коллоидная
частица
коллоидная
частица

 мицелла
мицелла
Устойчивость дисперсных систем.
Устойчивостью дисперсных систем называют неизменность во времени ее основных характеристик - дисперсности и равномерного распределения частиц дисперсной фазы в дисперсионной среде. Иногда требуется сохранить устойчивость (например, в процессе получения покрытий), в других случаях нарушить устойчивость (очистка сточных вод).
Устойчивость дисперсных систем разделяют на два вида
- седиментационную (устойчивость частиц дисперсной фазы к оседанию).
- агрегативную (устойчивость частиц дисперсной фазы объединению в агрегаты). Слипание частиц дисперсной фазы, их объединение в агрегаты называется коагуляцией. Она приводит к выпадению осадка (коагулянта), т.е. к разрушению дисперсной системы.
Лиофобные коллоиды термодинамически неустойчивы. Основными факторами, определяющими агрегативную устойчивость дисперсных систем являются:
электростатическое отталкивание между гранулами,
наличие адсорбционных и сольватных слоев на поверхности частиц дисперсной фазы.
Для лиофобных коллоидов преобладает электростатический фактор.
Коагуляция лиофобных коллоидов может быть вызвана различными причинами, которые способствуют разрушению электростатического барьера между частицами (нагрев, действие электромагнитных полей, добавка электролита). При этом наблюдаются следующие закономерности:
1) Все сильные электролиты при увеличении их концентрации в растворе до определенного значения вызывает коагуляцию. Эта концентрация Ск называется порогом коагуляции, или концентрацией коагуляции. Величина, обратная Ск, называется коагулирующей способностью электролита (Vк).
Vк = 1/Cк [л/моль]
Эта величина соответствует объему коллоидного раствора, коагуляция которого вызвана действием 1 моль ионов электролита.
2) Коагуляция обусловлена действием того иона электролита, заряд которого противоположен собственному заряду коллоидной частицы (гранулы). В случае Fe(OH)3 заряд гранулы +3х. Коагуляцию будут вызывать отрицательно заряженные ионы (SO42-, Cl-, NO3 - и т.д).
3) Коагулирующее действие электролита тем сильнее, чем выше заряд иона, вызывающего коагуляцию (правило Шульце -Гарди): Порог коагуляции обратно пропорционален заряду иона, вызывающего коагуляцию, взятому в шестой степени .
Ск = B/Z6
Расчет коагулирующей способности (Vк = 1/Cк) для одно- , двух- , трехзарядных ионов дает соотношение: 1 : 64: 799 . Таким образом, наиболее интенсивно коагуляция вызывается многозарядными ионами, противоположными по знаку собственному заряду коллоидных частиц.
Молекулярно-кинетические свойства.
Броуновское движение - хаотическое, непрерывное движение частиц дисперсной фазы под действием ударов молекул дисперсионной среды.
Диффузия - процесс выравнивания концентраций частиц по всему объему дисперсионной среды. Проявляется в меньшей степени, чем для растворов.
Оптические свойства коллоидных растворов.
Прохождение света через дисперсную систему сопровождается такими явлениями, как поглощение, отражение и светорассеяние света.
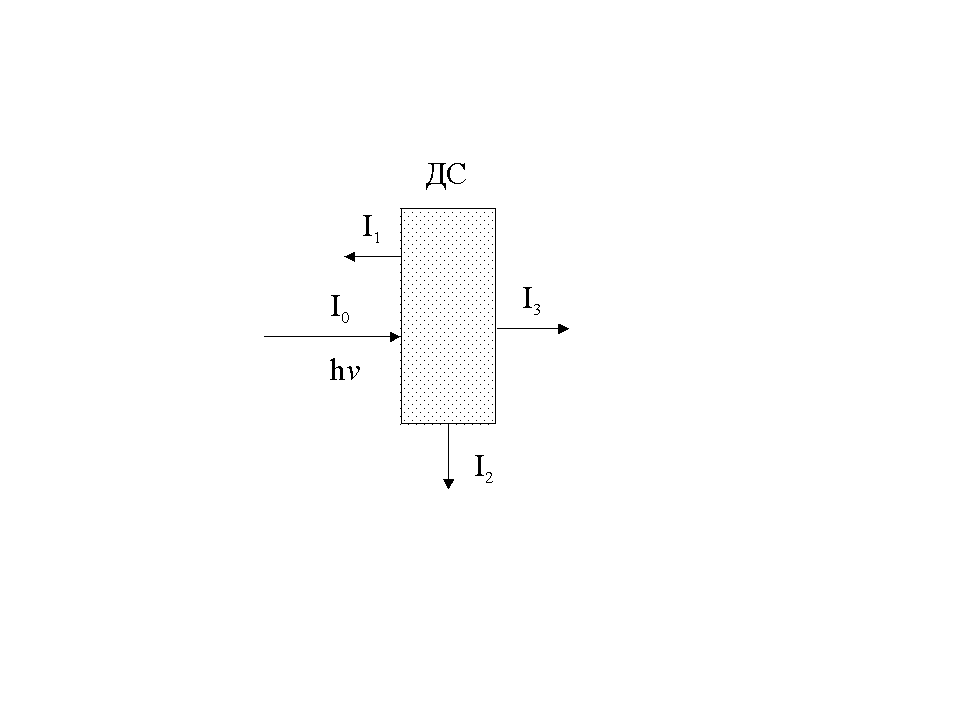 Если
а
(размер частиц ДФ) > λ (длины волны
света) происходит отражение
света (I1)
от
поверхности частицы.
Если
а
(размер частиц ДФ) > λ (длины волны
света) происходит отражение
света (I1)
от
поверхности частицы.
Когда a < λ происходит светорассеяние (эффект Тиндаля). Яркий свет от сильного источника фокусируют через линзу на кювету с раствором. При наблюдении в перпендикулярном лучу направлении видна светящаяся голубоватая полоска в форме конуса. Благодаря этому эффекту коллоидные растворы отличают от истинных. Интенсивность рассеянного света (I2) выражается уравнением Рэлея (I2 1/4 , где -длина волны света), из которого следует, что лучи света с минимальной длиной волны (голубые) наиболее подвержены рассеянию (голубой цвет неба и морской воды)
Светопоглощение происходит, когда частицы являются проводящими (металлическими), поэтому типично для золей металлов. Светопоглощение в коллоидных растворах зависит от дисперсности. Чем меньше размер частиц золя, тем сильнее поглощаются более короткие волны.
Окраска многих минералов- цветных стекол, драгоценных камней и самоцветов, содержащих включения из высокодисперсных металлов, связана с избирательным поглощением и рассеянием света.
Электрокинетические свойства дисперсных систем .
Под действием внешнего электрического поля частицы дисперсной фазы перемещаются в сторону одного из электродов (электрофорез) или под действием внешнего электрического поля жидкость может продвигаться через твердое пористое тело (электроосмос). В практике, например, при возведении плотин, дамб и для сооружений путем намыва грунта для удаления влаги в грунт вводят электроды, вода переносится к катодам и удаляется откачиванием.
Электрофорез и электроосмос свидетельствуют о том, что на поверхности твердых частиц возникают электрические заряды
