
- •Растворы.
- •Характеристика и свойства растворов.
- •Классификация растворов.
- •I.Растворы классифицируются по агрегатному состоянию растворителя и растворенного вещества.
- •Способы выражения концентраций:
- •II.Растворы подразделяются также по степени взаимодействия растворителя и растворенного вещества.
- •Давление насыщенного пара над раствором. Закон рауля.
Давление насыщенного пара над раствором. Закон рауля.
Растворы нелетучих веществ в летучих растворителях.

рA0– давление насыщенного пара над чистым растворителем.
рA– давление насыщенного пара над раствором.
Давление насыщенного пара рA0 над растворителем или жидкостью определяется межмолекулярным взаимодействием внутри жидкости. Чем больше сила взаимодействия fA-A между молекулами, тем меньше пара над жидкостью, и соответственно, тем меньше давление этого парарA0 <<<.
Давление насыщенного пора над раствором рAпри нелетучем растворенном веществе В отличается от давления насыщенного пара над чистым растворителемрA0. Для нахождения этого отличия в зависимости от состава идеального раствора рассмотрим условия равновесияi-го компонента в растворе и в парообразном состоянии. Это равновесие определяется равенством химических потенциалов:
![]() , где
, где
![]() –
химические потенциалыi-го
компонента в растворе и в парообразном
состоянии.
–
химические потенциалыi-го
компонента в растворе и в парообразном
состоянии.
Химический потенциал можно выразить через парциальное давление:
![]()
Если i-й компонент подчиняется законом идеальных газов, то дифференцируя это уравнение, получим:
![]() (*)
(*)
Теперь из уравнений
![]() и (*) выразим
изменения мольной доли растворенного
вещества следующим образом:
и (*) выразим
изменения мольной доли растворенного
вещества следующим образом:
![]()
Проведем интегрирование этого уравнения от рA0дорAи отNA=1 доNA, изменяющегося в пределах 0<NA<1, гдеNA– мольная доля растворителя в растворе; для чистого растворителяNA=1,

После интегрирования получаем:
![]()
![]()
![]() (1) (*)
(1) (*)
Давление насыщенного пара над растворомрA равно произведению его давления над чистым растворителем рA0 на его мольную долюNA.
Если раствор состоит из двух компонентов А(р-ль) и В(в-во), то мольная доля растворенного вещества равна NB=1-NA. Тогда уравнение (*) трансформируется:
Если NВ – мольная доля растворенного вещества, то
 (2) (**)
(2) (**)
Формулы (*) и (**) отражают различные способы выражениязакона Рауля.
Разность (рA0- рA) характеризует понижение давления насыщенного пара над раствором, а отношение (рA0- рA)/ рA0 – относительное понижение давления насыщенного пара.
Тогда закон Рауля формулируется следующим образом:относительное понижение давления пара над раствором равно мольной доле растворенного вещества в растворе.

Закон Рауля применим к идеальным и сильно разбавленным растворам.
Максимальноедавление пара, создаваемое жидкостью – давление её насыщенного пара при данной температуре.
ДНП растет с температурой.
Когда ДНП становится равным внешнему давлению, жидкость закипает.
Пример.Вычислим давление пара при 373 К (1000С) над водным раствором сахарозы, мольная доля которой составляетNB=1,01∙10-3, для воды рA0=1,013∙105 Па.
Согласно уравнению (**)
![]()
Как следует из полученных данных, над раствором сахарозы происходит весьма незначительное снижение давления насыщенного пара воды по сравнению с чистой водой.
Идеальные растворы из двух летучих компонентов.
А
В
А+В
Общее давление пара над раствором рбудет равно сумме парциальных давлений его компонентов; для раствора, содержащего компоненты А и В, общее давление р=рА+рВ.
На основании уравнения (*),
как для компонента А, так и для компонента
В, можно считать![]() ,
аNА=1-NВ.
,
аNА=1-NВ.
Общее давление будет равно:
![]()
(3) (***)
Это уравнение характеризует линейную зависимость давления от мольной доли компонента В, что можно отобразить графически.
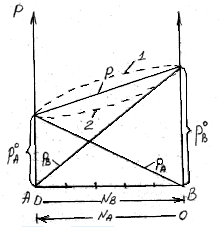
На рисунке по оси ординат слева отложены парциальные давления компонента А, которые изменяются от 0 до рA0, а справа – изменения парциального давления компонента В. Общее давлениеризменяется отрA0 дорВ0.Линейная зависимостьобщего и парциальных давлений от состава растворахарактерна для идеальных и разбавленных растворов(ΔV=0; ΔH=0; ΔS=ΔSи.г).
Практически, идеальными свойствами обладает раствор бензола в толуоле, что объясняется незначительностью сия межмолекулярного взаимодействия между молекулами всех компонентов раствора. Поэтому общее давление над раствором бензола в толуоле равно сумме парциальных давлений каждого из компонентов.
В случае предельно разбавленных растворов, концентрация растворенного вещества в которых бесконечно мала, давление пара (газа) растворителя выражается в соответствии сзаконом Рауля:
![]()
Давление паров растворенного вещества, которого в предельно разбавленном растворе ничтожно мало, не подчиняется закону Рауля. В этом случае давление пара над раствором описывается законом Генри, который формулируется так:при постоянной температуре парциальное давление растворенного вещества рГ пропорционально его мольной доле:
![]() ,
,
где КГ – коэффициент пропорциональности, называемыйконстантой Генри(справочная величина), которая зависит от температуры и природы компонентов раствора, но не зависит от давления.
Для неидеальных растворов линейная зависимость общего давления от состава раствора нарушается: наблюдается положительное и отрицательное отклонения. Причем, как правило, эти отклонения одного знака как для общего давления р, так и для парциальных давленийрAирВкомпонентов раствора.
Положительное отклонение от закона Рауля наблюдается в том случае, когда в растворе идет диссоциация молекул компонентов в растворе. Такие растворы образуются с поглощением теплоты (ΔH>0), т.е. процесс растворения будет эндотермическим.
ΔH>0, fA-A > fA-В

Отрицательное отклонение от закона Рауля наблюдается в случае ассоциации (укрупнения) частиц, формирующих раствор, и образования более прочных связей. При этом растворение идет с выделением теплоты (ΔH<0), т.е. процесс экзотермический.
ΔH<0, fA-A < fA-В

