
- •Пищевая химия
- •Содержание
- •1.2 Общие сведения
- •1.3 Практическая часть
- •1.3.1 Опыт 1. Разделение альбуминов и глобулинов яичного белка методом высаливания
- •1.3.1.1 Методика выполнения работы
- •1.3.1.2 Оформление результатов опыта
- •1.3.3.1 Методика выполнения работы
- •1.3.3.2 Оформление результатов опыта
- •1.3.4 Опыт 4. Колориметрический метод определения содержания доступного лизина
- •1.3.4.1 Подготовка к анализу
- •1.3.4.1.1 Методика очистки красителя «Оранж ж»
- •1.3.4.1.2 Приготовление раствора красителя
- •1.3.4.1.3 Построение градуировочного графика
- •1.3.4.2 Методика выполнения работы
- •1.3.4.3 Оформление результатов опыта
- •1.4 Контрольные вопросы
- •2.2 Общие сведения
- •2.3 Практическая часть
- •2.3.1 Опыт 1. Определение редуцирующих сахаров в продуктах растительного происхождения по Иссекутцу
- •2.3.1.1 Методика выполнения работы
- •2.3.1.2 Оформление результатов опыта
- •2.3.2 Опыт 2. Определение глюкозы по методу Вильштеттера и Шудля
- •2.3.2.1 Методика выполнения работы
- •2.3.2.2 Оформление результатов опыта
- •2.3.3 Опыт 3. Определение сахарозы
- •2.3.3.1 Методика выполнения работы
- •2.3.3.2 Оформление результатов опыта
- •2.4 Контрольные вопросы
- •3.2 Общие сведения
- •3.3 Практическая часть
- •3.3.2 Опыт 1. Определение содержания изомеров жирных кислот с сопряженными двойными связями.
- •3.3.2.1 Методика выполнения работы
- •3.3.2.2 Оформление результатов
- •3.3.3 Опыт 2. Определение перекисного числа масла.
- •3.3.3.1 Методика выполнения работы
- •3.3.3.2 Оформление результатов
- •2.4 Контрольные вопросы
- •4.2 Общие сведения
- •4.3 Практическая часть
- •4.3.1 Приготовление препаратов α-амилазы
- •4.3.2 Методика выполнения работы
- •4.3.3 Оформление результатов опыта
- •4.4 Контрольные вопросы
- •Литература
- •5.2 Общие сведения
- •5.3 Практическая часть
- •5.3.1 Методика выполнения работы
- •5.4 Контрольные вопросы
- •6.2 Общие сведения
- •6.3 Практическая часть
- •7.2 Общие сведения
- •7.3 Практическая часть
- •7.3.1 Опыт 1. Фотоколориметрическое определение ниацина (витамина рр)
- •7.3.1.1 Методика выполнения работы
- •7.3.1.2 Оформление результатов
- •7.3.2 Опыт 2. Фотоколориметрический метод определения аскорбиновой кислоты
- •Приготовление полунасыщенного раствора гидрохинона
- •Приготовление раствора ацетатного буфера с рН 4,0
- •7.3.2.1 Методика выполнения работы
- •7.3.2.2 Оформление результатов
- •7.4 Контрольные вопросы
- •Литература
2.3.2 Опыт 2. Определение глюкозы по методу Вильштеттера и Шудля
В основе этого метода лежит способность молекулярного йода в щелочной среде окислять только альдегидоспирты, не влияя на кетоспирты. Реакция идет в 2 стадии:
2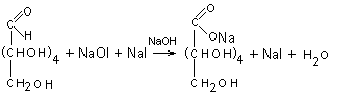 NaOH + I2
→ NaOI + NaI + H2O
NaOH + I2
→ NaOI + NaI + H2O
При внесении излишка йода непрореагировавший йод можно определить в кислой среде титрованием тиосульфатом натрия:
NaOI + NaI + 2HCl → I2 + 2NaCl + H2O
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Приборы и реактивы: конические колбы на 100 мл; бюретка для титрования; 0,1м раствор йода; 0,1 м раствор гидроксида натрия; 0,1 м раствор серной кислоты; 0,1 м раствор тиосульфата натрия; 1 % раствор крахмала.
2.3.2.1 Методика выполнения работы
В 2 колбы на 100 мл внести по 10 мл раствора йода. В одну из колб (опытный вариант) добавить 20 мл экстракта, приготовленного в опыте 2.3.1.1, в другую колбу (контрольный вариант) прилить 20 мл дистиллированной воды. Затем медленно добавить 15 мл раствора гидроксида натрия и оставить стоять при комнатной температуре 15 минут. После этого раствор подкислить 20 мл раствора серной кислоты и остаток йода оттитровать раствором тиосульфата натрия в присутствии растворимого крахмала (3 капли).
Массовую концентрацию глюкозы в растительном сырье ( г, %) рассчитать по формуле:
Г =
![]() ,
,
![]() -
объемы раствора тиосульфата натрия,
пошедшие на титрование, соответственно
контроля и опыта, мл;
-
объемы раствора тиосульфата натрия,
пошедшие на титрование, соответственно
контроля и опыта, мл;
![]() -
масса глюкозы, мг, эквивалентная 1 мл
раствора йода;
-
масса глюкозы, мг, эквивалентная 1 мл
раствора йода;
![]() -
навеска сырья (мг) в 1 мл экстракта;
-
навеска сырья (мг) в 1 мл экстракта;
![]() -
объем
экстракта, взятый для определения, мл.
-
объем
экстракта, взятый для определения, мл.
2.3.2.2 Оформление результатов опыта
Полученные результаты записывают в таблицу 7.
Таблица 7.
|
Образец |
Навеска, мг |
|
|
|
Г, г% |
|
|
|
|
|
|
|
2.3.3 Опыт 3. Определение сахарозы
Приборы и реактивы: мерная колба на 100 мл; мерный цилиндр; 5 % раствор соляной кислоты; 0,1 н раствор гидроксида натрия.
2.3.3.1 Методика выполнения работы
Отобрать 50 мл экстракта пипеткой в мерную колбу на 100 мл, добавить 5 мл раствора соляной кислоты, поместить в кипящую водяную баню на 30 минут для инверсии сахарозы. Затем колбу охладить, добавить до метки раствор гидроксида натрия, перемешать и в 10 мл гидролизата определить редуцирующие сахара по Иссекутцу.
Массовую долю сахарозы (С, %) в растительном сырье найти по формуле:
С = (х – Рв) 0,95, где
х, Рв – массовая доля редуцирующих сахаров в экстракте после и до инверсии, %;
0,95 – коэффициент пересчета редуцирующих веществ на сахарозу.
Пример расчета. При определении Рв в экстракте методом Иссекутца на титрование контроля и опыта пошло соответственно 9,5 и 3,4 мл тиосульфата. Остаток не вошедшего в реакцию с сахарами железосинеродистого калия определяют по пропорции:
10:9,5 = х:3,4
х = 3,58 мл
Объем К3Fe(СN)6, пошедший на реакцию с редуцирующими сахарами, составляет
10 – 3,58 = 6,42 мл
По таблице 7 находят количество редуцирующих сахаров:
6,40 мл – 10,41 мг
0,02 мл – 0,03 мг
6,42 мл – 10,44 мг Рв
Тогда массовая доля Рв в растительном сырье составит:
Рв =
![]() ,
,
По методу Вильштеттера и Шудля на титрование контроля и опыта пошло соответственно 10,0 и 8,0 мл тиосульфата натрия. Вычисляем массовую долю глюкозы в растительном материале по формуле:
Г =
![]()
Массовая доля фруктозы (Ф, %) в растительном сырье равна:
Ф = Рв – Г
В нашем примере это составит:
Ф = 10,44 – 4,5 = 5,94 %
Для определения количества редуцирующих сахаров в экстракте после инверсии известно, что на титрование контроля и опыта пошло соответственно 9,5 и 2,8 мл. Остаток железосинеродистого калия составляет х = 2,94 мл; пошедшего на реакцию с сахарами:
10 – 2,94 = 7,06 мл
По таблице 7 находим количество редуцирующих сахаров – 11,57 мг.
Следовательно, массовая доля их в экстракте после инверсии составляет:
х =
![]()
Массовая доля сахарозы в растительном сырье равна:
С = (11,57 – 10,44) 0,95=1,07 %
