
- •1. Строение атома
- •2. Химическая связь
- •3. Химическая термодинамика
- •Кинетика и равновесие химических реакций
- •Концентрация растворов
- •Электролитическая диссоциация
- •6 Гальванический элемент
- •Электролиз
- •Коррозия металлов
- •Энтальпии образования веществ, стандартные энтропии и температурные коэффициенты в уравнении теплоемкости
- •Электроотрицательность элементов по Полингу
- •Константы диссоциации кислот и оснований в водных растворах
- •Стандартные электродные потенциалы металлов (ряд напряжений)
1. Строение атома
Задание.
1. Составьте структуру электронной оболочки атомов элементов А и Б (табл. 2).
2. Покажите распределение электронов по ячейкам для атомов В и иона Г. Подсчитайте для них ковалентность.
Таблица 2
|
Номер варианта |
А |
Б |
В |
Г |
|
1 |
40 Zr |
71 Lu |
С |
Mg2+ |
|
2 |
31 Ga |
69 Tm |
P |
О-- |
|
3 |
34 Se |
68 Er |
Cl |
N2+ |
|
4 |
93 Np |
33 As |
B |
S2+ |
|
5 |
25 Mn |
96 Cm |
O |
Se2+ |
|
6 |
30 Zn |
63 Eu |
Na |
P3+ |
|
7 |
27 Co |
92 U |
Be |
Cl3+ |
|
8 |
42 Mo |
90 Th |
Mo |
F-- |
|
9 |
35 Br |
100 Fm |
Li |
S2+ |
|
10 |
38 Sr |
85 At |
N |
Cl-- |
|
11 |
26 Fe |
83 Bi |
Pl |
N+ |
|
12 |
59 Pr |
49 In |
F |
C2+ |
|
13 |
28 Ni |
84 Po |
О |
Na+ |
|
14 |
51 Sb |
89 Ac |
S |
N3+ |
|
15 |
22 Ti |
99 Es |
Ne |
Be2+ |
|
16 |
52 Те |
88 Ra |
К |
Cl-- |
|
17 |
73 Та |
37 Rb |
С |
Mg2+ |
|
18 |
24 Cr |
97 Bk |
S |
B3+ |
|
Номер варианта |
А |
Б |
В |
Г |
|
19 |
41 Nb |
68 Er |
С |
O2- |
|
20 |
31Ga |
93 Np |
P |
Mg2+ |
|
21 |
34 Se |
95 Am |
Cl |
S2+ |
|
22 |
33 As |
91 Pa |
B |
N2+ |
|
23 |
25 Mn |
94 Pu |
O |
P3+ |
|
24 |
32 Ge |
98 Cf |
Na |
Se2+ |
|
25 |
27 Co |
66 Dy |
Be |
P- |
|
26 |
42 Mo |
63 Eu |
Mg |
Cl3+ |
|
27 |
36 Kr |
85 At |
Al |
Cl- |
|
28 |
23 V |
101 Md |
Si |
Cl5+ |
|
29 |
21 Sc |
59 Pr |
F |
N+ |
|
30 |
49 In _ |
82 Pb |
P |
Cl+ |
Пример. Составьте структуру электронной оболочки атома 103 Lr. Покажите распределение электронов по ячейкам для атома Si* и иона Si2+. Подсчитайте для них ковалентность.
Решение. Структура электронной оболочки атома 103Lr:
103Lr 1s22s2p63s2p6d104s2p6d10f145s2p6d10f146s2p6d17s2
Lr относится к семейству f - элементов. Структура электронной оболочки атома Si:
14Si 1s22s2p63s2p2
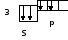 K=2
K=2
К - ковалентность, определяется числом неспаренных электронов.
В возбужденном состоянии (Si) электроны переходят на более высокие энергетические подуровни, ковалентность атома возрастает:
Si K=4
K=4
Положительно заряженный ион Si2+ образуется в результате отдачи 2 электронов:
Si2+=Si0-2e
Следует учесть, что при образовании положительно заряженных ионов обычно происходит возбуждение электронов:
Si2+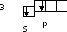 K=2
K=2
2. Химическая связь
Задание.
Изобразите пространственную структуру молекул А и Б (табл. 3). Определите, полярна ли связь в молекулах и полярны ли молекулы в целом. Используйте справочные данные по электроотрицательности элементов.
Таблица 3
|
Номер варианта |
А |
Б |
Номер варианта |
A |
Б |
|
1 |
AsCl3 |
MgI2 |
16 |
PBr3 |
HC1 |
|
2 |
НВг |
AlBr3 |
17 |
SnF4 |
Pl3 |
|
3 |
BeCl2 |
I2 |
18 |
N2 |
MgI2 |
|
4 |
NI3 |
SnCl2 |
19 |
BaBr2 |
HI |
|
5 |
H2Te |
AlI3 |
20 |
InBr3 |
CO |
|
6 |
SnCl4 |
BeI2 |
21 |
GeH4 |
SiO2 |
|
7 |
PCl3 |
SiO2 |
22 |
SiF4 |
SbCl3 |
|
8 |
NCl3 |
BCl3 |
23 |
GeI4 |
AsH3 |
|
9 |
РЬС12 |
CS2 |
24 |
InCl3 |
H2Se
|
|
10 |
MgCl2 |
CO2 |
25 |
SCl2 |
NH3 |
|
11 |
AsI3 |
SiCl4 |
26 |
SnH4 |
Br2 |
|
12 |
CCl4 |
SbBr2 |
27 |
AsBr3 |
SiH4 |
|
13 |
SnCl4 |
MgBr2 |
28 |
H2Te |
AlBr3 |
|
14 |
H2O |
SnI4 |
29 |
GeCl4 |
HBr |
|
15 |
РНз |
Br2 |
30 |
O2 |
CH4 |
Пример. Изобразите пространственную структуру молекулы BI3. Определите, полярна ли связь в молекуле и молекула в целом.
Решение. Составим структуру электронной оболочки В, центрального атома молекулы:
В 1s22s2p1  К=1
К=1
Валентность бора в BI3 равна 3, следовательно, атом бора переходит в возбужденное состояние:
В  К=3
К=3
В образовании связей участвуют орбитали одного s-и двух p-электронов атома бора, что приводит к образованию трех гибридных орбиталей, расположенных под углом 120°. Тип гибридизации sp2.
Структура электронной оболочки атома йода
I 1s22s2p63s2p6d104s2p6d105s2p5.  K=1
K=1
В образовании связей участвуют орбитали р-электронов атомов йода.
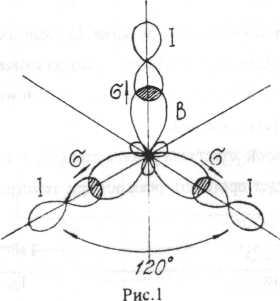
ЭО=ЭО1 – ЭОв=2,5 – 2,0=0,5.
Смещение электронной плотности происходит к атому I (на рис.1 изображено стрелкой). Молекула в целом не полярна, т.к. имеет симметрическую форму (векторная сумма дипольных моментов связей равна нулю).
