
Khimia_Bilety-2
.rtf1. Первое начало термодинамики (1842, Мейер) - всеобщий закон природы, закон сохранения и превращения энергии. Энергия не исчезает и не возникает из ничего а только превращается из одного вида в другой в строго эквивалентных соотношениях. В изолированной системе внутренняя энергия постоянна( дельта U = 0)
Энтальпия(Н) - сумма внутренней энергии системы и произвеения объема на давление. Это ТД функция, характеризующая энергетическое состояние системы при изобарно-изотермических условиях. Являтся экстенсивным параметром, зависит от количества вещества, температуры, давления, но не от пути прохождения реакции(закон Гесса)
Стандартная энтальпия образования простых веществ = 0. Энтальпия реакции равна разности исходных веществ из продуктов реакции. Н прямой реакции равна обратной но с противоположным знаком.
Экзотермические реакции - Н кон. < Н нач. (дельта Н < 0): СН4 + 2О2 = СО2 + 2Н2О + энергия (свет, тепло); СаО + Н2О = Са(ОН)2 + энергия (тепло)
CaCО3 = Cao+CO2 - эндотермическая реакция.
2. Энтропия - ТД функция, характеризующая меру неупорядоченности системы, т.е. неоднородности расположения и движения частиц в ней. S = Q/T (Дж/(моль*К). Экстенсивное свойство (Sкон. - Sнач.). Зависит от агрегатного состояния(газ - жидкость - твердое тело), от аллотропной формы(графит - алмаз) от температуры(возрастает неупорядоченность движения частиц). Стандартная энтропия простых веществ НЕ равна нулю.
Самопроизвольный процесс совершается в системе без затрат работы извне и который уменьшает работоспособность системы после своего завершения, следовательно, система переходит из менее в более устойчивое состояние.
3. Стационарное состояние - постоянство свойств во времени, поддерживающееся за счет непрерывного обмена веществом, энергией и информацией между системой и окр. средой. (характерно для живого организма)
Равновесное состояние - постоянство всех свойств во времени в любой точке сисетмы и отсутствие потоков вещества и энергии в ней.
Переходное состояние - переход системы из одного равновесного состояния в другое. Изменение свойств во времени.
Процесс - переход системы, сопровождающийся необратимым или обратимым изменением хотя бы одного параметра, характеризующего данную систему.
4. Процессы, при которых энергия в системе уменьшается, а энтропия возрастает, протекают самопроизвольно.
Энергия Гиббса(свободная энергия)- учитывает энергетику и неупорядоченность системы при изобарно-изотермических условиях. Та часть энтальпии системы, которая может быть переведена в работу. (Gкон. - Gнач.). Равна нулю для образования простых веществ. дельтаG = дельтаH - T*дельтаS.
В системе при постоянной температуре и давлении могут происходить только те процессы, при котрых энергия Гиббса уменьшается.
Экзергонические реакции - биохимические реакции, опровождающиеся ументшением энергии Гиббса. Могут совершаться самопроизвольно.
Эндергонические реакции - БХ реакции, при которых нергия Гиббса увеличивается. Невозможны без подвода энергии извне.(фотосинтез).
В живых системах эндергонические реакции происходят за счет сопряжения с экзергоническими. Это возможно, если обе реакции имеют какое-либо общее промежуточное соединение.
5. Химическре равновесие - стремление биохимических реакций достичь динамического равновесия, так как оно поддерживается вследствие протекания реакций в двух противоположных направлениях с одинаковыми скоростями( при этом энергия Гиббса минимальна, отсутствуют изменения величин параметров и функций состояния системы). Даная реакция самопроизвольна, в большинстве случаев обратима.
В открытой системе в стационарном состонии прирост энтропии принимает минимальное значение, рассеяние энергии Гиббса минимально.
Самопроизвольному протеканию реакции способствует энтропийный фактор, отрицательное значение изменения энергии Гиббса, т.е. при высоких температурах(тепловая денатурация белков).
И наоборот - для эндергонических реакций характерен энтальпийный фактор, достаточно низкие температуры(гидратация белков).
6. Гомогенные реакции не содержат поверхности раздела между реагентами, поэтому их взаимодействие протекает по всему объему.
Скорость химической реакции определяется изменением концентрации реагирующих веществ в единицу времени. v= c кон. - c нач./ tкон - tнач = дельта c/дельта t
Истинная скорость характеризует скорость в данный момент времени( только положительна величина, определяется первой производной концентрации по времени dc/dt).
Средняя скорость - модуль по частному дельта c/ дельта t
На скорость гомогенной реакции влияет природа реагирующих веществ, концентрация реагентов, температура, наличие катализатора.
7. Правило Вант-Гоффа - с увеличением температуры на каждые 10 градусов скорость реакции возрастает в 2-4 раза( 7-9 для ферментативных реакций).
γ-температурный коэффициент скорости реакции.
Физический смысл величины γ заключается в том, что он показывает, во сколько раз изменяется скорость реакции при изменении температуры на каждые 10 градусов.
Cкорость реакции и константа скорости химической реакции прямопропорциональны.
8. Энергия активации - минимальная энергия взаимодействующих частиц, достаточная для вступления их в химическую реакцию (кДж/моль). Характеризует э7ергетический барьер, преодоление которого частицами приводит к образованию новых частиц. Зависит от природы реагирующих частиц, пути прохождения реакции, НЕ зависит от температуры.
Если доля активных молекул превыщает 10^-7, то реакция протекает практически мгновенно, а если меньше 10^-18, то при данных условиях реакция практически не идет.
При повышении температуры реакции за счет величения энергии системы резко возрастает число активынх частиц, скорость реакции увеличивается.
Теория активных соударений: реакционноспособны только те молекулы, которые находятся в особом активном состоянии; активные молекулы образуются в результате протекания обратимого процесса поглощения энергии; обращаются в активные молекулы со скоростью, не зависящей от температуры; влияие температуры на скорость реакциии сводится к смещению равновесия между обычными и активными молекулами в сторону последних.
9. Уравнения Аррениуса: dlnk/dT = Ea/RT^2
Ea = -RT ln(k/A), где к - константа скорости реакции, А - фактор частоты для реакции, R - газовая постоянная, Т - температура в Кельвинах. (+ определения из 8 вопроса)
10. Катализатор - вещество, участвующее в реакции и увеличивающее ее скорость, но остающееся в результате неизменным. В присутствии катализатора реакция протекает по пути с меньшими значениями энергии активации, что и привожит к увеличению ее скорости. Катализатор также может способствовать опеределенной ориентации молекул в пространстве, увеличивать энтропию. На самом деле катализатор увеличивает скорость и обратной, и прямой реакции, способствуя установлению равновесия.
Ингибиторы препятствуют обычному протеканию реакции, вступая во взаимодействие с каким-либо промежуточным веществом.
Гомогенный катализ - катализатор и реакционная смесь находятся в одной фазе. Скорость пропорциональна количеству катализатора(омыление сложных эфиров) H2О2 + I → H2О + IO; H2О2 + IO → H2О + О2 + I
Гетерогенный катализ - катализатор обычно твердый, а реакция протекает на его поверхности. Скорость зависит от площади и состояния катализатора, т.к. реакция проходит на активных центрах(водный раствор пероксида водорода взаимодействует с оксидом марганца 4).
Положительный катализ - скорость растет, отрицательный - снижается.
11. Ферменты - белковые молекулы, которые катализируют химические реакции в живых системах. Каталиктической активностью обладают только активные центры молекулы. Имеется аллостерический центр, назначение которого состоит в распознавании субстрата и его размещении в активном центре.
Обладают каталитической эффективностью, высокой специфичностью, необходимыми определенными условиями(36-38 С, мягкая среда).
Общее между ферментами и неорганическими катализаторами:
1) Увеличивают скорость химических реакций, при этом сами не расходуются.
2) Ферменты и неорганические катализаторы ускоряют энергетически возможные реакции.
3) Энергия химической системы остается постоянной.
4) В ходе катализа направление реакции не изменяется.
Различия между ферментами и неорганическими катализаторами:
1) Скорость ферментативных реакций выше, чем реакций, катализируемых неорганическими катализаторами.
2) Ферменты обладают высокой специфичностью к субстрату.
3) Ферменты по своей химической природе белки, катализаторы - неорганика.
4) Ферменты работают только в опрделенном диапазоне температур (обычно в районе 37 град. С плюс/минус 2-3 град. С). , а скорость неорганического катализа возрастает в 2-4 раза при повышении температуры на каждые 10 град. С по линейной зависимости (правило Вант-Гоффа) .
5) Ферменты подвержены регуляции (есть активаторы и ингибиторы ферментов) , неорганические катализаторы работают нерегулируемо.
6) Ферменты обладают конформационной лабильностью - способностью к небольшим изменениям своей структуры за счет разрыва и образования новых слабых связей.
7) Ферментативные реакции протекают только в физиологических условиях, т. к. работают внутри клеток, тканей и организма (это определенные значения температуры, давления и рН).
12. (в картинках)
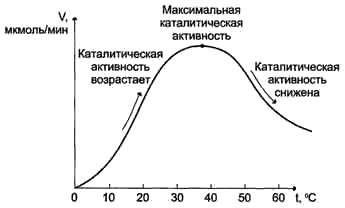
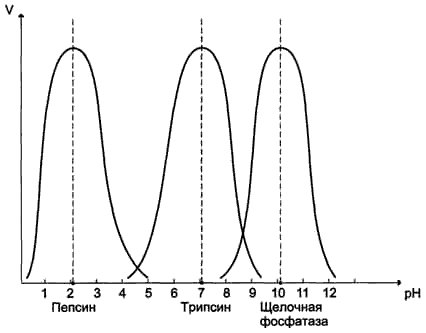

13. Для каждй ферментативной реакции промежуточной стадией является присоединение к активному центру фермента молекулы субстрата. Образование фермент-субстратного комплекса приводит к перераспределению электронов в молекуле субстрата, что уменьшает прочность разрываемых связей и приводит к уменьшению энергиии активации.
При данной концентрации фермента скорость зависит от концентрации субстрата. При низких концентрациях субстрата реакция имеет первый порядок о субстрату, а при высоких - нулевой. Достижение реакцией предельной скорости объясняется наличием в среде определенной концентрации фермента и тем, что его активные центры заняты. Дальнейший рост концентрации субстрата уже не будет вызывать изменения фермент-субстратного комплеса в системе.
k1 k2
![]()

E + S <=> (ES) -> E + P, где
k-1 - константы скоростей прямой и обратной реакций образования фермент-субстратного комплекса; k2 - константа скорости образования продукта.
14. Теория Дебая-Хюккеля - каждый ион действием своего эл. заряда поляризует окружение и образует вокруг себя некоторое преобразование ионов противоположного знака(ионная атмосфера).
Активность компонентов раствора - эффективная концентрация компонентов с учетом различных взаимодействий между ними в р-ре, т.е. с учетом отклонения поведения системной модели идеального раствора.
Отношение активности к общей концентрации вещества в растворе называется коэффициентом активности
![]()
Коэффициент активности служит мерой отклонения поведения раствора (или компонента раствора) от идеального. Отклонения от идеальности могут быть обусловлены различными химическими и физическими причинами — дипольные взаимодействия, поляризация, образование водородных связей, ассоциация, диссоциация, сольватация и др.
15. Изотонический раствор - растворы имеют одинаковое осмотическое давление, между ними происходит равновесный обмен растворителем. В медицине используются расторы 0,9% хлорида натрия(внутривенно для повышения кровяного давления после кровопотерь, для возмещения потерянной жидкости при обезвоживании), 5% раствор глюкозы.
Гипертонический раствор - с большим осмотическим давлением. Использются 3-10% расторы хлорида натрия при лечении гнойных ран, при легочных и желудочных кровотечениях для усиления мочеотделения, для промывания желудка и в виде клизмы.
Гипотонический раствор - с меньшим осмотическим давлением. Используют для ликвидации обезвоживания.
Гипертонический раствор всасывает растворитель гипотонического раствора, стремясь выровнять концентрации вещества путем перерапределения растворителя между контактирующими растворами.
16. Осмос - самопроизвольная диффузия молекул растворителя сквозь мембрну с избирательной проницаемостью. Не зависит от природы растворенного вещества, а только от числа частиц в растворе и от температуры.
Осмотическое давление - избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью. Для учета межмолекулярных взаимодействий в реальных растворах было предложено использовать изотонический коэффициент, который для растворов неэлектролитов i=1, а для растворов электролитов i > 1(максимальное значение равно числу ионов в его молекуле)
Pосм. = cRT
![]() i
— изотонический коэффициент раствора;
C — молярная концентрация раствора,
выраженная через комбинацию основных
единиц СИ, то есть, в моль/м3, а не в
привычных моль/л; R — универсальная
газовая постоянная; T — термодинамическая
температура раствора.
i
— изотонический коэффициент раствора;
C — молярная концентрация раствора,
выраженная через комбинацию основных
единиц СИ, то есть, в моль/м3, а не в
привычных моль/л; R — универсальная
газовая постоянная; T — термодинамическая
температура раствора.
(Онкотическое давление – осмотическое давление, создаваемое за счет наличия белков в биожидкостях организма.)
17. Коллигативные свойства – не зависящие от природы частиц свойства, а зависящие только от концентрации частиц в растворе.
Коллигативными свойствами разбавленных растворов являются: скорость диффузии, осмотическое давление, давление насыщенного пара растворителя над раствором, температура кристаллизации раствора, температура кипения.
Закон Рауля(1886) – при постоянной температуре относительное понижение давления насыщенного пара растворителя над идеальным раствором нелетучего вещества равно молярной доле растворенного вещества. (p0 – p)/p0 =I n/(n+N)
N – число молей растворителя; n – число молей нелетучего вещества.
Этот закон соблюдается только в идеальных растворах. Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области очень малых концентраций; при больших концентрациях наблюдаются отклонения от закона Рауля.
Второй закон Рауля(следствия) –
1)условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твердым растворителем. Это будет достигаться только при более низких температурах, чем температура замерзания растворителя.
2) жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если вещество нелетучее, то давление должно быть равным парциальному давлению растворителя.
18. Изотонический коэффициент Вант-Гоффа – показывает степень отклонения измеренного осмотического давления растворов многих неорганических веществ от рассчитанного. Безразмерный параметр, показывает поведение вещества в растворе.
Неэлектролиты не диссоциируют, следовательно, каждая молекула в растворе образует только одну частицу(i=1)
Электролиты диссоциируют, распадаясь на ионы, значит, изотонический коэффициент бужет больше одного и равен количеству ионов.
19. Осмос - самопроизвольная диффузия молекул растворителя сквозь мембрну с избирательной проницаемостью. Не зависит от природы растворенного вещества, а только от числа частиц в растворе и от температуры.
Осмотическое давление - избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью.
Онкотическое давление – осмотическое давление, создаваемое за счет наличия белков в биожидкостях организма
Pосм. = cRT
![]() i
— изотонический коэффициент раствора;
C — молярная концентрация раствора,
выраженная через комбинацию основных
единиц СИ, то есть, в моль/м3, а не в
привычных моль/л; R — универсальная
газовая постоянная; T — термодинамическая
температура раствора.
i
— изотонический коэффициент раствора;
C — молярная концентрация раствора,
выраженная через комбинацию основных
единиц СИ, то есть, в моль/м3, а не в
привычных моль/л; R — универсальная
газовая постоянная; T — термодинамическая
температура раствора.
20. Кислоты Бренстеда – те молекулы, которые способны быть донорами протонов в данной реакции.
H3O+(кислота) =H+ + H2O(основание) (кислота = Н + сопряженное основание)
Сила кислоты определяется ее способностью отдавать протоны, т.е. сильная кислота – активный донор. Слабые кислоты становятся сопряженными основаниями
21. Амфолиты – молекулы или ионы, способные отдавать и принимать протон, а следовательно, вступать в реакции, характерные для кислот и оснований.
HCO3(кислота) = H + CO3(основание)
Также амфолитами являются соединения, молекулы которых содержат две различные кислотно-основные группы(альфа-аминокислоты).
22. Кислоты, основания и амфолиты – протолиты. Переход протона от кислоты к основанию – протолиз.
Основания – акцепторы протонов. Отличаются от кислот по составу на один протон.
Смысл теории в том, что кислота не выделяет протон самостоятельно, а участвует в его переносе.
Для удобства оценки характера водной среды используют водородный показатель pH. Это количественная характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода. pH=-lg[H+] Иногда используют гидроксильный показатель pOH. В нейтральной среде водородный показатель =7, в кислой он меньше 7 а в щелочной – больше. Для определения кислотности среды используют индикаторный или ионометрический метод.
24. Водородный показатель воды: [H+][OH-] = 1.0*10^-14(22 C) логарифмируя это выражение получаем lg[H+] + lg[OH-] = -14 или pH+pOH=14 Это количественная характеристика кислотности среды, равная отрицательному десятичному логарифму концентрации свободных ионов водорода.
25. Реакции нейтрализации:
1)между слабыми электролитами NH3+CH3COOH=NH4+ +CH3COO-
2) слабыми и сильными NH3+H3O+(кислота) = NH4+ + H2O(основание)
3)сильными H3O(кислота)+OH=H2O+H2O
Реакции гидролиза:
B- + H2O=HB +OH-
Реакции ионизации:
CH3COOH + H2O(основание) ↔ H3O+(кислота) + CH3COO-
26. Большинство биожидкостей в организме способно поддерживать значение рН, так как они являются буферными растворами. Протолитичесий гомеостаз включает в себя не только физиологические механизмы, но и физмко-химическое буферное действие. Протолитическими буферными системами называются растворы, способные сохранять постоянное значение рН при добавлении или кислот, или щелочей. Компонентами буферного раствора являются донор протона и его акцептор(слабая кислота и слабое основание). Состав выражают формулами ее компонентов, указывая вначале акцептор, а затем донор протона.
Количественно буферный раствор характеризуется буферной емкостью – производной концентрации на среду dc/dX.
При разбавлении буферных растворов концентрация всех компонентов уменьшается. Но их отношение остается неизменным. Поэтому рН раствора согласно уравнению Гендерсона-Гассельбаха не меняется. Добавление небольших количеств сильной кислоты или щелочи в раствор моментально вызывает защитную реакцию по поддержанию кислотности среды. Защитные свойства будут сохраняться до тех пор, пока концентрации компонентов буферной системы будут выше концентрации добавляемых ионов.
27. Буферная система – протолитическая равновесная система, способная сохранять практически постоянное значение рН при добавлении небольшого количества кислоты или основания.
Согласно протолитической теории кислоты и основания могут быть трех типов: нейтральные, анионные и катионные. Анионные основания и кислоты представляют собой отрицательно заряженные ионы, например: HSO4-, HPO42-, HS- (кислоты); OH-, Cl-, NO3- (основания).
В роли катионных оснований и кислот выступают положительно заряженные ионы, например: NH4+, H3O+ (кислоты); H2N-NH3+, H2N-(CH2)2-NH3+ (основания).
28. Гидрокарбонатная буферная система является кислотной, т.е. содержит слабую кислоту(донор протона) и соль этой кислоты. рН кислотной буферной системы зависит от показателя концентраций акцептора и донора протона в растворе.
![]() Ка
= [HCO3-][H+]/[H2CO3]
Ка
= [HCO3-][H+]/[H2CO3]
[H+] = Ka[H2CO3]/[HCO3-] pH = -lg[H+] pKa = -lgKa1 -lg[H+] = -lgKa1-lg[H2CO3]/[HCO3-]
pH = pKa1+lg[HCO3-]/[H2CO3] (pH = pKa+lg c сопр.осн. /c сопр.к-та
рН зависит от соотношения концентраций компонентов, температуры, природы компонентов. Не зависит от разбавления.
29. Буферная емкость – число моль-эквивалентов сильной кислоты или щелочи, которые нужно добавить к 1л раствора, чтобы изменить рН на единицу. Различают емкость по кислоте и по основанию.
Зависит от концентраций компонентов и их отношения. Чем выше концентрация, тем больше буферная емкость. Основная буферная емкость определяется концентрацией буферной кислоты(донор протона) и наоборот. Уменьшается при разбавлении.
![]()
Зона буферного действия – интервал значения рН, в пределах которых сохраняется буферное действие.
30. Гидрокарбонатная система H2CO3 ↔ H+ + HCO3− - мощная и, пожалуй, самая управляемая система внеклеточной жидкости и крови. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Бикарбонатная система представляет собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты Н2СО3, выполняющую роль донора протона, и бикарбонат-иона НСО3–, выполняющего роль акцептора протона. При нормальном значении рН крови (7,4) концентрация ионов бикарбоната НСО3 в плазме крови превышает концентрацию СО2 примерно в 20 раз. Следовательно, эта система имеет буферную емкость по кислоте значительно большую, чем по основанию. Механизм действия данной системы заключается в том, что при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н+ взаимодействуют с ионами бикарбоната НСО3–, что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Последующее снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 через легкие в результате их гипервентиляции. Если в крови увеличивается количество оснований, то они, взаимодействуя со слабой угольной кислотой, образуют ионы бикарбоната и воду. При этом не происходит сколько-нибудь заметных сдвигов в величине рН. Бикарбонатная буферная система функционирует как эффективный регулятор в области рН 7,4.
Фосфатная буферная система - представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4– (донор протонов) и иона НРО42– (акцептор протонов). Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли двузамещенный фосфат – Na2HPO4. Во внеклеточной жидкости, в том числе в крови, соотношение [НРО42–]: [Н2РО4–] составляет 4:1. В крови емкость фосфатной буферной системы невелика (составляет не более 1 % общей буферной емкости), в связи с низким содержанием фосфатов в крови. Фосфатный буфер выполняет значительную роль в поддержании физиологических значений рН во внутриклеточных жидкостях и моче. Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО42– с образованием Н2РО4, а также ионов ОН– с ионами Н2РО4. Буферная пара (Н2РО4––НРО42–) способна оказывать влияние при изменениях рН в интервале от 6,1 до 7,7 и может обеспечивать определенную буферную емкость внутриклеточной жидкости.
Гемоглобиновая буферная система – самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови.Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). истема гемоглобина и система оксигемоглобина являются вза-имопревращающимися системами и существуют как единое целое. Буферные свойства гемоглобина прежде всего обусловлены возможностью взаимодействия кисло реагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина:
КНb
+ Н2СO3—> КНСO3 + ННb.
Белковая буферная система – NH2-Pt-COONa
В водных растворах: NH2-Pt-COOH <-> NH3-CH2COO-
Бывают анионного и катионного типа. Анионный буфер работает при рН> pIбелка, а катионный при рН <pIбелка. В сравнении с другими буферными системами имеет меньшее значение для поддержания кислотно-основного равновесия. Белки́ плазмы крови благодаря наличию кислотно-основных групп в молекулах белков (белок—H+ — кислота, источник протонов и белок− — сопряжённое основание, акцептор протонов) образуют буферную систему, наиболее эффективную в диапазоне pH 7,2—7,4
Белковая буферная система — главный внутриклеточный буфер. Он составляет примерно три четверти буферной ёмкости внутриклеточной жидкости. Компонентами белкового буфера являются слабодиссоциирующий белок с кислыми свойствами (белок-СООН) и соли сильного основания (белок-COONa). При нарастании уровня кислот они взаимодействуют с солью белка с образованием нейтральной соли и слабой кислоты. При увеличении концентрации оснований реакция их происходит с белком с кислыми свойствами. В результате вместо сильного основания образуется слабоосновная соль.
31. (в 30 вопросе)
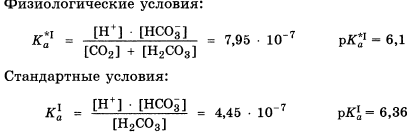
32. Ацидемия – отклонение рН крови от нормы(уменьшение рН).
Алкалиемия – (увеличение рН).
Буферные системы имеют большей емкостью по кислоте, так как в их составе преобладают буферные основания. Это отвечает особенностям метаболизма. Образуется больше кислотных продуктов, чем основных.
33. Алкалоз – увеличение кислотной буферной емкости физиологической системы по сравнению с нормой(рН крови становится выше, буферная емкость по кислоте выше, щелочной резерв повышается). Экзогенный алкалоз в основном возникает при поступлении в организм лекарств или других веществ, способствующих повышению рН(сода, ацетат калия). При компенсированном алкалозе кровь сохраняет рН в пределах нормы. Некоспенсированный алкалоз повышает кислотную буферную емкость и повышает рН крови до 7.9.
