
нирс
.docxХитозан
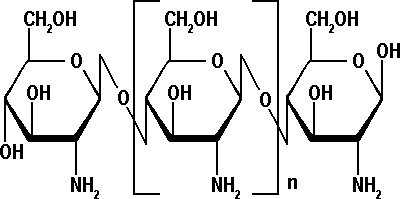
Хитозан- аминосахар, макромолекулы состоят из случайно-связанных β-(1-4) D-глюкозаминовых звеньев и N-ацетил-dглюкозамин.

Хитозан добывают из панцирей ракообразных и из низших грибов путем удаления ацила, который придает жесткость хитину. Впервые он был получен в 1859 году профессором С. Роже.
Хитозан обладает невероятными свойствами, начиная с того, что он используется в различных БАДах для похудания и отчистки организма, заканчивая его перспективностью для нанотехнологий.
Хитозан можно назвать “второй кожей” после одного случая. Известно, что при ожогах 70% кожи и более у человека почти нет шансов выжить, но известен случай, когда у мальчика в Японии был ожог 80% кожи и медики применили искусственную кожу из хитозана. После нескольких месяцев лечения кожа мальчика восстановилась и стала такой же, как была. При этом от ожогов не осталось и следа.
Что же это за искусственная кожа? Ученые называют так хитозанноноволокна. Они приготовленны из нанонитей в 200 раз тоньше человеческого волоса, при этом обладают способностью заживлять раны и ожоги. По мимо этого изветсно, что хитозан облодает антимикробной активностью, позже стало выяснено, что он убивает до 99% микробов, способностью поглащать биологические жидкости и помогать регенерации тканей. Искуственная кожа не вызывала реакций отторжения организмом, легко срасталась с телом, так как по своему составу близка к человеческому организму.
На основе его способности к ускорению регенерации тканей его стали применять и в хирургии, создав саморассасывающиеся хирургические шовные материалы. Их используют как заменители кровеносных сосудов, катетеров, шлангов. К тому же хитозаннановолокна не вызывают аллергической реакции.
Ко всему прочему в результате дальнейших экспериментов было обнаружено, что клетка посаженная на такое волокно растет. Это невероятное, революционное, фундаментальное открытие, которое позволит уже в недалеком будущем выращивать органы, а следовательно, решит многие проблемы в области трансплантации.
Немаловажно и то, что хитозаннановолокна получены именно нашими учеными впервые в мире в стенах московского технопарка “Строгино”
В области наномедицины антитела против антигенов человека могутприменяться для адресной доставки наночастиц в определённые клетки. Например, магнитные наночастицыконьюгированные с антителами к онкомаркёрам могут использоваться для диагностики с помощью магнитно-резонансной томографии и для терапии с помощью гипертермии (в последнем случае нагрев частицосуществляется внешним магнитным полем и вызывает локализованную смерть клеток).
ДНК-микрочип – устройство, созданное по аналогии с электронными микросхемами (чипами),предназначенное для одновременного выявления множества определенных последовательностей ДНК. ДНК-микрочип используется для изучения экспрессии генов и поиска мутаций в биомедицинских исследованиях.Микрочип изготавливается из стекла, силикона или пластика. ДНК наносится на него методом машинноймикропечати и химической пришивки в виде множества упорядоченных точек, каждая из которых содержитравное количество синтезированных ДНК-фрагментов, имеющих уникальную последовательность. В другихтехнологиях гибридизационного анализа генов комплементарные фрагменты ДНК пришивают к поверхностимикроскопических шариков. Современные ДНК-микрочипы могут одновременно измерить экспрессиюдесятков тысяч генов у человека и выявить около миллиона мутаций. Принцип работы микрочипа дляизучения экспрессии генов состоит в следующем. Активная работа гена в данной ткани выражается внакоплении его матричной РНК (мРНК). Все мРНК экстрагируются из образца ткани, и с помощью ферментаобратной транскриптазы на них синтезируется т.н. комплементарная ДНК (кДНК), которая значительноустойчивей и удобней в работе, чем мРНК. Полученный набор кДНК метят с помощью флуоресцентных илирадиоизотопных меток. Содержание индивидуальных кДНК в образце прямо пропорционально содержаниюих мРНК-матриц и, следовательно, уровню активности соответствующих генов. Смесь кДНК наносят намикрочип, в каждой точке которого пришиты ДНК-фрагменты, соответствующие кодирующейпоследовательности одного из генов. кДНК находят «свои» точки и связываются (гибридизуются) с ними попринципу комплементарности. Чем больше в растворе кДНК данного вида, тем больше ее прикрепляется ксвоей точке. Затем специальное сканирующее устройство определяет содержание кДНК в каждой точкемикрочипа, а программа соотносит его с названием гена, представленного данной точкой. Результатом ДНК-микрочипового исследования является матрица из точек, интенсивность которых прямо пропорциональнаактивности соответствующих генов.
Для создания «лабораторий на чипе» (lab-on-a-chip, LOC) используются технологии фотолитографии, микро-и нанофлюидики, прецизионного конструирования, наносенсорики и др., применяемые вмикроэлектромеханических системах (МЭМС). LOC отличаются от обычных биомикрочипов, выполняющих,как правило, одну реакцию (например, гибридизацию нуклеиновых кислот) возможностью осуществлятьпоследовательные химические превращения исходных образцов, включая стадии разделения,концентрирования, смешивания промежуточных продуктов, перемещения их в различные реакционныемикрокамеры и считывания конечных результатов. Основные преимущества LOC заключаются в простоте ихиспользования, высокой скорости проведения анализа, малом необходимом количестве образцов иреагентов, необходимых для получения результата, а также хорошей воспроизводимости результатовблагодаря использованию стандартных технологий и автоматизированного оборудования входе изготовления и применения. В перспективе LOC смогут выполнять исследования, проводимые внастоящее время в специализированных лабораториях на дорогостоящем оборудовании, например,диагностику онкологических и инфекционных заболеваний непосредственно у постели больногоили экспресс-анализ загрязнения окружающей среды в полевых условиях. Также существуетперспектива будущего применения лабораторий на чипе в качестве микрореакторов в синтетической химии.
‘
Магнитные наночастицы, используемые в терапевтических целях, могут состоять из ферро-,ферримагнитных или суперпарамагнитных материалов. Основное их достоинство - это возможностьбесконтактного управления их перемещением в организме с применением внешнего магнитного поля.Наиболее широкое применение в медицине находят наночастицы на основе оксидов железа со структуройшпинели (магнетит, маггемит).
Магнитные наночастицы в терапевтических целях редко применяют в чистом виде. Обычно ихинкапсулируют или помещают в биоинертные матрицы (различные органические соединения или полимеры,в том числе природного происхождения) с целью снижения возможного токсичного воздействия магнитнойфазы, повышения её физико-химической устойчивости и создания возможности иммобилизации наповерхности таких капсул или матриц лекарственных препаратов. Капсулирование обычно проводят всуспензиях ультрадисперсных ферро- , ферри- и суперпарамагнитных частиц,содержащих стабилизирующие реагенты и получивших название "магнитные жидкости".
Одной из областей применения магнитных наночастиц в медицине является адресная доставка лекарств. Кеё основным преимуществам относят возможность значительного уменьшения токсического действиялекарств на другие органы и системы организма, возможность направлять и удерживать в определённомместе наночастицы с лекарством при помощи магнитного поля, визуализировать их методами магнитно-резонансной томографии. Важным свойством магнитных наночастиц является возможность осуществлять ихлокальный нагрев высокочастотным магнитным полем для инициации механизма десорбции/декапсулирования лекарств или для проведения магнитной гипертермии. Для адресной доставки лекарств вкачестве магнитного носителя обычно используют суперпарамагнитные частицы, поскольку послевоздействия магнитного поля они не агрегируются, однако при этом происходит снижение мощностимагнитного воздействия, что усложняет перенос и удерживание частиц в непосредственной близости отцелевого объекта, особенно при мощном воздействии кровотока.
Магнитные наночастицы, покрытые биосовместимыми молекулами (декстран, поливиниловый спирт,фосфолипиды), к которым «пришиты» антитела к специфическим антигенам, используются в технологиимагнитного сепарирования. Так, например, магнитные частицы, покрытые иммуноспецифическимиагентами, могут быстро связываться с красными кровяными клетками, бактериями или раковыми клетками.Методика разделения (сепарирования) клеток состоит в добавлении суспензии иммуномодифицированныхмагнитных наночастиц непосредственно к образцу биологической жидкости. После 10-20 минутнойинкубации пробирка с образцом помещается в магнитный сепаратор, где клетки интересующей популяции,связанные с магнитными частицами, улавливаются магнитом, а супернатант удаляется.
Синтетические олигонуклеотиды(праймеры, зонды и др.) широко используются в качестве инструментов молекулярной биологии, геннойинженерии, биотехнологии, а также в молекулярной диагностике в медицине. Существуют природныеполинуклеотиды ДНК и РНК. Они различаются по типу углеводного остатка (дезоксирибозы или рибозы) иструктуре оснований. Синтетические олигонуклеотиды (праймеры, зонды и др.) широко используются вкачестве инструментов молекулярной биологии, генной инженерии и биотехнологии.
В клиническойбиохимии анализ индивидуальных белков и пептидов человека используется для определенияпатологического процесса и природы патологии, а также оценки течения различных физиологическихпроцессов. Идентификация белков микросеквенированием основана на определении (расшифровке) частиаминокислотной последовательности белка. Определение аминокислотной последовательностиолигопептидов позволяет идентифицировать белок по его части. Разработанные методымикросеквенирования позволяют работать с очень малыми количествами олигопептидов - вплоть донанограммов. В настоящее время возможно проведение как прямого N-концевого секвенирования белка,перенесенного на инертную мемебрану, так и секвенирование отдельных пептидов, полученных изизучаемого белка после его ферментативного расщепления. Для этого используют методывысокоэффективной жидкостной хроматографии или LC-ESI-Ion Trap-MS-MS масс-спектрометрии.
микросеквенирование белков, жидкостная хроматография высокого давления(HPLC), масс-спектрометрия, а также использование белковых чипов с различными типами детекции, такихкак SELDI Protein Chip.
Взаимодействие может строиться по типуантиген-антитело, рецептор-лиганд, ДНК-белок, белок-белок, фермент-субстрат или белок-липид. Чипысчитываются путем Surface-Enhanced Laser Desorption/Ionization (лазерная десорбция/ионизация - SELDI) спомощью специального устройства и идентифицируются с помощью времяпролетной масс-спектрометрии.В настоящее время в медицине применение методов протеомного анализа позволяет выявить маркерыкардиоваскулярных и онкологических заболеваний на ранней стадии заболевания (клиническая протеомика).
Гибридизациялежит в основе анализа с помощью ДНК-чипов: аналитические (детектирующие) ДНК-зонды, расположенныена носителе (например, стекле или пластике), гибридизуются со специфическими последовательностяминуклеиновых кислот в исследуемых образцах и таким образом выявляют их.
многофункциональные наночастицы в медицине
наночастицы и их комплексы, способные выполнять несколько медицинских задач, например, служитьдиагностическим контрастным агентом, биосенсором, вектором для направленной доставки лекарств,оказывать терапевтическое воздействие. Разработаны многофункциональные или т.н. динамические наноплатформы (наносомы) и текто-дендримеры, состоящие из соединяемых друг с другом наномодулей, каждый из которых выполняетопределенную функцию. Одни наночастицы могут нести лекарственные вещества, другие – молекулыузнавания и адресной доставки, третьи наноструктуры в составе наносомы могут выполнять рольбиосенсоров (рН, редокс потенциала, мембранного потенциала и др.), четвертые могут быть оснащенынаноантеннами из нанокристаллов золота, вызывающими нагревание наносомы при помещении вэлектромагнитное поле определенной частоты. Применение суперпарамагнитных наночастиц в составенаносом позволяет визуализировать их местонахождение в организме с помощью томографических методов.На основе флуоресцентных технологий созданы наномодули, способные сигнализировать о процессахгибели опухолевых клеток и других результатах наномедицинских воздействий. В зависимости от решаемыхврачом задач наносомы могут собираться из различных функциональных модулей и осуществлятьопределенные виды деятельности в организме, такие как мониторинг внутренней среды, нахождение ивизуализация целевых клеток, доставка лекарств и их контролируемое высвобождение, сообщение орезультатах терапии. Вариантами немодульных многофункциональных наночастиц являютсямодифицированные вирусные капсиды, при сборке которых возможно изменять как состав содержимогокапсида (груз), так и состав поверхностных молекул капсида, определяющих направленную доставку исенсорные функции. Наносомы и другие упомянутые многофункциональные наноустройства можнорассматривать, как отдаленный прообраз нанороботов медицинского назначения.
нанокапсула
наночастица, состоящая из полимерной или липидной оболочки, окружающей ее внутреннюю полость илисодержимое.
Наибольшее применение амфифильные вещества находят в нанобиотехнологиях.
ДНК-чип.
Что такое и откуда взялось?
В последнее время обороты начала набирать такая сфера генетики, как днк-диагностика и диагностика наследственных болезней. Такой «бум» в этой сфере связан с возникновением новых методов распознавания днк последовательности.
Это так называемое секвенирование- расшифровка последовательностей ДНК и их анализ. На данный момент уже существует множество различных способов секвенирование. По началу эти методы были весьма неэффективны. Они требовали большого количества времени и сами по себе были очень дорогостоящи, но технологии не стоят на месте и в этом случае. Чем дальше все это заходит, тем проще и эффективней становится процесс.
Одним из таких облегчений стало создание ДНК-микрочипов. Впервые набор различных ДНК, объединённых в чип, был использован в 1987 году для определения особенностей регуляции экспрессии генов интерферонами[1]. Ранние ДНК-микрочипы были сделаны путём «раскапывания» микроколичеств кДНК на фильтровальную бумагу. Использование миниатюрных чипов для определения особенностей экспрессии генов было осуществлено в 1995 году[2] и полный эукариотический геном (Saccharomyces cerevisiae) был размещён на микрочипе в 1997 году.
Появление во 2-й половине 90-х годов ДНК-чипов стало новой биотехнологической революцией, стоящей по значимости в одном ряду с расшифровкой структуры ДНК в 50-х, исследованием фундаментальных закономерностей молекулярной генетики, таких как генетический код и основная догма молекулярной биологии в 60-х, открытием обратной транскрипции и созданием первых рекомбинантных конструкций в 70-х, разработкой энзимологических методов манипуляций с генетическим материалом in vitro таких как амплификационные технологии в 80-х.
Теоретическая основа создания ДНК-чипов проста и очевидна. Она базируется на принципе комплементарной гибридизации одно-цепочечных полинуклеотидных цепей, являющихся фундаментом современных представлений о вторичной двух-цепочечной структуре ДНК.
Но для практической реализации этого элементарного принципа потребовалось объединить самые последние достижения таких наиболее прогрессивных направлений современной науки как молекулярная генетика, нанотехнология, информатика и полупроводниковая индустрия.
Современный ДНК-микрочип состоит из тысяч дезоксиолигонуклеотидов (зондов, или проб), сгруппированных в виде микроскопических точек и закреплённых на твёрдой подложке. Каждая точка содержит несколько пикомолей ДНК с определённой нуклеотидной последовательностью. Олигонуклеотиды ДНК-микрочипа могут быть короткими участками генов или других функциональных элементов ДНК и используются для гибридизации с кДНК или мРНК (кРНК). Гибридизация зонда и мишени регистрируется и количественно характеризуется при помощи флюоресценции или хемилюминесценции, что позволяет определять относительное количество нуклеиновой кислоты с заданной последовательностью в образце. В обычном ДНК-микрочипе зонды ковалентно прикрепляются к твёрдой поверхности — стеклянному или кремниевому чипу. Другие платформы, например, выпускаемые Illumina, используют микроскопические шарики вместо больших твёрдых поверхностей. ДНК-микрочипы используют для анализа изменения экспрессии генов, выявления однонуклеотидных полиморфизмов, генотипирования или повторного секвенирования мутантных геномов. Микрочипы отличаются по конструкции, особенностям работы, точности, эффективности и стоимости.
существуют два основных направления создания ДНК-чипов. Исторически первыми были методы размещения на чипах предварительно химически синтезированных олигонуклеотидов или полученных с помощью ПЦР одно-цепочечных фрагментов ДНК. Эти методы просты в использовании, необходимое оборудование доступно и относительно дешево. Самым главным преимуществом является высокая гибкость этих методов, позволяющая создать чип с любыми требующимися последовательностями, но этот подход имеет труднопреодолимые недостатки, сильно ограничивающие его использование. Прежде всего, это огромные затраты труда, времени и средств на синтез требуемого количества различных олигонуклеотидов или ДНК. Плотность размещения ДНК на таких чипах не может превышать десятков тысяч на 1 см2.
Другим более перспективным направлением является применение разработанных для нужд микроэлектроники литографических технологий с использованием ультрафиолетового излучения. Такая технология позволяет синтезировать олигонуклеотиды непосредственно на поверхности чипа. При этом плотность их составляет несколько миллионов на 1 см2. Недостатком этой технологии является необходимость литографических масок, что ограничивает возможность синтеза этих чипов рамками крупных фирм.
Последним достижением в данной области стала разработка в 1999 году технологии позволяющей обойтись без литографических масок. Это делает синтез чипов с плотностью олигонуклеотидов любой заданной последовательности превышающей 1 000 000 на 1 см2 доступным любой лаборатории.
Готовый чип гибридизируется с меченным различными способами ДНК-субстратом, представляющим собой обычно к-ДНК, синтезированную с помощью обратной транскрипции с м-РНК изучаемых тканей. Далее производится детекция меченных нуклеотидов с помощью специальных устройств, при этом строится паттерн гибридизации, учитывающий те олигонуклеотиды или ДНК фрагменты, с которыми гибридизировалась меченая ДНК и интенсивность сигнала, отражающую количество меченых молекул в данной ячейке чипа. Таким образом, можно получить информацию о последовательности исследуемых ДНК (так как каждой определенной последовательности исследуемой ДНК соответствует известная последовательность иммобилизованной на чипе ДНК) и о количестве каждой исследуемой последовательности.
Благодаря своим особенностям технология ДНК-чипов находит все более широкое применение в фундаментальных и прикладных исследованиях. Главной отличительной чертой этой технологии является возможность одновременного анализа огромного количества различных ДНК-последовательностей. Появилась ранее недоступная возможность изучать геном как целое. Это новое направление получило название "геномика". Применение ДНК-чипов позволяет количественно определить уровень экспрессии всех генов любого генома. Особенно важным является установление функциональной роли генов - функциональная геномика. Установление функций генов позволяет разработать методы этиологической диагностики патологических состояний, например злокачественного роста и способы управления функцией генов, которые ответственны за их развитие, в том числе и с помощью такого наиболее перспективного метода как генная терапия.
Благодаря появлению ДНК-чипов появилась возможность производить анализ мутаций во всех генах генома одновременно. Так для анализа всех возможных мутаций во всех генах человека достаточно ДНК-чипа с количеством ячеек равным 100-200 млн., что технически достижимо. ДНК-чипы позволяют производить одновременный анализ огромного количества полиморфных маркеров, что открывает новые перспективы для исследований в области молекулярно-генетической эволюции и позиционных геномных исследований (установление связи положения полиморфных маркеров с функцией соседних генов).
Стремительное
развитие ДНК-чип технологии и ее
уникальные возможности, особенно
появление в самое последнее время
принципиально новых доступных для
широкого использования подходов в
области синтеза чипов, манипуляций с
субстратом и детекции результатов
делает ДНК-чип технологии чрезвычайно
привлекательным для ее внедрения в
широкую клиническую практику. Такая
перспектива резкого расширения рынка
ДНК-чип технологий приведет к появлению
новой очень перспективной сферы
высокотехнологического бизнеса при
этом компании, сумевшие благодаря
быстрому внедрению новых высокоэффективных
технологий занять доминирующее положение
на этом огромном рынке, могут стать
такими же гигантами как Intel и Microsoft.


органические флуоресцентные молекулы
Флуоресценция нашла широкое применение в различных прикладных биологических и биомедицинских исследованиях[1]. Это физическое явление, суть которого заключается в кратковременном поглощении кванта света флюорофором (веществом, способным флуоресцировать) с последующей быстрой эмиссией другого кванта, который имеет свойства, отличные от исходного[2]. Много направлений в биофизике, молекулярной и клеточной биологии возникли и развиваются именно благодаря внедрению новых методов, базирующихся на флуоресценции.
Метод
секвенирования ДНК благодаря работам
Сэнгера был значительно усовершенствован
во второй половине 1980-х годов именно
благодаря внедрению флуоресцентной
детекции. Метод секвенирования с
дидезокситерминаторами был существенно
усовершенствован, когда радиоактивное
мечение праймера было заменено на
флуоресцентное мечение терминальных
нуклеотидов. На рисунке показана
структура дидезоксинуклеозид-трифосфатов,
которые содержат флуоресцентные
красители, привязанные ковалентными
связями к азотистым основаниям. Было
обнаружено, что такие модификации
азотистых оснований минимально влияют
на распознавание трифосфатов
ДНК-полимеразами, поэтому они могут
встраиваться в синтезированную ДНК
наряду с обычными дНТФ. В случае с
флуоресцентными дидезокситерминаторами
при терминации синтеза ДНК происходит
её флуоресцентное мечение. Использование
флуоресцентных красителей четырёх
цветов для кодирования каждого из
природных нуклеозидов позволило
проводить синтез в одной пробирке и
разделение на одной дорожке геля. Более
того, флуоресцентная детекция оказалась
более чувствительной и быстрой по
сравнению с радиоактивной, позволяя.проводить
определение нуклеотидов в реальном
времени.

Важным следствием этого стала высокая скорость и надёжность секвенирования. Кроме того, метод был автоматизирован. Это открыло техническую возможность проведения широкомасштабного (по масштабам того времени) секвенирования и позволило начать проект «Геном человека» в начале 1990-х годов. Хотя секвенирование по Сэнгеру почти полностью вышло из использования, флуоресценция продолжает использоваться в методах секвенирования ДНК следующих поколений.
Флуоресценция дала новый толчок развитию клеточной биологии. Благодаря конфокальной флуоресцентной микроскопии и разработке новых флуоресцентных меток на базе зелёного флуоресцентного белка (ЗФБ) и его аналогов появилась возможность получать специфически контрастную окраску и делать фотоснимки с высоким разрешением многих внутриклеточных белковых структур. Разработка новых флуоресцентных зондов — веществ, изменяющих флуоресценцию, когда к ним присоединяется определённая молекула — дала возможность детально исследовать химический состав живых клеток и даже организмов, а также его изменение во времени и пространстве, что положило начало флуоресцентному молекулярному имиджингу (англ. molecular imaging).
В результате в конце 1980-х удалось разработать автоматические системы для секвенирования ДНК с разделением терминированных фрагментов в капиллярном варианте гель-электрофореза и с детекцией каждой «буквы» в последовательности по её специфическому цвету флуоресценции.
Хитозан
Хитозан- аминосахар, макромолекулы состоят из случайно-связанных β-(1-4) D-глюкозаминовых звеньев и N-ацетил-dглюкозамин.
Хитозан добывают из панцирей ракообразных и из низших грибов путем удаления ацила, который придает жесткость хитину. Впервые он был получен в 1859 году профессором С. Роже.
Хитозан обладает невероятными свойствами, начиная с того, что он используется в различных БАДах для похудания и отчистки организма, заканчивая его перспективностью для нанотехнологий.
Хитозан можно назвать “второй кожей” после одного случая. Известно, что при ожогах 70% кожи и более у человека почти нет шансов выжить, но известен случай, когда у мальчика в Японии был ожог 80% кожи и медики применили искусственную кожу из хитозана. После нескольких месяцев лечения кожа мальчика восстановилась и стала такой же, как была. При этом от ожогов не осталось и следа.
Что же это за искусственная кожа? Ученые называют так хитозанноноволокна. Они приготовленны из нанонитей в 200 раз тоньше человеческого волоса, при этом обладают способностью заживлять раны и ожоги. По мимо этого изветсно, что хитозан облодает антимикробной активностью, позже стало выяснено, что он убивает до 99% микробов, способностью поглащать биологические жидкости и помогать регенерации тканей. Искуственная кожа не вызывала реакций отторжения организмом, легко срасталась с телом, так как по своему составу близка к человеческому организму.
