
ГЕМАТОЛОГИЧЕСКИЕ АСПЕКТЫ ЗАБОЛЕВАНИЙ ПЕЧЕНИ
.pdfГЕМАТОЛОГИЧЕСКИЕ АСПЕКТЫ ЗАБОЛЕВАНИЙ ПЕЧЕНИ
Общая характеристика
Печёночно-клеточная недостаточность, портальная гипертензия и желтуха могут вызывать изменения картины крови. Хронические заболевания печени обычно сопровождаются гиперспленизмом. Часто выявляют уменьшение продолжительности жизни эритроцитов. Кроме того, поражение печёночной паренхимы и холестатическая желтуха могут вызывать нарушение свёртывания крови. Усугублению этих изменений способствуют неполноценное питание, алкоголизм, кровотечение и нарушения синтеза белков в печени.
Спонтанные кровотечения, наличие синяков и пурпуры в сочетании с анамнестическими указаниями на кровоточивость после минимальной травмы (например, венопункции) у больных с заболеваниями печени являются более важным свидетельством гипокоагуляции, чем лабораторные показатели.
Объём крови
У больных циррозом печени, особенно при наличии асцита, а также при длительной обструктивной желтухе или гепатите, часто увеличен объём плазмы. Эта гиперволемия может частично, а иногда и полностью объяснить снижение концентрации гемоглобина или содержания эритроцитов в крови. Общее количество циркулирующего гемоглобина уменьшено лишь у половины больных.
Изменения эритроцитов
Эритроциты могут быть гипохромными, что часто является следствием желудочнокишечных кровотечений, приводящих к дефициту железа. При портальной гипертензии анемия развивается вслед за желудочно-пищеводным кровотечением и становится ещё более выраженной при наличии тромбоцитопении и нарушений свёртывания крови. При холестазе или алкогольном циррозе кровотечение может быть следствием язвы или гастрита. Носовое кровотечение, синяки и кровоточивость дёсен усугубляют тяжесть анемии.
Обычно эритроциты нормохромные, что является следствием сочетания микроцитоза на фоне хронической кровопотери и макроцитоза, свойственного больным с заболеваниями печени. Изменение содержания в мембране эритроцитов холестерина и фосфолипидов и их соотношения проявляется различными морфологическими отклонениями, включая появление тонких макроцитов и мишеневидных клеток.
Тонкие макроциты — частая находка, сочетающаяся с макронормобластным характером костномозгового кроветворения. Они исчезают по мере улучшения функции печени.
Мишеневидные клетки, также являющиеся тонкими макроцитами, обнаруживаются при печеночно-клеточной и холестатической желтухе. Они представляют собой плоские макроциты с увеличенной площадью поверхности и повышенной осмотической резистентностью. Особенно часто они обнаруживаются при холестазе, когда повышение концентрации жёлчных кислот может подавлять активность фермента лецитинхолестеринацилтрансферазы (ЛХАТ) [10]. Активность Л

ХАТ в мембране эритроцита снижается, обусловливая повышение в ней содержания холестерина и лецитина. Текучесть мемб раны при этом не меняется.
Шпоровидными клетками называются клетки с необычными вы ростами в виде шипов. Их также называют акантоцитами (рис. 4-1). Они встречаются при дале ко зашедших поражениях печени, обычно у больных алкоголизмом, у которых также выявляются тяжёлая анемия и гемолиз [13, 14]. Появление таких к леток рассматривается как неблагоприятный прогностический признак. Механизм их образования неясен; однако, возможно, они образуются из эхиноцитов [22]. Эти отростчатые клетки обычно не видны при просмотре высушенных мазко в крови, а выявляются при исследовании влажных препаратов или сканирующей электронной микроскопии у многих больных с заболеваниями печени. Они образуются вследствие взаимодействия с аномальными липопротеинами высокой плотности, которые встречаются при за болеваниях печени [22]. Избыточное накопление неэтерифицированного холестерина по срав нению с фосфолипидами приводит к снижению текучести клеточной мембраны и образовани ю шиловидных выростов. Ретикулоэндотелиальные клетки селезёнки модифицируют эти ри гидные клетки, удаляя мембрану.
Толстые макроцит ы, встречающиеся у больных алкоголизмом , вероятно, образуются в результате токсического влияния алкоголя на костный мозг. Дефицит витамина В12 и фолиевой кислоты также может вызва ть макроцитоз.
Рис. 4-1. Сканирующ ая электронная микрофотограмма патологических форм эритроцитов больного с алкогольным гепатитом, на ко торой представлены эхиноциты (Е) на разных стадиях развития и акантоцит
(А).
Эритроцитоз мож ет осложнять течение гепатоцеллюлярной карциномы вследствие продукции эритропоэтина о пухолевыми клетками [30].
Костный мозг при хронической печёночно-клеточной н едостаточности является гиперпластическим и макр онормобластическим. Несмотря на это, ко личество циркулирующих эритроцитов уменьшено, что свидетельствует о неспособности ко стного мозга полностью компенсировать анемию {относительная недостаточность костного мозга).
Метаболизм фолатов и витамина В12
Печень накапливает фолаты и переводит их в активную депонирующуюся форму — тетрагидрофолат [9]. Хронические заболевания печени могут сопровождаться дефицитом фолатов, что часто встречается у больных алкоголизмом. Это в основном обусловлено алиментарным дефицитом. Уровень фолатов в сыворотке низкий. Целесообразна терапия препаратами фолиевой кислоты. Печень накапливает также витамин В12, запасы которого в печёночной ткани снижены при её поражении. Некроз гепатоцитов приводит к высвобождению витамина В12 в кровь и повышению его концентрации в сыворотке. Это наблюдается при гепатите, активном циррозе и первичном раке печени. При холестатической желтухе выявляются нормальные показатели обмена фолатов и витамина В12.
Мегалобластная анемия редко встречается при хронических заболеваниях печени, и потребность в терапии витамином В12 низка.
Продолжительность жизни эритроцитов и гемолитическая анемия
При печёночно-клеточной недостаточности и желтухе всех типов почти всегда усилен распад эритроцитов [27], о чём свидетельствуют полихромазия эритроцитов и ретикулоцитоз.
Механизм этого процесса чрезвычайно сложный. Главным фактором является гиперспленизм, приводящий к разрушению эритроцитов в селезёнке. Кроме того, в шпоровидных клетках имеются дефекты мембраны, в частности снижение текучести, что в комплексе с нарушением архитектоники усиливает распад клеток в селезёнке. Однако в некоторых случаях селезёнка не является местом распада эритроцитов и спленэктомия или лечение кортикостероидами дают незначительный эффект [27].
Гемолиз может встречаться при болезни Вильсона (см. главу 22). И этот диагноз является наиболее вероятным у молодых больных с гемолизом и нарушением функции печени.
У больных с алкогольным гепатитом и сопутствующей гиперхолестеринемией может развиться острый гемолиз (синдром Зиве) [39].
Редко при хроническом гепатите, первичном билиарном циррозе и первичном склерозирующем холангите наблюдается аутоиммунная гемолитическая анемия с положительной реакцией Кумбса [7]. Гемолитическая анемия может также развиться после трансплантации печени вследствие попадания лимфоцитов хозяина в несовместимый трансплантат [11] или отсроченной трансфузионной реакции.
Апластическая анемия редко осложняет течение острого вирусного гепатита (обычно типа ни А ни В ни С) |28|. Прогноз заболевания неблагоприятный, требуется проведение трансплантации костного мозга |37|. Апластическая анемия может развиться после трансплантации печени по поводу фульминантного гепатита ни А ни В.
Сыворотка, содержащая HBV, подавляет активность нормальных клеток костного мозга человека [38|.
Изменения лейкоцитов и тромбоцитов
У больных циррозом печени часто обнаруживаются лейкопения и тромбоцитопения, обычно в сочетании с незначительной анемией {гиперспленизм).
Лейкоциты
Отмечается лейкопения в пределах 1,5—3,0•109/л, в основном уменьшается количество полиморфноядерных клеток. Иногда лейкопения бывает более выраженной.
Холангит, фульминантный гепатит, алкогольный гепатит, абсцесс печени и онкологические заболевания сопровождаются лейкоцитозом. Последний также наблюдается при внепеченочных опухолях, вырабатывающих колониестимулирующий фактор, что может сочетаться с поражением печени |32|. При вирусных инфекциях, например при инфекционном мононуклеозе и вирусном гепатите, в периферической крови выявляются атипичные лимфоциты.
Тромбоциты
При всех формах заболеваний печени наблюдаются сходные отклонения в количестве, структуре и функции тромбоцитов.
Убольных с портальной гипертензией тромбоцитопения, редко тяжёлая, является следствием усиления секвестрации клеток в селезёнке. Это вызвано значительным повышением селезёночного пула тромбоцитов. Разрушение тромбоцитов при этом минимальное. Т1/2 тромбоцитов остаётся в пределах нормы, объём их уменьшается [15]. Аналогичные гематологические изменения встречаются при тромбозе портальной вены и других заболеваниях, сопровождающихся спленомегалией.
Участи больных может отмечаться повышенное разрушение тромбоцитов. Антитромбоцитарные IgG выявляются при хроническом вирусном гепатите, в частности при гепатите С (в 88% случаев) и гепатите В (в 47% случаев) [21]. Количество антител коррелирует со степенью тромбоцитопении.
Убольных циррозом печени, в частности группы С по Чайлду, нарушена функция тромбоцитов, особенно агрегация. При этом происходит нарушение потребления арахидоновой кислоты, необходимой для синтеза простагландинов [231, а также снижение содержания в тромбоцитах АТФ и 5-гидрокситриптамина |17|.
Нарушение агрегации тромбоцитов вследствие диссеминированного внутрисосудистого свёртывания может играть важную роль в патогенезе тяжёлой печёночной недостаточности.
Снижение образования тромбоцитов костным мозгом может быть обусловлено избыточным употреблением алкоголя, дефицитом фолиевой кислоты и вирусным гепатитом.
Тромбоцитопения (обычно в пределах 60,0—90,0•109/л) при хронических заболеваниях печени встречается чрезвычайно часто и в основном обусловлена гиперспленизмом. Она проявляется клинически очень редко. Если состояние больного от лейкопении и тромбоцитопении не страдает, селезёнку не следует удалять; для принятия решения о спленэктомии факт наличия уменьшенного количества тромбоцитов и лейкоцитов сам по себе недостаточен. Если функция циркулирующих, хотя и в недостаточном количестве, лейкоцитов и тромбоцитов не нарушена в отличие от таковой у больных лейкозом, то спленэктомия противопоказана. Послеоперационная смертность больных с заболеваниями печени высокая. Сама операция может осложниться тромбозом воротной и селезёночной вен. А это в свою очередь требует проведения последующих оперативных вмешательств на воротной вене, которые могут осложнить осуществление трансплантации печени.
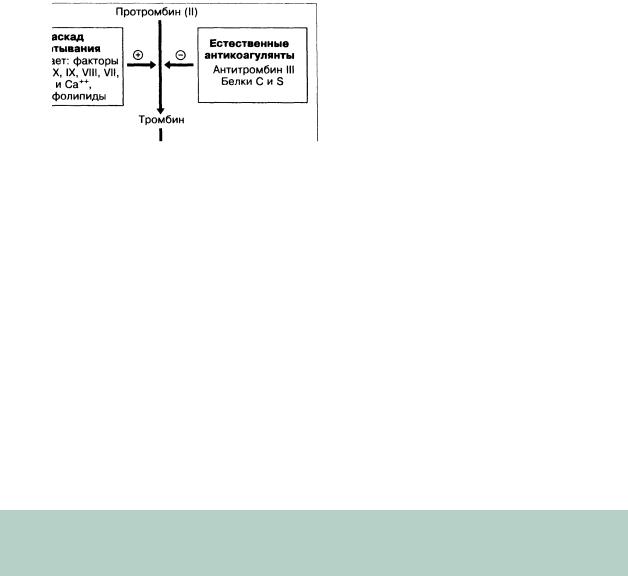
Печень и свёрт ывающая система крови
[20, 25. 36]
Механизмы наруше ний свёртывания крови при болезнях печени и жёлчных путей очень сложны. Это является следс твием изменений пути как образования фиб рина, так и его распада — фибринолиза (рис. 4-2, табл . 4-1). Об изменениях количества и функций тромбоцитов говорилось в предыдущем разделе. Конечным результатом этих нарушений, несмот ря на всю их сложность, становится гипокоагуляция, что требует терапевтического вмешательст ва в случае кровотечения или при планировании про ведения какой-либо процедуры, чреватой кро вотечением.
Гепатоцит является основным местом синтеза всех белков свё ртывающей системы, за исключением фактора Ви ллебранда и фактора VIII С. К этим белкам относятся витамин К- зависимые факторы II, VII, I X и X, а также лабильный фактор V, фактор VIII, контактные факторы XI и XII, фибриноген и фибрин стабилизирующий фактор XIII. Т1/2 всех пере численных выше белков системы свёртывания очен ь короткий. Отсюда следует, что острый н екроз печёночных клеток может быстро привести к снижению уровня этих белков. Наиболее заме тно падает концентрация фактора VII, ^ которого составляет 100-300 мин.
Рис. 4-2. Нормальные пути свёртывания крови (а) и фибринолиза (б). При заболеваниях печени могут поражаться практически все этапы этого процесса. ИАП — ингибитор акти ватора плазминогена; АП — антиплазмин.
Таблица 4-1. Вли яние заболеваний печени на гемостаз

Снижение синтеза факторов свёртывания: нарушение функции печени недостаточность/нарушение всасывания витамина К
Снижение синтеза ингибиторов свёртывания: образование аномальных/ неполноценных белков повышение фибринолитической активности уменьшение выведения активаторов фибринолиза уменьшение образования ингибиторов фибринолиза уменьшение выведения печенью активированных факторов свёртывания
Диссеминированное внутрисосудистое свёртывание: многофакторное, в том числе эндотоксемия нарушения тромбоцитарного звена гемостаза уменьшение количества тромбоцитов нарушение функции тромбоцитов
Витамин К — жирорастворимый витамин, вырабатываемый кишечными бактериями. Наиболее частой причиной его недостаточности является внутри- и внепеченочный холестаз, однако снижение его концентрации может быть также обусловлено лечением хелаторами жёлчных кислот (холестирамин) или перорально применяемыми антибиотиками. Витамин К- зависимые белки синтезируются в зернистой эндоплазматической сети. На своём азотистом конце они содержат несколько остатков глутаминовой кислоты, которые должны после этапа синтеза на рибосомах с участием фермента карбоксилазы трансформироваться в γ-карбоксиглутаминовую кислоту. Для функционирования карбоксилазы необходим витамин К [12]. Функция белков свёртывания зависит от этой конверсии. При холестазе парентеральная заместительная терапия витамином К быстро (в течение 24—48 ч) восстанавливает до нормы протромбиновое время и используется в диагностических целях. Если коагулопатия является следствием болезни печени, протромбиновое время может улучшиться, но не нормализуется.
Ингибиторы, влияющие на каскад свёртывания, также синтезируются печенью. К ним относятся антитромбин III, белки С и S и кофактор II гепарина. Белки С и S являются витамин К- зависимыми. При фульминантной печёночной недостаточности [18] и циррозе печени [2] количество этих ингибиторов уменьшено, однако их недостаточность не приводит к тромбозам, возможно, вследствие других изменений в системе свёртывания крови. При гомозиготной недостаточности белка С прибегают к трансплантации печени [8].
Болезни печени могут сопровождаться образованием структурно и функционально
неполноценных белков и факторов свёртывания. Особенно часто при циррозе, хроническом гепатите и острой печёночной недостаточности обнаруживается дисфибриногенемия. Фибриноген может содержать избыток остатков сиаловой кислоты. Считается, что последние приводят к нарушению полимеризации фибриновых мономеров. Может также выявляться фибриноген с низкой молекулярной массой. Аномалии фибриногена у многих больных с заболеваниями печени вызывают увеличение протромбинового времени (ПВ). Это увеличение можно заподозрить при повышении частичного тромбопластинового времени (ЧТВ) в сочетании с нормальным содержанием фибриногена и при отсутствии нарастания продуктов его распада.
У больных с заболеваниями печени обнаруживается усиление фибринолитической активности. В 1914 г. Гудпасчер впервые описал ускоренный лизис сгустка крови у больных циррозом печени. Гепатоциты синтезируют плазминоген и ингибиторы плазмина, такие как α2- антиплазмин и ингибиторы тканевого активатора плазминогена (ТАП-1). У больных циррозом печени отмечается уменьшение количества антигена ингибитора ТАП-1 даже без признаков активации свёртывания (повышение отношения фибрин/продукты распада фибриногена; D- димеров) [35]. Считается, что повышение активности ТАП-1, относительно активности ингибитора ТАП-1 и α2-антиплазмина ведёт к повышению фибринолиза [19]. Больные с тяжёлым
заболеванием печени и признаками гиперфибринолиза имеют более высокий риск кровотечения [34].
Вопрос о диссеминированном внутрисосудистом свёртывании крови (ДВС-синдром) у
больных с циррозом печени, хроническим гепатитом и острым гепатитом был предметом дискуссий.
При заболеваниях печени могут быть комплексные изменения со стороны белков свёртывания, ингибиторов и фрагментов белков, обычно сочетающихся с ДВС-синдромом. Результаты исследования тромбин-антитромбиновых комплексов, растворимого фибрина, продуктов деградации фибрина и фибриногена (D-димер, D-мономер) позволяют предположить, что ДВС-синдром лёгкой степени участвует в патогенезе коагулопатии у некоторых больных с тяжёлыми заболеваниями печени [1, 16, 24]. К стимулирующим его механизмам относятся нарушение выведения активированных факторов свёртывания и эндотоксемия [33].
Независимо от исходного состояния у больных циррозом печени, однако имеется больший риск развития развёрнутого ДВС-синдрома по сравнению с больными с нормальной функцией печени, особенно при наличии сепсиса и артериальной гипотензии [6].
Асцитическая жидкость содержит мономеры фибрина, продукты его распада и небольшое количество фибриногена, что указывает на активный внутрибрюшинный процесс свёртывания. Фибринолиз, вызванный введением активаторов плазминогена, обусловливает коагулопатию [31], которая осложняет внутривенную инфузию асцитической жидкости, как при шунтировании по Левину.
Цирроз печени может также осложняться тромбозами. Предстоит выяснить взаимосвязь между антифосфолипидными антителами (волчаночный антикоагулянт, антикардиолипиновые антитела) у больных циррозом печени [29], снижением уровня естественных антикоагулянтов (антитромбин III, белки С и S) и тромботическими осложнениями.
Исследование свёртывания крови
Наиболее адекватный тест, выявляющий нарушение свёртывания крови у больных с поражением печени и жёлчных путей, — исследование ПВ до и после внутримышечного введения 10 мг витамина К. Этот тест является также наиболее достоверным показателем: он имеет прогностическое значение и позволяет судить о наличии печёночно-клеточного некроза. Иногда определяют ЧТВ, которое является более чувствительным показателем, чем ПВ. Его удлинение указывает на дефицит не только протромбинового комплекса, но и факторов XI и XII.
Необходимость исследования отдельных факторов свёртывания возникает редко, хотя уровень фактора V является прогностическим критерием у больных с фульминантной печёночной недостаточностью. Так, у больных с печёночной недостаточностью, вызванной интоксикацией парацетамолом, падение уровня фактора V ниже 10% при поступлении свидетельствует о плохом прогнозе [26]. Соотношение факторов VIII (содержание его повышено при заболевании печени) и V при поступлении также представляет клиническую ценность.
Исследуют также количество тромбоцитов. Определение времени кровотечения позволяет оценить роль количества и функции тромбоцитов в поддержании гемостаза.
Фибринолиз и ДВС-синдром диагностируют на основании значительного увеличения ПВ, снижения уровня фибриногена ниже 1 г/л, увеличения количества продуктов деградации фибриногена более 100 мкг/л и тромбоцитопении менее 100•109/л.
Лечение нарушений свёртывания крови
Всем больным с увеличенным ПВ необходимо назначать витамин К,. Обычный курс включает внутримышечные инъекции витамина К, по 10 мг/сут в течение 3 дней. Эффект наступает примерно через 3 ч: происходит устранение гипопротромбинемии, связанной с нарушением всасывания витамина К вследствие дефицита жёлчных кислот. Нарушения, обусловленные преимущественно поражением гепатоцитов, не устраняются назначением витамина К,. Тем не менее даже у больных с преимущественно печёночно-клеточной желтухой может быть недостаточная секреция жёлчных кислот и введение витамина К, часто уменьшает ПВ на несколько секунд. Увеличение ПВ более чем на 3 с (международное нормированное отношение — MHO 1.2) после внутримышечного введения витамина К, является противопоказанием к проведению таких вмешательств, как биопсия печени, спленопортография, чрескожная холангиография или лапаротомия. Если эти процедуры необходимы, нарушение свёртывания можно уменьшить введением свежезамороженной плазмы, которая эффективна в течение нескольких часов (табл. 4-2). Однако даже у больных с показателями П В и количества тромбоцитов, приемлемыми для проведения инвазивных процедур (ПВ менее 17 с и количество тромбоцитов более 30•109/л), может отмечаться увеличение времени кровотечения [3]. Анализ методом множественной линейной регрессии показывает, что время кровотечения независимо коррелирует с уровнем сывороточного билирубина в сыворотке и количеством тромбоцитов.
В целом если у больных с заболеванием печени нет кровотечения, то, за исключением терапии витамином К,, необходимость в других мероприятиях по восстановлению нормальной функции свёртывающей системы отсутствует. Трансфузия консервированной крови позволяет восполнить недостаток протромбина, факторов VII, VIII и X. Свежая кровь также служит источником фактора V и тромбоцитов. Свежезамороженная плазма — богатый источник факторов свёртывания, особенно фактора V.
Десмопрессин, аналог вазопрессина, вызывает непродолжительное уменьшение времени кровотечения и ЧТВ ( но не ПВ) наряду с повышением уровня фактора VIII и фактора Виллебранда. Инфузии десмопрессина могут быть эффективны для остановки кровотечения у больных с хроническими заболеваниями печени [5J.
Лечение ДВС-синдрома осуществляют путём устранения факторов, запускающих его развитие, таких как инфекция, шок и дегидратация. Чаще используют свежую кровь, однако, если её нет, переливают эритроцитную массу и свежезамороженную плазму. Течение ДВС-синдрома обычно нетяжёлое, и необходимость в терапии гепарином, как правило, не возникает.
При тромбоцитопении используют концентраты плазмы, богатые тромбоцитами. Их инфузии можно проводить с целью «прикрытия» процедур, например трансъюгулярной биопсии печени у больного с тяжёлой тромбоцитопенией.
Трансплантация печени
Предоперационные нарушения свёртывания крови являются следствием поражения печени. Эти нарушения, а также операционная кровопотеря служат основанием для проведения заместительной терапии 20 дозами эритроцитной массы и 15 дозами тромбоцитов. Прогноз зависит от количества переливаемой крови и её компонентов [41. Во время хирургического вмешательства активируются процессы свёртывания и фибринолиза. На беспечёночном этапе операции отмечается сниженное выведение активированных белков и ингибиторов. Послеоперационные показатели свёртывания крови зависят от состояния трансплантированной донорской

печени. Если функция донорского органа оказалась скомпрометированной, после реваскуляризации может развиться выраженная дефибринация с последующим неконтролируемым кровотечением.
Таблица 4-2. Стандартная подготовка больного к инвазивным вмешательствам, включая операцию
Исследование |
Определение ПВ Определение ЧТВ Определение количества тромбоцитов |
|
|
|
|
Рекомендации |
Полное воздержание от приёма алкогольных напитков не менее чем в течение недели |
|
до вмешательства Внутримышечные инъекции витамина К по 10 мг |
||
|
При необходимости Переливание свежезамороженной плазмы Переливание тромбоцитной масы
Гемолитическая желтуха
При гемолитической желтухе высвобождается значительное количество гемоглобина, которое может достигать 45 г/сут при норме 6,25 г/сут. Соответственно отмечается нарастание уровня билирубина в сыворотке, 85% которого составляет неконъюгированная фракция. Повышение уровня конъюгированного билирубина происходит, возможно, вследствие задержки его выведения.
Даже при максимальной выработке жёлчного пигмента (1500 мг/сут, что в 6 раз превышает норму) уровень билирубина в сыворотке повышается лишь до 35—50 мкмоль/л (2—3 мг%). Это обусловлено способностью печени связывать большие количества пигмента. Если у больных с гемолитической желтухой уровень билирубина превышает 70— 85 мкмоль/л, то возможно наличие дополнительного фактора (печёночно-клеточная дисфункция или почечная недостаточность). Следует учесть, что анемия сама по себе подавляет функцию печени.
Неконъюгированный билирубин не растворяется в воде и не выделяется с мочой. Даже при повышении уровня конъюгированного билирубина в сыворотке при гемолизе с помощью чувствительных тестов в моче можно обнаружить лишь небольшие количества билирубина.
Существенно возрастает экскреция жёлчных пигментов, и в кале обнаруживаются большие количества стеркобилиногена. Каждый миллиграмм стеркобилиногена соответствует распаду 24 мг гемоглобина. Этот показатель является лишь приблизительным, так как значительная часть пигмента гема в фекалиях происходит не из гемоглобина зрелых эритроцитов, а из других источников.
ПАТОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
Распад гемоглобина сопровождается высвобождением железа, в связи с чем большинство типов гемолитической анемии сопровождается тканевым сидерозом.
Печень имеет нормальные размеры и красно-коричневую окраску вследствие повышенного отложения железа. Гистологическое исследование выявляет гранулы железа в клетках Купффера, крупных макрофагах портальных трактов и в меньшей степени в паренхиме печени (рис. 4-3).

При тяжёлой анем ии отмечаются центрозональное расширение синусоидов и жировые изменения. Локальные очаги некроза гепатоцитов связаны с обструкцией сосудов, впадающих в синусоиды, лизирующимися повреждёнными клетками или с непосредственным влиянием гемолиза на печёночные клетки. Клетки Купффера обычно набухш ие, изредка встречаются гиперпластические очаги эр итропоэза. Жёлчный пузырь и жёлчные пути содержат тёмную вязкую жёлчь. У половины или двух третей больных обнаруживаются пигм ентные конкременты из билирубината кальция. Вторичный холецистит может осложниться обра зованием множественных фасетчатых, смешанных по составу жёлчных камней.
Селезёнка увеличена, мягкой консистенции и забита эритроцитам и. В красном костном мозге отмечаются гиперпластические измене ния.
КЛИНИЧЕСКИЕ ОСОБЕННОСТИ
Картина заболевания зависит от этиологии, но определённые симптомы и признаки характерны для всех форм г емолиза.
Выраженность анемии зависит от соотношения скорости распада и образования эритроцитов. Она быстро нарастает при кризах, когда у больного отм ечаются боли в животе и конечностях, лихорадка, головная боль, а иногда даже падение артериального давления и коллапс.
Желтуха обычно сл або выражена, кожа имеет лимонно-жёлтый оттенок. Желтуха быстро усиливается при гемолитич еских кризах или при наличии сопутствующ его нарушения экскреции жёлчи, например при вирус ном гепатите, холедохолитиазе или почечной недостаточности.
Пигментные жёлч ные камни могут сопровождаться признаками хронического холецистита.
Рис. 4-3. Гемолитиче ская желтуха. Архитектоника печени не наруше на. В гепатоцитах, клетках Купффера и особенно в крупных макрофагах портальных трактов (П) видно увел иченное количество железа. Окраска ферроцианидом, х90.
