
Язвенные кровотечения
.pdf
ГАСТРОЭНТЕРОЛОГИЯ
Лечение острого язвенного кровотечения
I.M. Gralnek 1, A.N. Barkun2, M. Bardou3
1 Кампус Рамбама, Израиль
2 Университет Монреаля, Канада
3 Клинический центр Университета дю Бокаж, Франция
строе кровотечение из верхних отделов желудоч- Оно–кишечного тракта (ЖКТ), определяемое как кро-
вотечение, источник которого располагается проксимальнее связки Трейтца, является частым и клинически важным состоянием, оказывающим существенное
влияние на расходы здравоохранения во всех странах мира. Среди негативных последствий этого явления следует назвать повторное кровотечение и смерть, которая во многих случаях связана с декомпенсацией существующих заболеваний, вызванной острым кровотечением [1]. В настоящем обзоре речь пойдет о лечении пациентов с острым язвенным кровотечением.
Эпидемиология
Ежегодно в Соединенных Штатах Америки происходит 160 госпитализаций в связи с острым желу-
дочно–кишечным кровотечением (ЖКК) на 100 тыс. жителей, что соответствует более чем 400 тыс. госпитализаций в год [2]. Большая часть (80–90%) эпизодов
острого кровотечения не связана с варикозным расширением вен пищевода и вызван язвами желудка и двенадцатиперстной кишки [3]. Хотя в нескольких рабо-
тах было высказано предположение, что число язвенных кровотечений в мире может снижаться [4], недавно были опубликованы данные о том, что частота их встре-
чаемости составляет 60 на 100 тыс. населения [5], при этом все большее число подобных кровотечений связано с приемом ацетилсалициновой кислоты и нестероид-
ных противовоспалительных препаратов (НПВП). Кроме того, в большинстве случаев язвенные кровотечения развиваются у пожилых, так как 68% случаев состав-
ляют люди в возрасте старше 60 лет, а 27% – в возрасте старше 80 лет [6]. Смертность от язвенных кровотечений продолжает оставаться высокой, находясь в пределах от 5 до 10% [1,3]. По существующим оценкам, непо-
средственные расходы на стационарное лечение паци-
ентов с язвенными кровотечениями в Соединенных Штатах Америки превышают 2 млрд долларов в год [7].
Клиническая картина
Первичное ведение пациентов
Рвота с кровью и мелена являются наиболее часты-
ми первыми проявлениями острого язвенного кровотечения. Мелена в некоторых случаях имеет место у пациентов с кровотечениями из нижних отделов ЖКТ
(т.е. дистальной тонкой и толстой кишки), а у пациентов
с кровотечением из верхних отделов может иметь место примесь крови в кале [8]. Важна оценка состояния гемо-
динамики, включающая тщательное измерение пульса и
артериального давления (АД), в том числе анализ ортостатических изменений для оценки объема внутрисосудистой жидкости и проведения реанимационных мероприятий. У пациентов с острым язвенным кровотечением и значительным снижением объема внутрисосудистой жидкости отмечается тахикардия в покое (пульс
более или равен 100 уд./мин), гипотензия (систолическое артериальное давление менее 100 мм рт.ст.) или значительные ортостатические изменения (ускорение
пульса на 20 и более уд./мин или снижение АД на 20 и более мм рт.ст. при вставании) [9,10]. Также должны быть оценены состояние слизистых, вен шеи и объем выделяемой мочи, так как они косвенно отражают состояние внутрисосудистого объема жидкости [9].
Первой задачей лечения является восстановление потерь жидкости и гемодинамической стабильности. Необходимо начать введение кристаллоидных
растворов с применением крупных венозных катетеров (например, двух периферических катетров 16–18–го размера или центрального катетера при невозможности установки периферических). В целях поддержания
адекватной способности крови к транспортировке кислорода, особенно у пожилых людей с сопутствующими
сердечно–сосудистыми заболеваниями, следует рассмотреть возможность применения кислорода и переливания плазмы крови и эритроцитов при наличии тахикардии, гипотензии или снижения уровня гемоглобина
ниже 10 г/дцл [9,11]. При наличии показаний также следует проводить коррекцию коагулопатии [12].
Введение назогастрального зонда может быть весьма полезным на первичном этапе обследования пациента (особенно для определения тяжести заболевания), хотя мнение о ценности данной процедуры продолжает
оставаться противоречивым [10]. Было высказано предположение, что наличие алой крови в аспирате из назогастрального зонда является плохим прогностическим признаком, указывающим на необходимость срочного эндоскопического обследования [10,13]. В то же время отсутствие крови или материла, напоминающего кофейную гущу, не является гарантией отсутствия кровотечения, так как у 15% подобных пациентов при эндоскопическом обследовании были выявлены поражения высокого риска [10]. Применение орогастральных зондов большого диаметра для промывания желудка (водой комнатной температуры) улучшает визуализа-
цию желудочного дна при эндоскопии, но не результаты лечения [14]. Внутривенное введение эритромицина,
являющегося агонистом рецепторов мотилина, усиливает перистальтику желудка и значительно улучшает
визуализацию его слизистой при первичной эндоско-
пии. Однако повышение диагностической ценности
|
|
|
|
933 |
ТОМ 18, № 15, 2010 |
|
РМЖ |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|

ГАСТРОЭНТЕРОЛОГИЯ
Таблица 1. Лечение острого язвенного кровотечения в соответствии с клинической картиной и результатами эндоскопического исследования*
Клиническая картина
При поступлении
–Оцените состояние гемодинамики (пульс и артериальное давление, включая ортостатические изменения)
–Назначьте общий анализ крови, исследуйте уровни электролитов (включая мочевину и креатинин), международное нормализованное отношение, группу крови
–Начните терапию (кристаллоиды и продукты крови, если необходимо) и назначьте кислород
–Рассмотрите необходимость установки назогастрального зонда и аспирации по нему жидкости; исследование содержимого желудка на предмет выявления скрытой крови неоправданно
–Оцените необходимость проведения лечения в форме внутривенного введения ингибиторов протонного насоса
(болюс 80 мг с последующей постоянной инфузией 8 мг/ч) в ожидании эндоскопического исследования, Н2–блокаторы не показаны†
–Выполните раннее эндоскопическое обследование (в течение первых 24 ч после поступления)
–Возможно введение одной дозы эритромицина (250 мг) внутривенно за 30–60 мин до эндоскопии
–Определите к какой группе риска относится пациент, для этой цели возможно применение шкал Blatchford [16] и Rockall [17] перед эндоскопией
При ранней эндоскопии
–Оцените степень риска, учитывайте возможность применения шкалы Rockall [17]
Эндоскопические данные
Высокий риск – активное кровотечение или некровоточащий, но видимый сосуд (стадии IA, IB или IIA по Forrest)
–Добейтесь гемостаза путем применения контактного термального воздействия, механического воздействия с применением клипс или введения адреналина с последующим термальным воздействием или введением другого препарата. Ограничиваться только введением адреналина не рекомендуется
–Эндоскописту следует применять тот метод гемостаза, с которым он лучше знаком§
–Госпитализируйте пациента в палату круглосуточного наблюдения или интенсивной терапии
–Проводите лечение в форме внутривенного введения ингибиторов протонной помпы¶ (болюс 80 мг с последующим посто-
янным введением в дозе 8 мг/ч) в течение 72 ч после эндоскопического вмешательства, применение Н2–блокаторов, соматостатина и октреотида неоправданно
–Прием жидкости следует начинать через 6 ч после эндоскопии при условии стабильности гемодинамики [9]
–По окончании внутривенного введения переходите на пероральный прием блокаторов протонной помпы
–Проведите обследование с целью выявления H. pylori; если результат положительный назначьте лечение
Высокий риск – закрепленный тромб (стадия IIB по Forrest)
–Постарайтесь эндоскопически удалить сгусток, после чего добейтесь гемостаза (как описано выше) в случае кровотечения или наличия видимого сосуда
–Госпитализируйте пациента в палату круглосуточного наблюдения или интенсивной терапии
–Проводите лечение в форме внутривенного введения ингибиторов протонной помпы¶ (болюс 80 мг с последующим постоянным введением в дозе 8 мг/ч) в течение 72 ч после эндоскопического вмешательства, независимо от того, выполнялись ли манипуляции с целью гемостаза, применение Н2–блокаторов, соматостатина и октреотида неоправданно
–Прием жидкости следует начинать через 6 ч после эндоскопии при условии стабильности гемодинамики [9]
–По окончании внутривенного введения переходите на пероральный прием блокаторов протонной помпы
–Проведите обследование с целью выявления H. pylori; если результат положительный назначьте лечение
Низкий риск – плоское пигментированное пятно или чистое основание (стадии IIC или III по Forrest)
–Не выполняйте эндоскопических манипуляций с целью гемостаза
–Если пациент не имеет клинических признаков повышенного риска, он может быть выписан домой после эндоскопического обследования
–Лечение пероральными ингибиторами протонного насоса
–Прием жидкости следует начинать через 6 ч после эндоскопии при условии стабильности гемодинамики [9]
–Проведите обследование с целью выявления H. pylori; если результат положительный назначьте лечение
После эндоскопического обследования
–При наличии клинических признаков повторного язвенного кровотечения повторите эндоскопическое обследование с попыткой добиться гемостаза**, организуйте консультацию хирурга или интервенционного радиолога
–В соответствующих случаях обсудите необходимость продолжения приема НПВП, дезагрегантов, а также применение вместе с ними гастропротективных препаратов
* H2–блокаторы – антагонисты гистаминовых Н2–рецепторов
† Применение высоких доз внутривенных ингибиторов протонного насоса в ожидании эндоскопического обследования не влияет на результаты лечения, при этом оно может сопровождаться снижением степени риска выявленных измененийВведение эпинефрина проводят раствором препарата 1 к 10 000
§ Применение большого одно– или двухканального эндоскопа является предпочтительным, если применяется контактное тепловое воздействие, необходим крупный (10 French) зонд
¶ Только омепразол и пантопразол были изучены в клинических исследованиях, в которых оценивали их влияние на частоту повторных кровотечений, хирургических вмешательств и смертность ‖ Выполнение данной манипуляции рекомендуется только при наличии у врача соответствующего опыта [15]
** Рутинное выполнение повторной эндоскопии в течение первых 24 ч после первой не рекомендуется
934 |
|
|
|
|
|
|
РМЖ |
|
ТОМ 18, № 15, 2010 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
эндоскопии или улучшение результатов лечения в результате введения эритромицина доказаны не были (табл. 1) [18].
Сортировка пациентов и определение риска
Разработаны критерии, основанные на клинических признаках (т.е. не на данных эндоскопии), которые поз-
воляют ускорить сортировку пациентов с острым ЖКК, выявить нуждающихся в срочном вмешательстве, прогнозировать риск осложнений и определить оптималь-
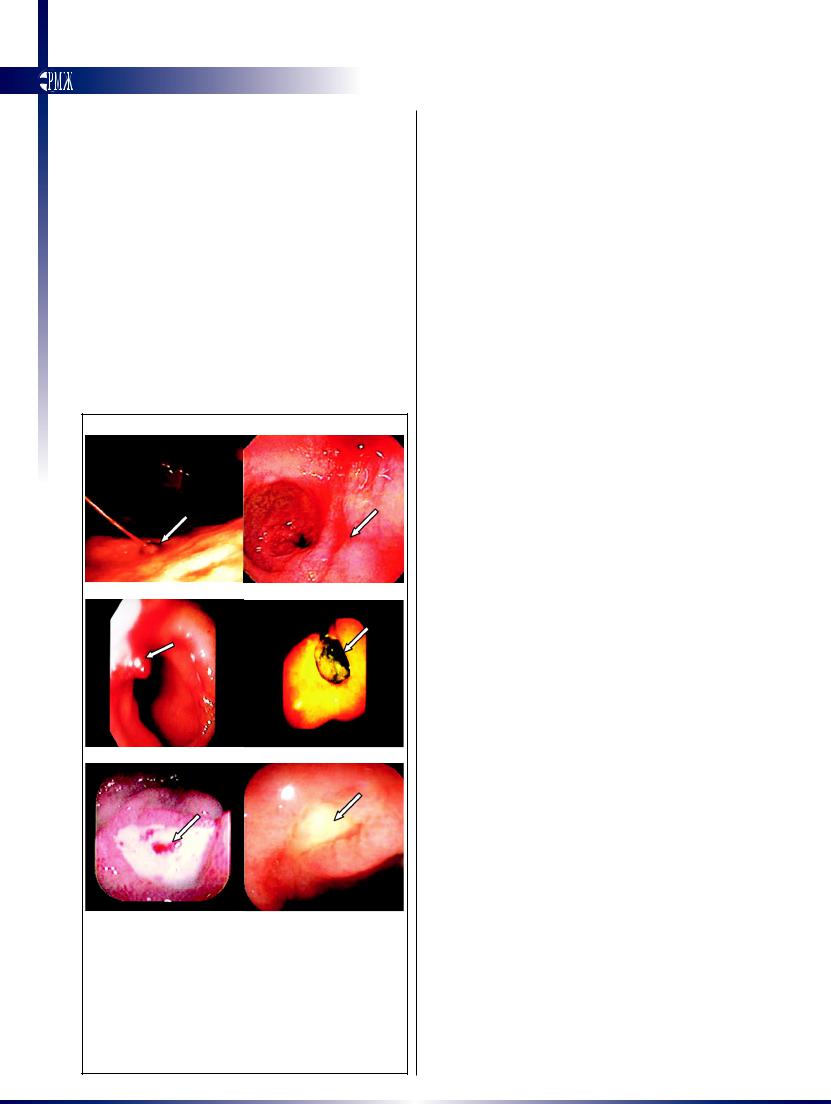
ный метод лечения [19,20]. Шкала Blatchford, общепризнанный метод классификации степени риска, основанный на клинических и лабораторных данных, используется для прогнозирования необходимости медицинского вмешательства у пациентов с кровотечением из верхних отделов ЖКТ (табл. 2) [16]. Данный показатель может находиться в пределах от 0 до 23, при этом более высокие значения указывают на больший риск. Шкала Rockall является, вероятнее всего, наиболее известной систе-
мой определения риска при кровотечениях из верхних отделов ЖКТ, и ее эффективность была доказана в различных условиях (табл. 2) [17]. Клинический показатель
Rockall (т.е. рассчитываемый до эндоскопии) получают исключительно на основании клинических данных непо-
средственно при поступлении. Полный показатель
Rockall включает как клинические, так и эндоскопические данные и позволяет прогнозировать риск повторного кровотечения и смерти, он варьирует от 0 до 11 бал-
лов, при этом более высокие значения указывают на более высокий риск. Оба эти показателя (Rockall и
Blatchford) полезны в определении прогноза пациентов, поступающих с острым кровотечением из верхних отделов ЖКТ, и имеют общие черты, включая данные о гемодинамическом состоянии и сопутствующих заболева-
ниях; применение этих шкал позволяет снизить число экстренных эндоскопических вмешательств среди паци-
ентов, имеющих низкий риск [21]. Предложены и другие методы определения риска [20]. В настоящее время рекомендуется применение подобных шкал в качестве дополнения к клинической оценке состояния больных.
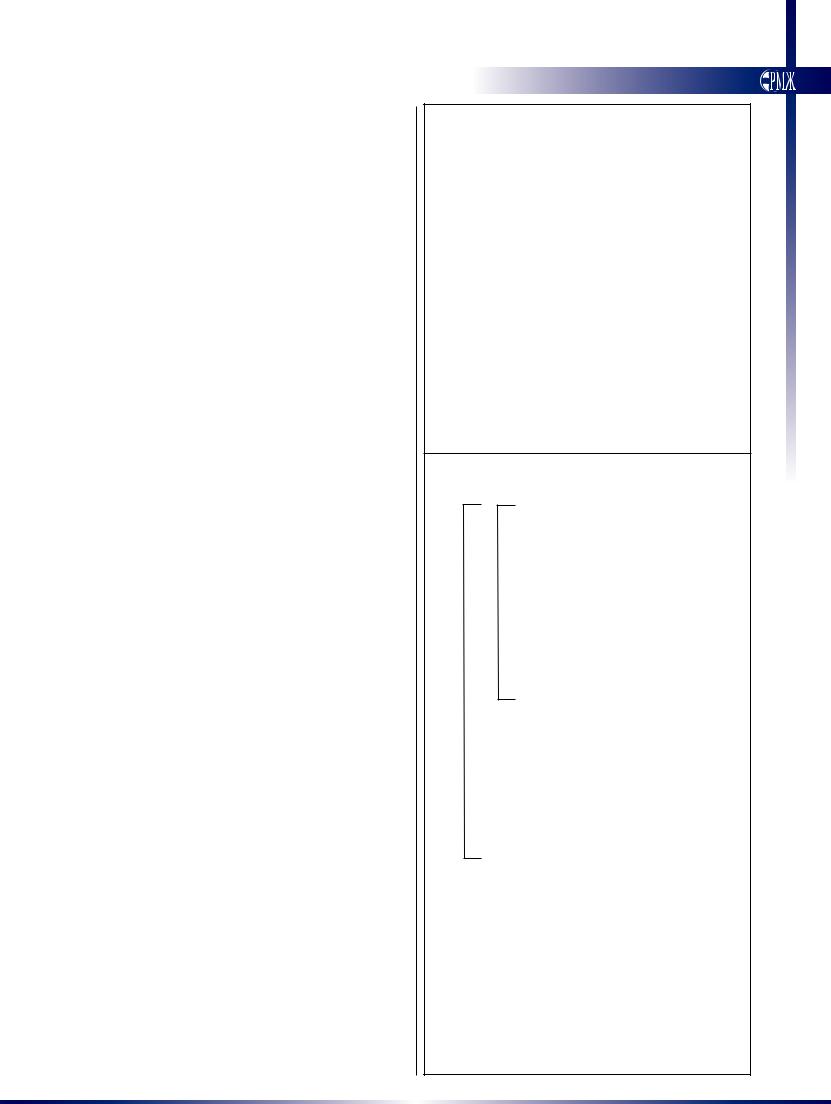
Эндоскопическая картина кровоточащей язвы может быть использована для прогнозирования повторного
кровотечения на основании классификации Forrest, в которой выделяют категории от IA до III. К числу изменений высокого риска относят язвы с видимым сильным
(категория IA) или слабым кровотечением (категория IB),
видимым сосудом, описываемым как пигментирован-
ный выступ, без кровотечения (категория IIA) и закрепленным тромбом (определяемым как красное или чер-
ное образование аморфной консистенции, которое
невозможно сместить путем отсасывания или полива водой под давлением) (категория IIB) (рис. 1A–1D).
Поражения низкого риска включают плоские, пиг-
ментированные пятна (категория IIC) и язвы с чистым дном (категория III) (рис. 1E и 1F) [8,22–24]. Зави-
симость правильности определения категории язвы от квалификации специалиста, выполняющего исследова-
ние, низка [25].
При первичном эндоскопическом исследовании
изменения высокого риска выявляются примерно в диа-
пазоне от одной трети до половины случаев [3], при этом
ГАСТРОЭНТЕРОЛОГИЯ
А. Шкала Blatchford |
|
||
При поступлении |
|
|
|
Баллы |
|
|
|
|
|
|
|
Систолическое АД |
|
|
|
100–109 мм рт.ст. |
1 |
||
90–99 мм рт.ст. |
|
2 |
|
<90 мм рт.ст. |
|
3 |
|
|
|
|
|
Мочевина крови |
|
|
|
6,5–7,9 ммоль/л |
|
2 |
|
8,0–9,9 ммоль/л |
|
3 |
|
10,0–24,9 ммоль/л |
4 |
||
|
|
|
|
25 ммоль/л |
|
6 |
|
Гемоглобин у мужчин |
|
||
|
|
|
|
12,0–12,9 г/дл |
|
1 |
|
10,0–11,9 г/дл |
|
3 |
|
<10,0 г/дл |
|
6 |
|
Гемоглобин у женщин |
|
||
10,0–11,9 г/дл |
|
1 |
|
<10,0 г/дл |
|
6 |
|
|
|
|
|
Другие показатели |
|
|
|
Пульс 100 |
|
1 |
|
|
|
|
|
Мелена |
|
|
1 |
Потеря сознания |
2 |
||
|
|
|
|
Печеночная дисфункция |
2 |
||
Сердечная недостаточность |
2 |
||
В. Шкала Rockall |
|
|
|
|
|
Показатель |
Баллы |
|
|
|
|
|
|
Возраст |
|
|
|
< 60 лет |
0 |
|
|
|
|
|
|
60–79 лет |
1 |
|
|
80 лет |
2 |
|
|
|
|
|
Клиническаяшкала Rockall |
Шок |
|
шкалаПолнаяRockall |
другие тяжелые заболевания |
2 |
|
|
|
Частота сердечных |
|
|
|
сокращений >100 уд./мин |
1 |
|
|
Систолическое АД |
|
|
|
<100 мм рт.ст. |
2 |
|
|
Сопутствующие заболевания |
|
|
|
Ишемическая болезнь сердца, |
|
|
|
сердечная недостаточность, |
|
|
|
|
|
|
|
|
|
|
|
Почечная недостаточность, |
|
|
|
|
|
|
|
печеночная недостаточность, |
|
|
|
метастатический рак |
3 |
|
|
|
|
|
|
Эндоскопическая картина |
|
|
|
Изменений не выявлено, |
|
|
|
разрыв Маллори – Вейса |
0 |
|
|
Язва, эрозивный процесс, эзофагит |
1 |
|
|
Рак верхней части жкт |
2 |
|
|
Эндоскопические признаки |
|
|
|
недавнего кровотечения |
0 |
|
|
Язва с чистым дном, плоское |
|
|
|
|
|
|
|
пигментированное пятно |
2 |
|
|
Кровь в верхней части ЖКТ, |
|
|
|
|
|
|
|
активное кровотечение, |
|
|
|
видимый сосуд, сгусток |
|
Таблица 2. Шкалы для определения степени риска
при кровотечении из верхних отделов ЖКТ
Вразделе А представлены показатели, используемые для оценки по
шкале Blatchford, сумма баллов варьирует в пределах от 0 до 23,
более высокие показатели соответствуют более высокому риску.
В разделе В представлена шкала Rockall, в которой баллы начис-
ляются за три группы клинических показателей (возраст, наличие шока и сопутствующих заболеваний) и две группы эндоскопических
показателей (источник и признаки кровотечения). Сумма баллов по полной шкале Rockall варьирует в пределах от 0 до 11. Пациенты с
суммой баллов по клинической шкале Rockall 0 или по полной
2 и менее рассматриваются как имеющие низкий риск смерти. Данные взяты из Blatchford и соавт. [16] и Rockall и соавт. [17].
Для перевода значений мочевины крови в миллиграммы на децилитр необходимо разделить на 0,357
|
|
|
|
|
935 |
|
ТОМ 18, № 15, 2010 |
|
РМЖ |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
ГАСТРОЭНТЕРОЛОГИЯ
частота повторных кровотечений из этих язв составляет от 22 до 55%, если их не пытались лечить эндоскопически [8,22,24]. Для подтверждения самостоятельной
диагностической ценности эндоскопического доплеровского ультразвукового исследования области кровотечения до и после воздействия на нее с целью остановки
кровотечения в отношении определения риска необходимы дополнительные исследования [26].
Подходы к лечению
Рекомендуется совместное лечение различными специалистами со своевременным привлечением спе-
циально подготовленного эндоскописта [9,19,27]. Подобная тактика требует круглосуточной доступности подобных специалистов в связи с тем, что ранняя эндо-
скопия (выполненная в течение 24 ч после обращения пациента) является краеугольным камнем лечения пациентов с острым кровотечением из верхних отделов
А. Видимое сильное кровотечение |
В. Видимое слабое кровотечение |
С. Видимый некровоточащий сосуд |
D. Закрепленный тромб |
E. Плоское пигментированное пятно |
F. Чистое основание |
Рис. 1. Эндоскопические признаки кровоточащих язв, отно-
симых к низкой и высокой степеням риска
К изменениям высокого риска относят те, в которых видно
сильное кровотечение (стадия IA по Forrest, рисунок A), слабое кровотечение (стадия IB, рисунок B), которые
содержат некровоточащий видимый сосуд (стадия IIA, рисунок C) или закрепленный тромб (стадия IIB, рисунок D).
К изменениям низкого риска относят плоские пигментиро-
ванные пятна (стадия IIC, рисунок E) или чистое основание
(стадия III, рисунок F)
ЖКТ и может улучшать отдельные результаты лечения (количество перелитой крови и длительность госпитализации) в случае пациентов, отнесенных к группе высокого риска. Ранняя эндоскопия также позволяет определить показания к безопасной выписке пациентов, отнесенных к группе низкого риска, таким образом снижая расходы на их лечение [19,28]. Целями ранней
эндоскопии являются определение источника кровотечения, прогноза и проведение эндоскопического лечения при наличии показаний. Рекомендации по лече-
нию касаются прежде всего первых 72 ч после поступления и эндоскопического обследования и лечения, так как риск повторного кровотечения наиболее высок именно в этот период (табл. 1) [24,29].
Пациенты из группы высокого риска
Пациенты с высоким риском должны быть госпитализированы, им следует провести эндоскопическое иссле-
дование и назначить лечение. Необходимо определить нуждаются ли они в помещении в отделение интенсивной терапии или достаточно усиленного наблюдения в тече-
ние первых 24 ч, при этом общая длительность госпитализации составляет как правило около 72 ч.
Пациентам с кровоточащими язвами, отнесенными к группе высокого риска при эндоскопии (активное кровотечение или видимый кровеносный сосуд), должен быть выполнен эндоскопический гемостаз, который снижает
риск повторного кровотечения, экстренного оперативного вмешательства и смерти [19,27,30]. К числу современных методов эндоскопического вмешательства
относят инъекции (например, физиологического раствора, вазоконстрикторов, склерозирующих веществ, препаратов, склеивающих ткани, или их комбинаций), тер-
мальные воздействия (контактные, такие как многополярная электрокоагуляция, и бесконтактные, такие как коагуляция с применением аргоновой плазмы) или меха-
нические воздействия (прежде всего эндоскопическое клипирование).
Все методы эндоскопических вмешательств дока-
занно превосходят отсутствие какого–либо вмешательства [19,27]. В то же время добавление второго метода
гемостаза (инъекции, термального воздействия) к введению адреналина (в физиологическом растворе в разведении 1 к 10 000) в еще большей степени снижает вероятность повторного кровотечения, оперативных
вмешательств и смерти [31] по сравнению с только введением адреналина, которого следует избегать [27,32]. Хотя эффективность введения только склерозирующего вещества считается сомнительной, оно редко приводит к повреждению тканей [33].
Существующие рекомендации считают более предпочтительным комбинированное лечение (введение адреналина с целью достижения местной вазоконстрикции и облегчения визуализации кровоточащего сосуда с последующим термальным воздействием) [19], однако преимущества комбинированного лечения перед только термальным воздействием доказаны не окончатель-
но [32]. Возможность эндоскопического лечения среди пациентов с высоким риском, имеющих закрепленный
тромб, остается дискуссионным вопросом (табл. 1)
[15,19,34–36].
936 |
|
|
|
|
|
|
РМЖ |
|
ТОМ 18, № 15, 2010 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|

ГАСТРОЭНТЕРОЛОГИЯ
Применение методов механического воздействия, прежде всего эндоскопической установки клипс, считается весьма перспективным [19]. Точная роль этого мето-
да окончательно не определена, существующие данные указывают на эффективность, аналогичную только термальному воздействию, комбинации инъекции и контакт-
ного термального воздействия, а также установке клипс в сочетании с инъекцией [32,37]. Этот вопрос требует дальнейшего изучения. Возможно, в будущем оптимальный метод лечения будет зависеть от расположения и внешнего вида язвы. В настоящее время эндоскопистам следует применять те методы гемостаза, которые они лучше знают, так как все эти методы достаточно эффективны. Однако применение только инъекции эпинефрина является неоправданным. Точная роль новых методов
эндоскопического гемостаза, таких как криотерапия, ушивание и применение металлических клипс, должна быть установлена в будущих исследованиях.
Различные клинические и эндоскопические факторы были предложены для прогнозирования эффективности эндоскопического лечения у пациентов с язвенным кровотечением. Они включают наличие язвенной
Таблица 3. Критерии для выявления пациентов с низким риском, которым показана лишь кратковременная госпитализация или амбулаторное лечение*
Клиническая картина
Критерии
•Возраст <60 лет
•Отсутствие признаков нестабильности гемодинамики, включая тахикардию (пульс 100 уд./мин.), гипотензию (систолическое артериальное давление <100 мм рт.ст.) или постуральные изменения (увеличение пульса до 20 уд./мин или снижение систолического АД 20 мм рт.ст. при вставании), или стабильная гемодинамика в течение 3 ч после первичного осмотра
•Отсутствие тяжелых сопутствующих заболеваний (например, сердечной недостаточности, хронической обструктивной болезни легких, цирроза печени, рака крови, хронической почечной недостаточности или инсульта)
•Уровень гемоглобина выше 8–10 г/дцл после адекватного увеличения объема внутрисосудистой жидкости и отсутствие необходимости в переливании крови
•Нормальная свертываемость крови
•Начало кровотечения за пределами больницы
•Выявление при раннем (выполненном в течение первых 24 ч после госпитализации) эндоскопическом обследовании язвы с чистым дном или отсутствия явных источников кровотечения
•Адекватная социальная поддержка дома и возможность быстро вернуться в больницу
* Данные из Rockall и соавт. [43], Longstreth и Feitelberg [44], Lai и соавт. [47], Moreno и соавт. [48], Lee и соавт. [49], Cipolletta и соавт. [50] и Bjorkman и соавт. [51]. Некоторые из этих критериев применялись в опубликованных работах, включавших только взрослых с кровотечениями из язв и других поражений, не связанных с варикозным расширением вен пищевода, таких как разрывы Маллори – Вейса, и не включавших кровотечения, вызванные варикозным расширением вен пищевода и желудка, гастропатию, вызванную портальной гипертензией, и опухоли верхней части ЖКТ
болезни в анамнезе, наличие язвенных кровотечений в анамнезе, поступление в состоянии шока, активное кровотечение во время эндоскопического исследования, большой размер язвы (более 2 см в диаметре), большой размер сосуда, из которого происходит кровотечение (≥2 мм в диаметре), а также расположение язвы на
малой кривизне желудка, или на задней стенке, или в верхней части луковицы двенадцатиперстной кишки
[38,39].
Обязательное выполнение повторной эндоскопии в течение первых 24 ч после первого исследования не рекомендуется [19,27]: хотя эффективность подобной процедуры была подтверждена в двух мета–анализах [40,41], снижение частоты рецидивов кровотечения является небольшим. Кроме того, данное вмешательство может оказаться неэффективным с финансовой точки зрения при применении медикаментозной терапии, нацеленной на подавление выделения кислоты
[42]. В некоторых случаях можно рассмотреть вопрос о выполнении повторной эндоскопии в индивидуальном
порядке при наличии клинических признаков повторного кровотечения или неуверенности в эффективности первого вмешательства.
Пациенты из группы низкого риска
Значительная часть пациентов, госпитализированных с острым кровотечением из верхних отделов ЖКТ,
не связанным с варикозным расширением вен пищевода, имеют низкий риск повторного кровотечения и смерти [43–45]. Результаты рандомизированных и рет-
роспективных исследований показали, что после эндоскопии пациенты с низким риском могут быть выписаны домой, в зависимости от того, когда было выполнено
эндоскопическое исследование [46–50]. Основные критерии для выбора метода ведения пациентов из группы низкого риска представлены в таблице 3 [43,44,47–51].
Пациенты с низким риском, не соответствующие этим критериям, должны быть госпитализированы для дальнейшего наблюдения.
Медикаментозное лечение
В течение последних 10 лет основной целью медикаментозного лечения пациентов с кровотечением из
верхних отделов ЖКТ, не связанным с варикозным расширением вен пищевода, являлось подавление выра-
ботки кислоты с применением ингибиторов протонного насоса. Экспериментальные данные показали, что соля-
ная кислота желудка препятствует формированию тром-
бов, способствует разделению тромбоцитов и фибринолизу [52]. В этой связи угнетение выработки кислоты и
повышение уровня внутрижелудочного рН до 6 и выше с
поддержанием этого уровня способствует стабильности тромбов, таким образом снижая вероятность повторно-
го кровотечения. Стоит, впрочем, отметить, что ориен-
тир внутрижелудочной кислотности 6 является чисто теоретическим и его клиническое значение в лечении язвенных кровотечений не доказано. Более того, хотя данные клинических исследований подтверждают
эффективность болюсного введения с последующей
поддерживающей инфузией ингибиторов протонного насоса, последние исследования из Северной Америки
|
|
|
|
|
937 |
|
ТОМ 18, № 15, 2010 |
|
РМЖ |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
ГАСТРОЭНТЕРОЛОГИЯ
показывают, что даже введение этих препаратов в высоких дозах может не позволить поддерживать внутрисосудистый рН на уровне 6 и выше [53]. Применение антагонистов гистаминовых Н2–рецепторов (Н2–блокаторов) у пациентов с язвенными кровотечениями не приводит к
достоверному улучшению результатов лечения [54], вероятнее всего вследствие развития фармакологической толерантности к их действию.
Мощные ингибиторы протонного насоса не вызывают развития тахифилаксии и высокоэффективны клинически [55]. Проведенный недавно мета–анализ показал, что применение ингибиторов протонного насоса
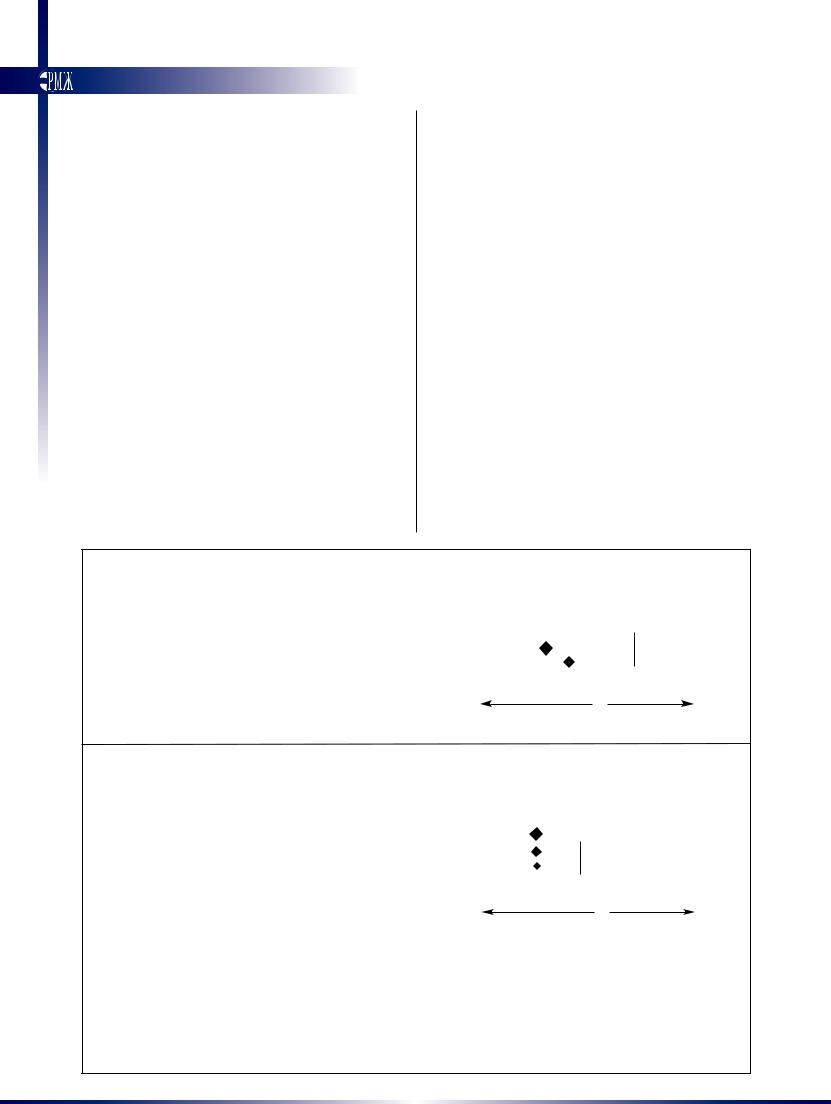
достоверно снижает риск повторных язвенных кровотечений (отношение шансов 0,40; 95%–ный доверительный интервал (ДИ) от 2,24 до 0,67), необходимость в проведении экстренных оперативных вмешательств (отношение шансов 0,50; 95%–ный ДИ от 0,33 до 0,76) и
риск смерти (отношение шансов 0.53; 95%–ный ДИ от 0,31 до 0,91) (рис. 2А и 2В) [56,57]. Эти данные также подтверждаются клинической практикой [3]. Однако сниже-
ние риска прежде всего имеет место в группе пациентов с высоким риском, которым сначала было проведено эндоскопическое лечение, это свидетельство, что меди-
каментозное лечение является дополнением, но не заменой эндоскопических вмешательств [34,57].
В настоящее время существует лишь ограниченное
число данных об эффективности внутривенного введе-
ния ингибиторов протонного насоса у пациентов с острым язвенным кровотечением, полученных в рандоми-
зированных клинических исследованиях в Соединенных Штатах Америки. Недавнее исследование, в котором
сравнивали применение высоких доз ингибиторов протонного насоса с Н2–блокаторами, было остановлено в связи с медленным набором пациентов, и хотя была
отмечена тенденция к более высокой эффективности ингибиторов протонной помпы, исследование было недостаточно крупным для того, чтобы это различие
достигло степени статистической достоверности [58]. Кроме того, важным является дозирование ингибиторов протонного насоса. Обобщенный анализ 16 рандомизированных исследований, включавший более 3800 пациентов, показал, что введение внутривенного болюса с последующей поддерживающей инфузией более эффективно, чем только болюс, в отношении снижения вероятности повторного кровотечения и оперативного лечения [59]. В этой связи в настоящее время рекомен-
дуется введение внутривенного болюса ингибитора протонного насоса с последующей поддерживающей инфузией в течение 72 ч после эндоскопического вмешатель-
ства, хотя оптимальная доза продолжает оставаться спорной (табл. 1). Также было подтверждено, что приме-
нение высоких доз внутривенных ингибиторов протонно-
го насоса является более эффективным и менее дорогостоящим в различных клинических условиях [60,61].
А. Повторное кровотечение и оперативные вмешательства |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Группа |
Ингибиторы |
Контрольная группа |
|
|
|
|
Отношение шансов |
|
|
|
|
|
|
||||||||||||
протонного насоса |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
количество пациентов и количество осложнений |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Повторное кровотечение |
1026/111 |
1031/189 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Оперативное вмешательство |
1082/38 |
1103/71 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
0.0 |
|
|
|
|
|
0.5 |
|
|
|
1.0 |
|
|
|
1.5 |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
Ингибиторы протонного |
|
Контрольная |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
насоса лучше |
группа лучше |
|
|
|
||||||||||||||
В. Смертность |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Группа |
Ингибиторы |
Контрольная группа |
|
|
|
|
Отношение шансов |
|
|
|
|
|
|
||||||||||||
протонного насоса |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
количество пациентов и количество осложнений |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Все пациенты |
1040/20 |
1062/38 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Пациенты, которым было выполнено |
954/17 |
969/32 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
эндоскопическое вмешательство |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пациенты, которым не было выполнено 86/3 |
93/6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
эндоскопическое вмешательство |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0.0 |
0.5 |
1.0 |
1.5 |
|
2.0 |
|
2.5 |
|
||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
Ингибиторы протонного |
|
Контрольная |
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
насоса лучше |
группа лучше |
|
|
|
||||||||||||||
Рис. 2. Эффективность ингибиторов протонного насоса
Графики демонстрируют эффективность ингибиторов протонного насоса в снижении частоты повторных кровотечений и оперативных вмешательств (рисунок А) и смерти (рисунок В). Смертность показана как для всех пациентов,
так и для тех, кому было и не было выполнено эндоскопическое вмешательство с целью гемостаза. Ромбы показывают
отношения рисков, а их размер пропорционален количеству пациентов, горизонтальные линии представляют 95%–ный интервал [57]
938 |
|
|
|
|
|
|
РМЖ |
|
ТОМ 18, № 15, 2010 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ГАСТРОЭНТЕРОЛОГИЯ |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
Введение высоких доз внутривенных ингибиторов |
|
тия значительно снизилось, в частности на сегодняш- |
|
|
|||||||
|
|
|
|
|||||||||
|
протонного насоса до эндоскопического вмешатель- |
|
ний день консультация хирурга не считается обязатель- |
|
|
|||||||
|
ства не влияет на результаты лечения, хотя может при- |
|
ным компонентом обследования пациентов с острым |
|
|
|||||||
|
вести к отнесению самой язвы к менее опасной форме. |
|
кровотечением из верхних отделов ЖКТ. Целью экстрен- |
|
|
|||||||
|
Иными словами, пациенты, получившие такое лечение, |
|
ных оперативных вмешательств является не излечение |
|
|
|||||||
|
имеют меньшую вероятность быть отнесенными к груп- |
|
болезни, а остановка кровотечения в тех случаях, когда |
|
|
|||||||
|
пе высокого риска по сравнению с получавшими плаце- |
|
эндоскопического вмешательства недостаточно или |
|
|
|||||||
|
бо (отношение шансов 0,67; 95%–ный ДИ от 0,54 до |
|
оно недоступно. Роль раннего планового оперативного |
|
|
|||||||
|
0,84) [62]. Таким образом, эти пациенты реже нуждают- |
|
вмешательства все еще окончательно не определена, |
|
|
|||||||
|
ся в выполнении эндоскопических манипуляций с целью |
|
так же как и оптимальная хирургическая методика у |
|
|
|||||||
|
гемостаза (19,1 и 28,4%, р=0,007) [63]. Экономическая |
|
пациентов с острым процессом [69,70]. Недавно прове- |
|
|
|||||||
|
эффективность подобного применения ингибиторов |
|
денный анализ, в котором сравнивали ваготомию с дре- |
|
|
|||||||
|
протонного насоса продолжает оставаться спорной |
|
нированием и ваготомию с резекцией желудка, не |
|
|
|||||||
|
[64,65]. |
|
|
|
выявил достоверных различий [71]. Хирургическое |
|
|
|||||
|
Применение больших доз пероральных ингибито- |
|
вмешательство продолжает оставаться безопас- |
|
|
|||||||
|
ров протонного насоса при язвенных кровотечениях |
|
ным и эффективным методом лечения для отдель- |
|
|
|||||||
|
оказалось эффективным в исследованиях, проведенных |
|
ных групп пациентов с неконтролируемым крово- |
|
|
|||||||
|
в Азии, приводя к снижению риска повторных крово- |
|
течением (т.е. тех, у кого не получается добиться ста- |
|
|
|||||||
|
течений (отношение шансов 0,24; 95%–ный ДИ от 0,16 |
|
билизации гемодинамики путем переливания кристал- |
|
|
|||||||
|
до 0,36), оперативных вмешательств (отношение шан- |
|
лоидов и продуктов крови), а также больных, которые |
|
|
|||||||
|
сов 0,29; 95%–ный ДИ от 0,16 до 0,53) и смерти (отно- |
|
могут не перенести рецидив или усиление кровотечения |
|
|
|||||||
|
шение шансов 0,35; 95%–ный ДИ от 0,16 до 0,74) [66]. |
|
[72]. У большинства пациентов с признаками продол- |
|
|
|||||||
|
Впрочем, эти результаты могут быть неприменимы для |
|
жающегося или повторного кровотечения вторая попыт- |
|
|
|||||||
|
жителей Северной Америки и Европы в связи с имею- |
|
ка эндоскопического вмешательства с целью достиже- |
|
|
|||||||
|
щимися различиями в физиологии, фармакологических |
|
ния гемостаза в большинстве случаев оказывается |
|
|
|||||||
|
особенностях (метаболизме ингибиторов протонного |
|
эффективной, может реже сопровождаться осложне- |
|
|
|||||||
|
насоса цитохромами Р–450 2С19, зависящем от генети- |
|
ниями по сравнению с хирургическим вмешательством |
|
|
|||||||
|
ческого полиморфизма), а также частотой встречаемо- |
|
и является рекомендуемым методом лечения [3,73]. |
|
|
|||||||
|
сти Helicobacter pylori, которые могут повышать эффек- |
|
Исключениями могут быть пациенты с язвами более |
|
|
|||||||
|
тивность указанных препаратов именно среди азиат- |
|
2 см в диаметре, а также те, у кого развивается гипо- |
|
|
|||||||
|
ских пациентов [66]. Необходимы дополнительные дан- |
|
тензия на фоне повторного кровотечения: у них повы- |
|
|
|||||||
|
ные о сравнительной эффективности внутривенных и |
|
шен риск неэффективности второго эндоскопического |
|
|
|||||||
|
пероральных ингибиторов протонного насоса, получен- |
|
вмешательства [27,73]. |
|
|
|
|
|
||||
|
ные в рандомизированных клинических исследованиях |
|
|
Ангиография с чрезкатетерной |
эмболизацией |
|
|
|||||
|
в западных странах, так как применение пероральных |
|
является еще одним методом неоперативного лечения |
|
|
|||||||
|
препаратов может позволить достичь существенной |
|
пациентов, у которых кровотечение не было остановле- |
|
|
|||||||
|
экономии при лечении [61]. |
|
|
но или его очаг не был выявлен при эндоскопии. Для |
|
|
||||||
|
Соматостатин и его аналог октреотид угнетают сек- |
|
эмболизации кровоточащих сосудов применяют такие |
|
|
|||||||
|
рецию как кислоты, так и пепсина, а кроме этого сни- |
|
вещества, как Gelfoam, поливинил этанол, цианакрило- |
|
|
|||||||
|
жают интенсивность кровотока в стенках желудка и две- |
|
вые клеи и кольца [74]. Эффективность подобных вме- |
|
|
|||||||
|
надцатиперстной кишки. Тем не менее эти препараты не |
|
шательств варьирует в пределах от 52 до 94%, а часто- |
|
|
|||||||
|
считают стандартным методом лечения пациентов с |
|
та повторных кровотечений, требующих эмболизации, |
|
|
|||||||
|
язвенным кровотечением в связи с тем, что проведен- |
|
составляет около 10% [75]. В исследованиях без конт- |
|
|
|||||||
|
ные рандомизированные исследования не выявили |
|
рольной группы было показано, что эмболизация |
|
|
|||||||
|
существенного эффекта от их применения как в форме |
|
значительно снижает смертность пациентов с крово- |
|
|
|||||||
|
монотерапии, так и в сочетании с Н2–блокаторами [67]. |
|
течениями из верхних отделов ЖКТ [74], хотя в некото- |
|
|
|||||||
|
Более того, нет также подтверждений целесообразно- |
|
рых случаях и сопровождается такими осложнениями, |
|
|
|||||||
|
сти применения этих препаратов в качестве дополнения |
|
как кишечная ишемия, вторичный дуоденальный сте- |
|
|
|||||||
|
к эндоскопическим вмешательствам. |
|
|
ноз, а также инфаркты желудка, печени и селезенки |
|
|
||||||
|
|
|
|
|
[75]. В большинстве клиник радиологические вмеша- |
|
|
|||||
|
Хирургическое лечение и интервенционная |
|
|
тельства выполняют у пациентов, которым не помогли |
|
|
||||||
|
радиология |
|
|
эндоскопические вмешательства, особенно тех из них, |
|
|
||||||
|
Мета–анализы показывают снижение числа опера- |
|
кто имеет высокий риск развития осложнений в резуль- |
|
|
|||||||
|
тивных вмешательств до 6,5–7,5% [31], что подтвержда- |
|
тате оперативного вмешательства. Ретроспективный |
|
|
|||||||
|
ется данными национальными статистическими данны- |
|
анализ не выявил существенных различий между эмбо- |
|
|
|||||||
|
ми [3], однако эпидемиологические исследования пока- |
|
лизацией и хирургическими вмешательствами в отно- |
|
|
|||||||
|
зывают увеличение числа экстренных хирургических |
|
шении частоты повторных кровотечений (29,0 и 23,1% |
|
|
|||||||
|
операций с 5,2 до 7,0 на 100 тыс. жителей в год в период |
|
соответственно), необходимости выполнения дополни- |
|
|
|||||||
|
с 1987 по 1999 г. [68]. В связи с лучшим пониманием |
|
тельных оперативных вмешательств (16,1 и 30,8%) и |
|
|
|||||||
|
природы язвенной болезни значение хирургических |
|
смертности (25,8 и 20,5%), несмотря на старший воз- |
|
|
|||||||
|
вмешательств в ее лечении в последние два десятиле- |
|
раст и более высокую частоту сердечно–сосудистых |
|
|
|||||||
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
939 |
|
|
|
|
|
ТОМ 18, № 15, 2010 |
|
РМЖ |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

ГАСТРОЭНТЕРОЛОГИЯ
заболеваний в группе пациентов, которым выполняли эмболию [76]. Хотя радиологическое вмешательство может в ряде случаев не быть окончательно излечиваю-
щим, оно позволяет стабилизировать состояние пациента до того момента, когда можно будет провести другое лечение [74].
Хотя обсуждение долгосрочного лечения пациентов с острым язвенным кровотечением выходит за рамки настоящей статьи, мы считаем необходимым упомянуть о крайней важности выявления и лечения H. pylori [77]. Кроме того, у отдельных пациентов важным является установление необходимости приема НПВП, а также дезагрегантов, и если подобное лечение требуется, следует также назначать им гастропротективные препараты [78].
Реферат подготовлен к.м.н. В.В. Иремашвили по материалам статьи I.M. Gralnek , A.N. Barkun, M. Bardou. «Management of acute bleeding from a peptic ulcer», New England Journal of Medicine 2008; 359: 928–937
Литература
1.Lim CH, Vani D, Shah SG, Everett SM, Rembacken BJ. The outcome of suspected upper gastrointestinal bleeding with 24–hour access to upper gastrointestinal endoscopy: a prospective cohort study. Endoscopy 2006;38:581–5.
2.Lewis JD, Bilker WB, Brensinger C, Farrar JT, Strom BL. Hospitalization and mortality rates from peptic ulcer disease and GI bleeding in the 1990s: relationship to sales of nonsteroidal anti–inflam- matory drugs and acid suppression medications. Am J Gastroenterol 2002;97:2540–9.
3.Barkun A, Sabbah S, Enns R, et al. The Canadian Registry on Nonvariceal Upper Gastrointestinal Bleeding and Endoscopy (RUGBE): endoscopic hemostasis and proton pump inhibition are associated with improved outcomes in a real–life setting. Am J Gastroenterol 2004;99:1238–46.
4.Targownik LE, Nabalamba A. Trends in management and outcomes of acute nonvariceal upper gastrointestinal bleeding: 1993–2003. Clin Gastroenterol Hepatol 2006;4:1459–66. [Erratum, Clin Gastroenterol Hepatol 2007;5:403.]
5.Lassen A, Hallas J, Schaffalitzky de Muckadell OB. Complicated and uncomplicated peptic ulcers in a Danish county 1993–2002: a population–based cohort study. Am J Gastroenterol 2006;101:945–53.
6.Ohmann C, Imhof M, Ruppert C, et al. Time–trends in the epidemiology of peptic ulcer bleeding. Scand J Gastroenterol 2005;40:914–20.
7.Viviane A, Alan BN. Estimates of costs of hospital stay for variceal and nonvariceal upper gastrointestinal bleeding in the United States. Value Health 2008;11:1–3.
8.Laine L, Peterson WL. Bleeding peptic ulcer. N Engl J Med 1994;331:717–27.
9.British Society of Gastroenterology Endoscopy Committee. Non–variceal upper gastrointestinal haemorrhage: guidelines. Gut 2002;51:Suppl 4:iv1–iv6.
10.Aljebreen AM, Fallone CA, Barkun AN. Nasogastric aspirate predicts high–risk endoscopic lesions in patients with acute upper–GI bleeding. Gastrointest Endosc 2004;59:172–8.
11.H bert PC, Wells G, Blajchman MA, et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. N Engl J Med 1999;340:409–17. [Erratum, N Engl J Med 1999;340:1056.]
12.Baradarian R, Ramdhaney S, Chapalamadugu R, et al. Early intensive resuscitation of patients with upper gastrointestinal bleeding decreases mortality. Am J Gastroenterol 2004;99:619–22.
13.Corley DA, Stefan AM, Wolf M, Cook EF, Lee TH. Early indicators of prognosis in upper gastrointestinal hemorrhage. Am J Gastroenterol 1998;93:336–40.
14.Lee SD, Kearney DJ. A randomized controlled trial of gastric lavage prior to endoscopy for acute upper gastrointestinal bleeding. J Clin Gastroenterol 2004; 38:861–5.
15.Jensen DM, Kovacs TO, Jutabha R, et al. Randomized trial of medical or endoscopic therapy to prevent recurrent ulcer hemorrhage in patients with adherent clots. Gastroenterology 2002;123:407–13.
16.Blatchford O, Murray WR, Blatchford M. A risk score to predict need for treatment for upper–gastrointestinal haemorrhage. Lancet 2000;356:1318–21.
17.Rockall TA, Logan RF, Devlin HB, Northfield TC. Risk assessment after acute upper gastrointestinal haemorrhage. Gut 1996;38:316–21.
18.Carbonell N, Pauwels A, Serfaty L, Boelle PY, Becquemont L, Poupon R. Erythromycin infusion prior to endoscopy for acute upper gastrointestinal bleeding: a randomized, controlled, double–blind trial. Am J Gastroenterol 2006;101:1211–5.
19.Barkun A, Bardou M, Marshall JK. Consensus recommendations for managing patients with nonvariceal upper gastrointestinal bleeding. Ann Intern Med 2003;139:843–57.
20.Das A, Wong RC. Prediction of outcome of acute GI hemorrhage: a review of risk scores and predictive models. Gastrointest Endosc 2004;60:85–93.
21.Romagnuolo J, Barkun AN, Enns R, Armstrong D, Gregor J. Simple clinical predictors may obviate urgent endoscopy in selected patients with nonvariceal upper gastrointestinal tract bleeding. Arch Intern Med 2007;167:265–70.
22.Forrest JA, Finlayson ND, Shearman DJ. Endoscopy in gastrointestinal bleeding. Lancet 1974;2:394–7.
23.Consensus conference: therapeutic endoscopy and bleeding ulcers. JAMA 1989; 262:1369–72.
24.Freeman ML, Cass OW, Peine CJ, Onstad GR. The non–bleeding visible vessel versus the sentinel clot: natural history and risk of rebleeding. Gastrointest Endosc 1993;39:359–66.
25.Lau JY, Sung JJ, Chan AC, et al. Stigmata of hemorrhage in bleeding peptic ulcers: an interobserver agreement study among international experts. Gastrointest Endosc 1997;46:33–6.
26.Wong RC. Endoscopic Doppler US probe for acute peptic ulcer hemorrhage. Gastrointest Endosc 2004;60:804–12.
27.Adler DG, Leighton JA, Davila RE, et al. ASGE guideline: the role of endoscopy in acute non–vari- ceal upper–GI hemorrhage. Gastrointest Endosc 2004;60:497–504. [Erratum, Gastrointest Endosc 2005; 61:356.]
28.Spiegel BM, Vakil NB, Ofman JJ. Endoscopy for acute nonvariceal upper gastrointestinal tract hemorrhage: is sooner better? A systematic review. Arch Intern Med 2001;161:1393–404.
29.Lau JY, Chung SC, Leung JW, Lo KK, Yung MY, Li AK. The evolution of stigmata of hemorrhage in bleeding peptic ulcers: a sequential endoscopic study. Endoscopy 1998;30:513–8.
30.Cook DJ, Guyatt GH, Salena BJ, Laine LA. Endoscopic therapy for acute nonvariceal upper gastrointestinal hemorrhage: a meta–analysis. Gastroenterology 1992; 102:139–48.
31.Calvet X, Vergara M, Brullet E, Gisbert JP, Campo R. Addition of a second endoscopic treatment following epinephrine injection improves outcome in high–risk bleeding ulcers. Gastroenterology 2004; 126:441–50.
32.Marmo R, Rotondano G, Piscopo R, Bianco MA, D’Angella R, Cipolletta L. Dual therapy versus monotherapy in the endoscopic treatment of high–risk bleeding ulcers: a meta–analysis of controlled trials. Am J Gastroenterol 2007;102:279–89, 469.
33.Park WG, Yeh RW, Triadafilopoulos G. Injection therapies for nonvariceal bleeding disorders of the GI tract. Gastrointest Endosc 2007;66:343–54.
34.Sung JJ, Chan FK, Lau JY, et al. The effect of endoscopic therapy in patients receiving omeprazole for bleeding ulcers with nonbleeding visible vessels or adherent clots: a randomized comparison. Ann Intern Med 2003;139:237–43.
35.Kahi CJ, Jensen DM, Sung JJ, et al. Endoscopic therapy versus medical therapy for bleeding peptic ulcer with adherent clot: a meta–analysis. Gastroenterology 2005;129:855–62. [Erratum, Gastroenterology 2006;131:980–1.]
36.Laine L. Systematic review of endoscopic therapy for ulcers with clots: can a meta–analysis be misleading? Gastroenterology 2005;129:2127–8.
37.Sung JJ, Tsoi KK, Lai LH, Wu JC, Lau JY. Endoscopic clipping versus injection and thermo–coa- gulation in the treatment of non–variceal upper gastrointestinal bleeding: a meta–analysis. Gut 2007;56:364–73.
38.Chung IK, Kim EJ, Lee MS, et al. Endoscopic factors predisposing to rebleeding following endoscopic hemostasis in bleeding peptic ulcers. Endoscopy 2001;33:969–75.
39.Thomopoulos KC, Theocharis GJ, Vagenas KA, Danikas DD, Vagianos CE, Nikolopoulou VN. Predictors of hemostatic failure after adrenaline injection in patients with peptic ulcers with nonbleeding visible vessel. Scand J Gastroenterol 2004;39:600–4.
40.Marmo R, Rotondano G, Bianco MA, Piscopo R, Prisco A, Cipolletta L. Outcome of endoscopic treatment for peptic ulcer bleeding: is a second look necessary? A meta–analysis. Gastrointest Endosc 2003;57:62–7.
41.Chiu PW–Y, Lau T–S, Kwong K–H, Suen DT–K, Kwok SP–Y. Impact of programmed second endoscopy with appropriate retreatment on peptic ulcer re–bleeding: a systematic review. Ann Coll Surg Hong Kong 2003;7:106–15. Spiegel BM, Ofman 42. JJ, Woods K, Vakil NB. Minimizing recurrent peptic ulcer hemorrhage after endoscopic hemostasis: the cost–effectiveness of competing strategies. Am J Gastroenterol 2003;98:86–97.
43.Rockall TA, Logan RF, Devlin HB, Northfield TC. Selection of patients for early discharge or outpatient care after acute upper gastrointestinal haemorrhage: National Audit of Acute Upper Gastrointestinal Haemorrhage. Lancet 1996;347:1138–40.
44.Longstreth GF, Feitelberg SP. Successful outpatient management of acute upper gastrointestinal hemorrhage: use of practice guidelines in a large patient series. Gastrointest Endosc 1998;47:219–22.
45.Dulai GS, Gralnek IM, Oei TT, et al. Utilization of health care resources for low–risk patients with acute, nonvariceal upper GI hemorrhage: an historical cohort study. Gastrointest Endosc 2002;55: 321–7.
46.Hay JA, Maldonado L, Weingarten SR, Ellrodt AG. Prospective evaluation of a clinical guideline recommending hospital length of stay in upper gastrointestinal tract hemorrhage. JAMA 1997;278:2151–6.
Полный список литературы Вы можете найти на сайте http://www.rmj.ru
940 |
|
|
|
|
|
|
РМЖ |
|
ТОМ 18, № 15, 2010 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
