
- •Введение
- •Предельные углеводороды (алканы и циклоалканы)
- •Способы получения
- •Углеводороды с двойными связями алкены
- •Диеновые углеводороды
- •Понятие об ароматичности
- •Функциональные производные
- •Галогенопроизводные
- •Физические свойства
- •Кислородсодержащие функциональные производные
- •Одноатомные спирты
- •Физические свойства
- •Применение.
- •Многоатомные спирты
- •Физические свойства
- •Применение.
- •Фенолы, нафтолы
- •Физические свойства
- •Оксосоединения. Альдегиды и кетоны.
- •Физические свойства
- •Применение.
- •Карбоновые кислоты
- •Одноосновные кислоты (насыщенные и ароматические)
- •Способы получения
- •Одноосновные ненасыщенные кислоты
- •Физические свойства.
- •Применение.
- •Двухосновные кислоты
- •Применение.
- •Функциональные производные карбоновых кислот
- •Гидроксикислоты
- •Углеводы. Определение, строение, нахождение в природе.
- •Физические свойства
- •Физические свойства
- •Азотсодержащие соединения
- •Нитросоединения
- •Физические свойства
- •Применение.
- •Диазо- и азосоединения
- •Физические свойства
- •Применение.
- •Аминокислоты
- •Классификация, изомерия
- •Химические свойства
- •Значение аминокислот
- •Пептиды
- •Гетероциклические соединения
Диеновые углеводороды
К диеновым углеводородам относятся органические соединения, содержащие в молекуле две двойные связи. Если в молекуле есть несколько двойных связей, то такие вещества относятся к полиеновым соединениям (например, природный пигмент β-каротин).
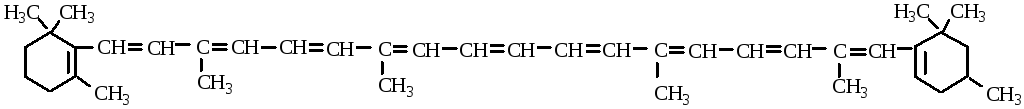
β-каротин
При составлении названий веществ перед суффиксом добавляется умножающая приставка ди- (-диен), если три двойных связи в молекуле – три- (-триен), N двойных связей – поли- (-полиен).
1,3-бутадиен,
дивинил
1,4-пентадиен
2-метил-1,3-бутадиен,
изопрен![]()
1,3,5-гексатриен![]()
В зависимости от расположения двойных связей различают:
1) сопряженные диены, когда π-связи чередуются одной σ-связью
![]()
2) изолированные, если двойная связь разделена более чем одной σ-связью
![]()
![]()
3) кумулированные, когда π-связи расположены рядом
СПОСОБЫ ПОЛУЧЕНИЯ
Способы получения диеновых углеводородов аналогичны способам получения алкенов.
1. Дегидрирование предельных углеводородов происходит при нагревании в присутствии катализаторов (Pt, Ni, Pd, Cr2O3).
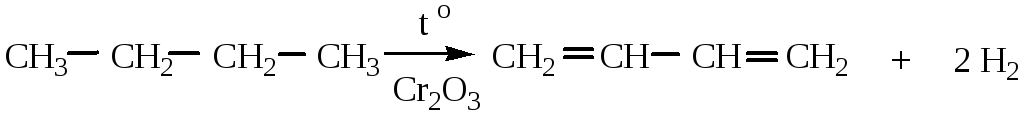
2. Дегидратация непредельных спиртов идет при нагревании в присутствии водоотнимающих средств (H2SO4, H3PO4, Al2O3).

3. Дегидратация гликолей. Условия реакции аналогичны вышеприведенным в п.2.
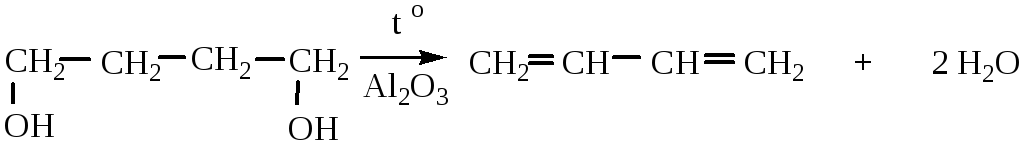
4. Метод Лебедева – промышленный способ получения дивинила из этанола.
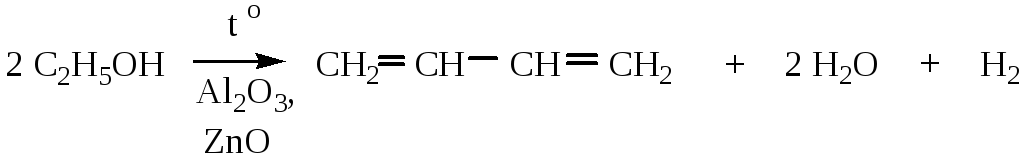
Физические свойства
Основные закономерности изменения физических свойств в гомологическом ряду алкадиенов аналогичны ряду алкенов.
ХИМИЧЕСКИЕ СВОЙСТВА
Для диеновых углеводородов характерны реакции присоединения, окисления и полимеризации, протекающие в условиях, аналогичных для алкенов. Ниже приведены реакции, характеризующие особые свойства сопряженных диенов.
Кумулированные и изолированные диены обладают такими же химическими свойствами, как и алкены; сопряженные – обладают повышенной реакционной способностью и могут вступать как в 1,2–, так и в 1,4– присоединение.
П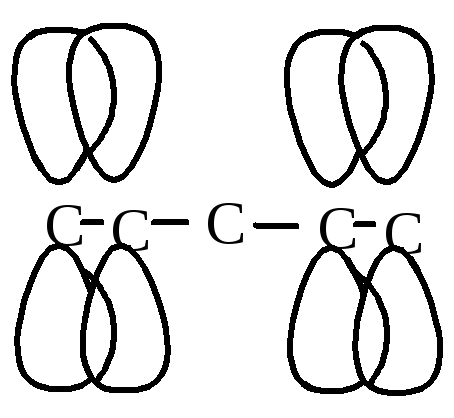 оведение
диеновых углеводородов обусловлено
строением их молекул (рис. 4).
оведение
диеновых углеводородов обусловлено
строением их молекул (рис. 4).
Изолированные диены
С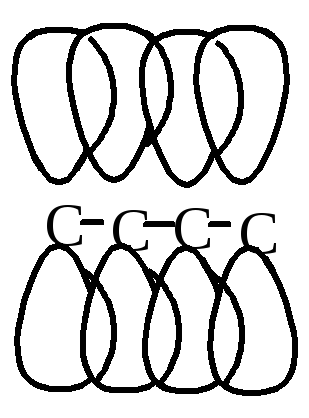 опряженные
диены
опряженные
диены
Рис. 4. Электронное строение диеновых углеводородов
В молекулах сопряженных диенов наблюдается π-сопряжение, электронная плотность равномерно распределяется по всем 4-м атомам углерода. Реакции, характерные для диеновых углеводородов, протекают с образованием более устойчивых радикалов или карбкатионов.
электрофильный
механизм
радикальный
механизм
аллильный радикал
аллильный карбкатион
При низких температурах химические реакции для сопряженных диенов идут по типу 1,2– присоединения; при повышенной температуре происходит перегруппировка с образованием аллильного радикала или карбкатиона, вследствие чего протекает 1,4– присоединение.
1. Реакции присоединения.
1) Галогенирование
1,3-бутадиен
2) Гидрогалогенирование

3) Гидрирование
2. Реакции полимеризации.
1,2
1,4-цис
1,4-транс
3. Димеризация.
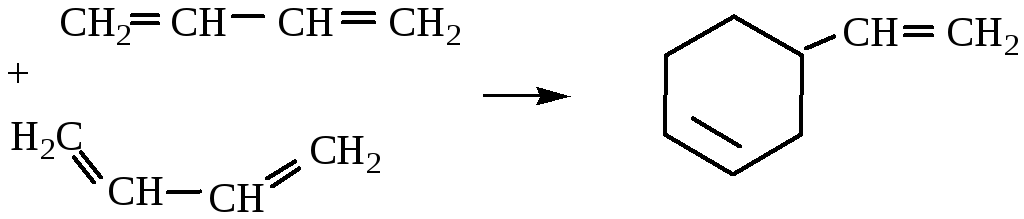
4. Диеновый синтез.
1,3-бутадиен
диенофил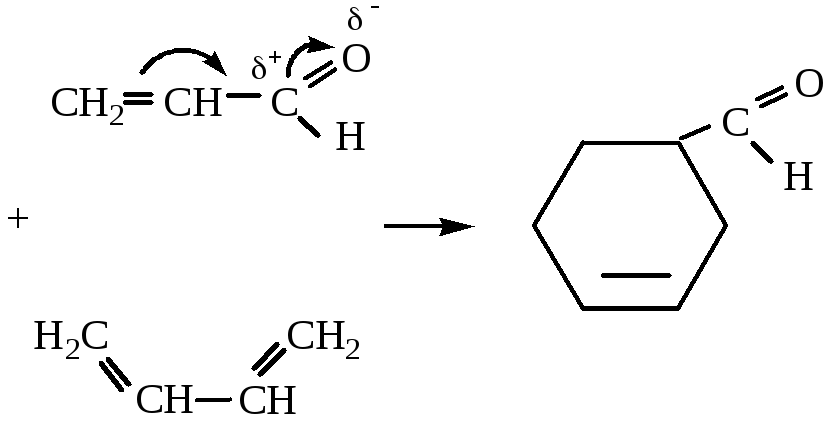
АЛКИНЫ
Алкинами называются
непредельные углеводороды, содержащие
в своем составе тройную связь ![]() .
Общая формула алкинов CnH2n-2.
Тип гибридизации углеродных атомов,
связанных тройной связью – sp,
т.е. углерод находится в третьем валентном
состоянии (гибридизованы только две
орбитали: s
и p).
σ-связь лежит в одной плоскости, две
π-связи – во взаимно перпендикулярных
областях образуются негибридизованными
р-орбиталями атомов углерода (рис. 5).
.
Общая формула алкинов CnH2n-2.
Тип гибридизации углеродных атомов,
связанных тройной связью – sp,
т.е. углерод находится в третьем валентном
состоянии (гибридизованы только две
орбитали: s
и p).
σ-связь лежит в одной плоскости, две
π-связи – во взаимно перпендикулярных
областях образуются негибридизованными
р-орбиталями атомов углерода (рис. 5).
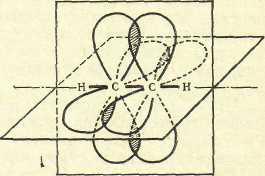
Рис. 5. Пространственное расположение орбиталей в молекуле ацетилена.
Угол σ-связей равен 180 оС. Длина связей С-С равна 0,120 нм, С-Н – 0,106 нм.
НОМЕНКЛАТУРА, ИЗОМЕРИЯ.
Первый представитель гомологического ряда алкинов – ацетилен НС≡СН.
При составлении названия гомологов ацетилена в названии соответствующего алкана суффикс «–ан» заменяется на «–ин».

Структурная изомерия связана со строением углеродного скелета и положением тройной связи.
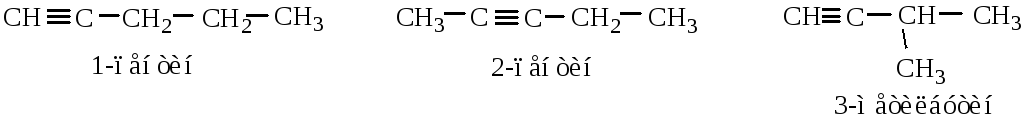
Геометрическая изомерия в ряду алкинов отсутствует.
СПОСОБЫ ПОЛУЧЕНИЯ
Наибольшее практическое применение из алкинов имеет ацетилен. В промышленности его получают следующими способами.
1. Получение из карбида кальция (способ Велера)
![]()
2. Термический крекинг (из алканов С1-С4 под действием высокой температуры)
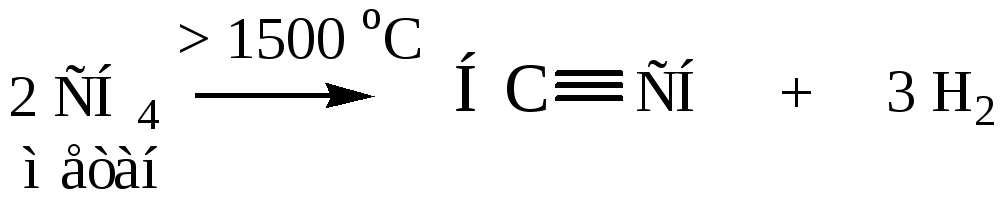
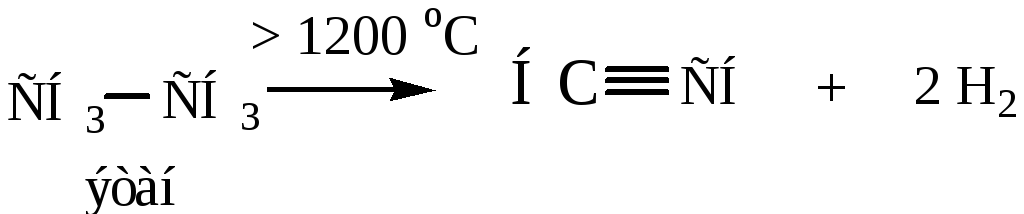
Способы получения гомологов ацетилена можно разделить на следующие.
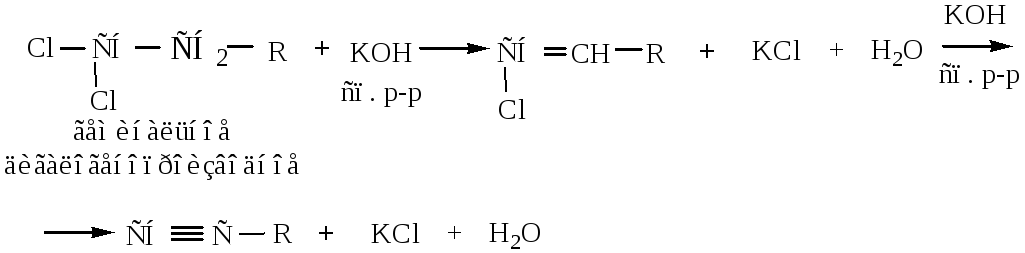
1) Из вицинальных дигалогенопроизводных. Действием КОН спиртового раствора или твердой щелочи КОН последовательно получаются двойная, а затем тройная связь.

2) Из геминальных дигалогенопроизводных в условиях, аналогичных предыдущей реакции, можно получить какой-либо гомолог ацетилена.
3) Алкилирование металлорганических производных ацетилена. При взаимодействии ацетиленидов натрия, серебра и др. с галогенопроизводными могуь быть получены алкины заданного строения.
![]()
![]()
Физические свойства.
Гомологи С2–С4 (за исключением 1-бутина) – газы, С5–С15 – жидкости, С15 и более – твердые вещества. Закономерности в изменении tпл., tкип., и ρ – такие же, как у алкенов.
ХИМИЧЕСКИЕ СВОЙСТВА
Поведение алкинов связано с наличием в их молекулах тройной связи. Для углеводородов этого класса характерны реакции присоединения, полимеризации, окисления и замещения атома водорода у тройной связи.
Реакции присоединения
протекают ступенчато с образованием
алкенов или их производных, затем алканов
(или их производных). Так как в молекулах
алкинов атомы углерода, связанные
тройной связью, находятся в состоянии
sp-гибридизации,
они расположены ближе друг к другу и
более электроотрицательны, чем атомы
углерода, связанные двойной связью в
алкенах. π-электроны тройной связи
втянуты внутрь молекулы, поэтому атомы
углерода меньше экранированы с внешней
стороны. Поляризуемость π-связи ![]() уменьшена, поэтому
алкины легче присоединяют нуклеофильные
реагенты, труднее – электрофильные.
1-алкины проявляют кислотные свойства
и могут отдавать атом Н, стоящий у тройной
связи, замещая его на атом металла и
образуя при этом ацетилениды.
уменьшена, поэтому
алкины легче присоединяют нуклеофильные
реагенты, труднее – электрофильные.
1-алкины проявляют кислотные свойства
и могут отдавать атом Н, стоящий у тройной
связи, замещая его на атом металла и
образуя при этом ацетилениды.
1) Гидрирование. Присоединение водорода в присутствии катализатора (Ni, Pt или Pd) происходит ступенчато, с образованием вначале алкена, затем алкана.
![]()
2) Галогенирование – присоединение Br2 или Cl2 по тройной связи идет с меньшей скоростью, чем у алкенов.
Присоединение Br2 в Cl4 является качественной реакцией и на тройную связь, так как при этом бромная вода обесцвечивается.

3) Гидрогалогенирование – присоединение галогеноводородов (HBr или HCl) идет по электрофильному механизму (аналогично алкенам) по правилу Марковникова)
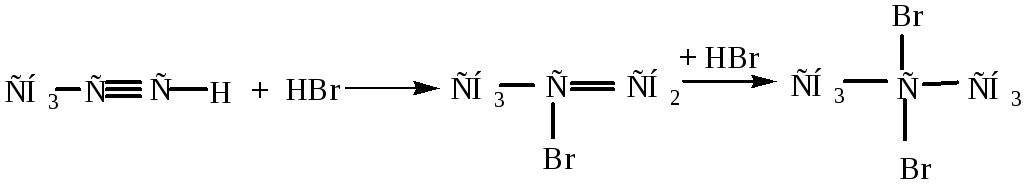
4) Гидратация (присоединение воды) происходит в присутствии солей двухвалентной ртути или кадмия (реакция Кучерова). Гидратация ацетилена приводит к образованию альдегида, остальных алкинов – к образованию соответствующего кетона
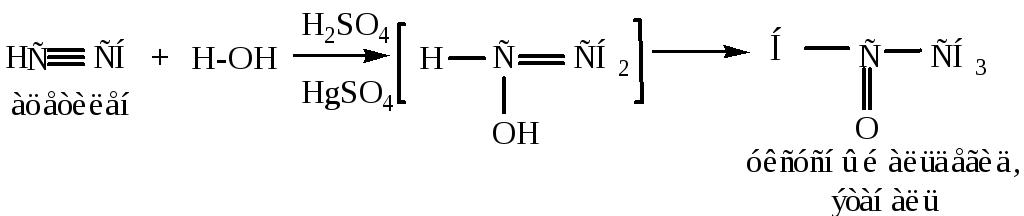
Виниловый спирт, образующийся на промежуточной стадии неустойчив согласно правилу Эльтекова: гидроксил у двойной связи неустойчив, в результате чего происходит внутримолекулярная перегруппировка с образованием соответствующего карбонильного соединения.

5) Присоединение спиртов (реакция Фаворского и Шостаковского) происходит в присутствии твердых щелочей при нагревании по правилу Марковникова

6) Присоединение карбоновых кислот протекает по правилу Марковникова в присутствии H3PO4 как катализатора
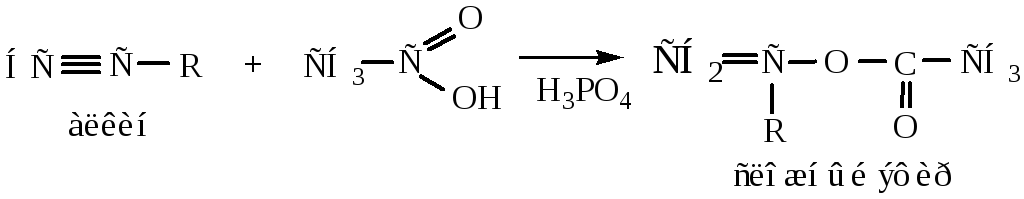
7) Присоединение синильной кислоты идет по правилу Марковникова при участии в качестве катализатора раствора, содержащего хлорид меди.
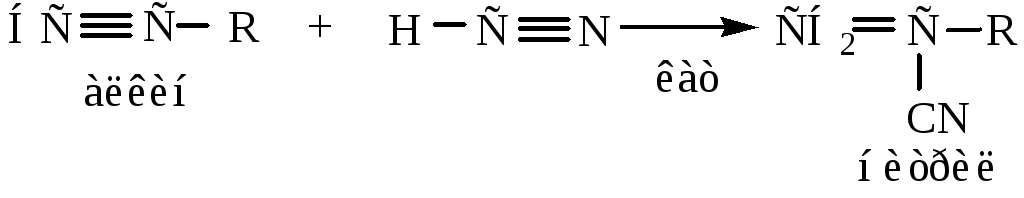
8) Реакция Ренке – присоединение оксида углерода и спиртов – происходит в присутствии катализатора Ni(Co)4.

9) Реакции замещения ацетиленового атома водорода. 1-алкины обладают слабыми кислотными свойствами, т.к. могут под действием некоторых реагентов отщеплять Н+. Это связано с тем, что атомы углерода у тройной связи обладают повышенной электроотрицательностью:
![]()
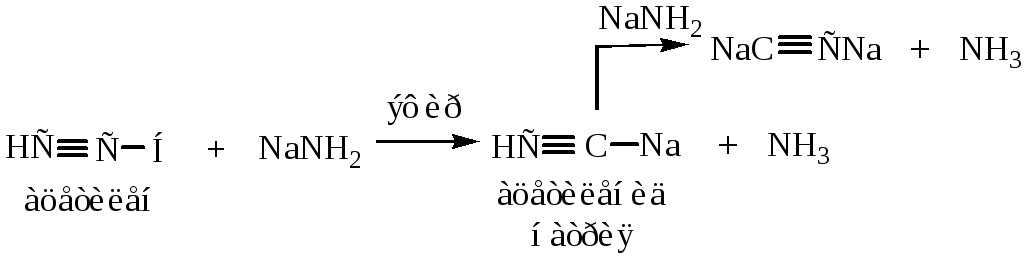
![]()
Реакция с аммиачным раствором гидроксида серебра является качественной реакцией на концевую тройную связь.
Ацетилениды в сухом виде являются взрывоопасными веществами.

Металлорганические производные ацетилена: CH≡CMgI и CH≡CNa – используются для получения гомологов ацетилена.
10) Присоединение альдегидов и кетонов происходит по нуклеофильному механизму, также является реакцией проявления алкинами кислотных свойств.
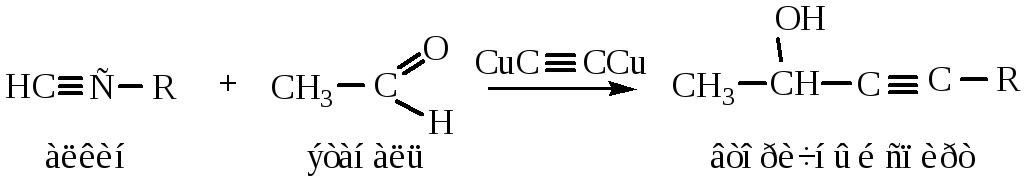
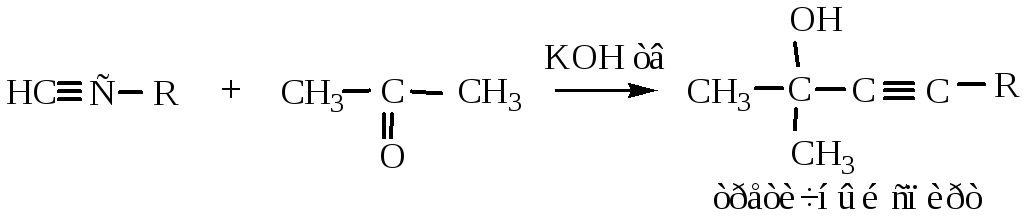
11) Окисление алкинов происходит по тройной связи с ее разрывом. При действии окислителей (KMnO4, концентрированных кислот, хромовой смеси) образуется смесь карбоновых кислот.

Алкины окисляются в условиях реакции Вагнера (разбавленным раствором KMnO4), т.е. она является качественной и на тройную связь.
При полном окислении (горении) образуется смесь СО2 и Н2О с выделением большого количества теплоты.
![]()
12) Изомеризация (реакция Фаворского) – реакция, в результате которой тройная связь перемещается из конца в середину молекулы под действием спиртовых растворов щелочей.

13) Полимеризация. В зависимости от условий реакции, при полимеризации могут образовываться различные продукты, применяющиеся в химической промышленности.
а) Реакция Зелинского – образование бензола при нагревании ацетилена над активированным углем при температуре до 450 оС.
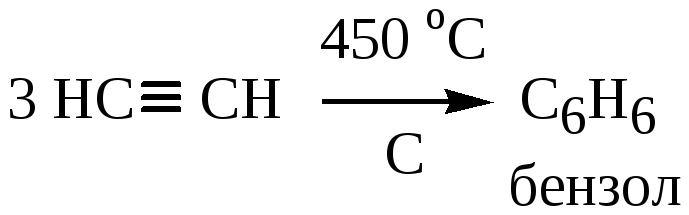
б) Образование винилацетилена.
![]()
в) В общем виде реакция полимеризации может быть записана в следующем виде:

АРЕНЫ
А роматические
соединения(арены) – это соединения,
содержащие в своей структуре бензольное
ядро – особую циклическую группировку
из шести атомов углерода:
роматические
соединения(арены) – это соединения,
содержащие в своей структуре бензольное
ядро – особую циклическую группировку
из шести атомов углерода:
По количеству бензольных группировок арены делятся на одноядерные и многоядерные, в качестве боковых цепочек они могут содержать различные алифатические, циклические группировки, либо функциональные группы.
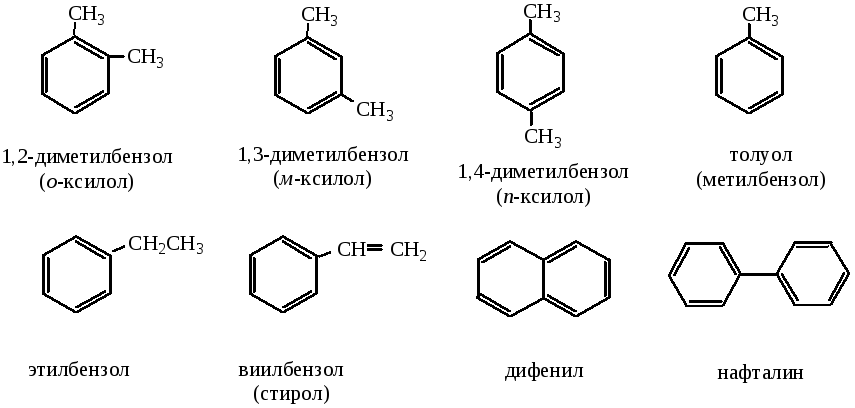
ОДНОЯДЕРНЫЕ АРОМАТИЧЕСКИЕ УГЛЕВОДОРДЫ
Общая формула гомологического ряда бензола CnH2n-6. Одним из наиболее важных представителей гомологического ряда одноядерных ароматических углеводородов является бензол С6Н6.

Химическая формула бензола была предложена в 1865 г. немецким ученым Кекуле. Формула Кекуле отражает правильно элементный состав, т.е. соотношение количества атомов углерода и водорода, но не отвечает на вопрос, почему для бензола и его гомологов характерны реакции замещения, а не присоединения (бензол не обесцвечивает бромную воду, устойчив к действию окислителей и высоких температур). Особенность химических свойств аренов обусловлена их электронным строением:


Н
Н
а) б)
Атомы углерода в молекуле бензола образуют правильный шестиугольник со сторонами 0,140 нм и находятся в состоянии sp2-гибридизации. Все σ-связи С-С и С-Н лежат в одной плоскости под углом 120 0 а негибридизированные р-орбитали перекрываются над и под плоскостью σ-связи, образуя единую замкнутую систему р-электронов (так называемое π-сопряжение). Таким образом, в молекуле бензола связи между атомами углерода равноценны, нет ни одинарных, ни двойных связей.
Связь С-С обладает повышенной прочностью, поэтому бензол и его гомологи устойчивы к действию окислителей и высокой температуры, инертны в реакциях присоединения и легко вступают в реакции электрофильного замещения.
СПОСОБЫ ПОЛУЧЕНИЯ
Для получения бензола и его гомологов используются следующие способы:
1) Выделение из природных источников: каменного угля (примерно 1 %), нефти (ароматические нефти встречаются редко, поэтому нефть «ароматизируют»)
2) Дегидроциклизация алканов, содержащих С6 и более атомов углерода. Молекула алкана замыкается в цикл с последующим отщеплением 3-х молекул водорода при нагревании в присутствии катализаторов (оксидов хрома, молибдена, ванадия)

3) Дегидрирование циклоалканов происходит при применении в качестве катализатора платины на оксиде алюминия:

4) Полимеризация алкинов (реакция Зелинского). Реакция идет при нагревании до t=400 оС ацетилена и его гомологов над активированным углем
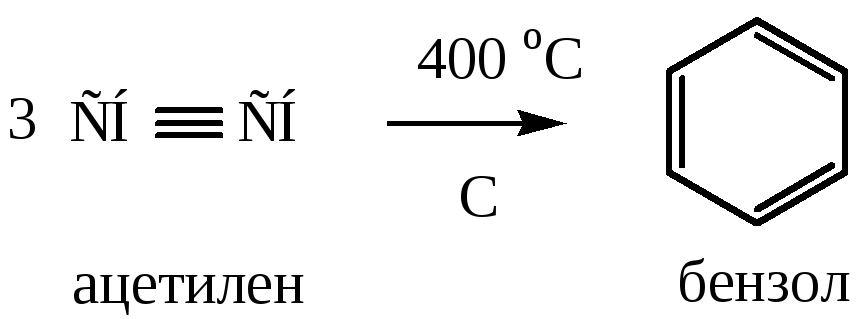
5) Реакция Вюрца-Фиттига протекает аналогично реакции Вюрца. При действии металлического натрия на смесь ароматического галогенопроизводного со вторым галогенопроизводным образуются гомологи бензола.
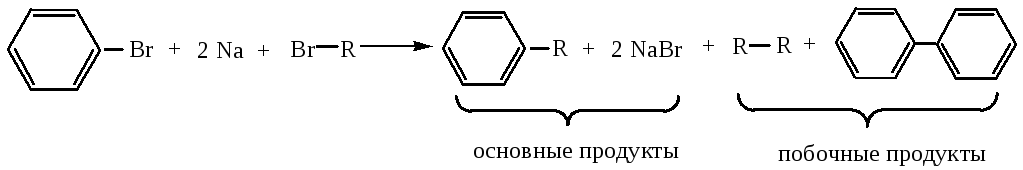
6) Алкилирование бензола по Фриделю-Крафтсу – способ введения в молекулу бензола алкильных радикалов (подробнее реакция будет рассмотрена в химических свойствах)

7) Декарбоксилирование солей ароматических карбоновых кислот происходит при их нагревании в присутствии твердой щелочи. В результате реакции могут быть получены как бензол, так и его гомологи.
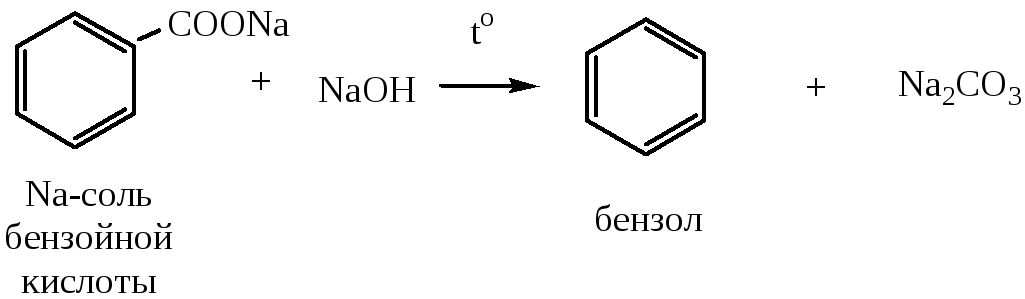
8) Методы восстановления могут быть использованы для получения гомологов бензола, содержащих в молекуле алкильные цепочки (т.к. бензольное кольцо восстанавливается очень трудно, можно использовать жирно-ароматические кетоны).
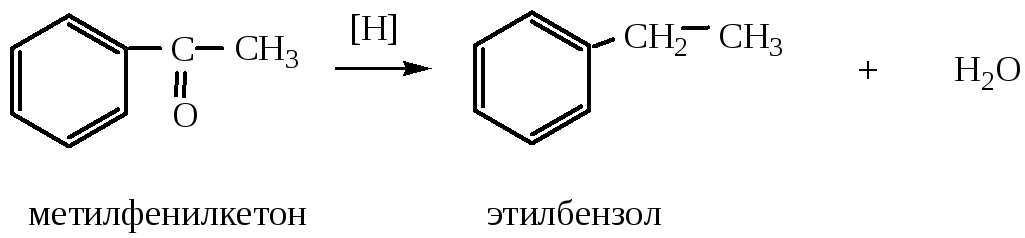
Физические свойства.
Одноядерные арены – жидкости, реже твердые вещества с высокими показателями преломления, часто обладают специфическим запахом, за что и получили название ароматических. Легче воды и практически в ней нерастворимы. Хорошо растворяются в органических растворителях. Температура плавления и кипения зависят от строения, общие закономерности их изменения в гомологическом ряду сохраняются. При работе с ароматическими веществами необходимо помнить, что практически все они токсичны.
