
Билет 2
Высаливание. При добавлении растворов солей щелочных и щелочноземельных металлов происходит осаждение белков из раствора. Обычнобелок не теряет способности растворяться вновь в воде после удаления солей методами диализа или гельхроматографии. Высаливанием белковобычно пользуются в клинической практике при анализе белков сыворотки крови и других биологических жидкостей, а также в препаративной энзимологии для предварительного осаждения и удаления балластных белков или выделения исследуемого фермента. Различные белкивысаливаются из растворов при разных концентрациях нейтральных растворов сульфата аммония. Поэтому метод нашел широкое применение в клинике для разделения глобулинов (выпадают в осадок при 50% насыщении) и альбуминов (выпадают при 100% насыщении).
Хромопротеиды (хромо... и протеиды), сложные белки, содержащие окрашенные простетические (небелковые) группы. Наиболее обширную группу Х. составляют железосодержащие белки гемопротеиды, к которым относятся цитохромы(переносчики электронов в процессах клеточного дыхания, при фотосинтезе, в системах гидроксилирования), некоторые ферменты (каталаза, пероксидаза), дыхательные пигменты (гемоглобин, миоглобин). У многих беспозвоночных животных функцию связывания кислорода выполняют гемоглобиноподобные белки эритрокруорины, а в крови некоторых многощетинковых червей — хлорокруорины. Вторую группу Х. составляют дыхательные пигменты крови беспозвоночных — гемеритрины (содержат негемовое железо) и гемоцианины (содержат медь). Третью группу Х. составляют ферменты, простетическая группа которых представлена рибофлавином, — флавопротеиды (переносчики электронов; играют важную роль в окислительно-восстановительных реакциях во всех животных клетках). К Х. относится и зрительный пурпур (родопсин) сетчатки глаза, содержащий в качестве хромофорной группы 11-цис-ретиналь. Термин "Х." выходит из употребления и всё чаще применяется главным образом по отношению к дыхательным пигментам крови
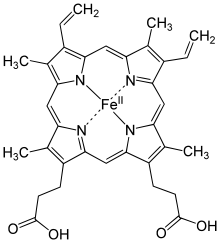 ГЕМ
ГЕМ
БИЛЕТ 3
Буферные свойства белков основаны на их амфотерности . В кислой среде белки проявляют слабощелочные свойства и нейтрализуют кислоты. В щелочной среде они реагируют как слабые кислоты. Фосфатный буфер крови состоит из смеси двузамещенного и однозамещенного фосфата натрия (Na2HPO4: NaH2PO4). Однозамещенный фосфат натрия слабо диссоциирует и проявляет кислые свойства. Двузамещенный фосфат натрия обладает выраженными щелочными свойствами. При накоплении в крови избытка кислот двузамещенный фосфат натрия образует с ними соответствующие соли и однозамещенный фосфат натрия:
Na2HPO4 +H2CO3↔NaHCO3 +NaH2PO4. При напряженной мышечной работе буферные системы оказываются не в состоянии нейтрализовать накапливающиеся в крови продукты неполного обмена (в частности, молочную кислоту). Реакция крови сдвигается в кислую сторону. Это явление называется метаболическим ацидозом. Последствия ацидоза ликвидируются в восстановительном периоде.
ГЛИКОПРОТЕИДЫ
гликопротеины, сложные белки, содержащие углеводы (от долей % до 80%). Мол. м. 15 000—1 000 000. Присутствуют во всех тканях животных, растений и в микроорганизмах. К Г. относятся мн. белки плазмы крови (церулоплазмин, трансфсррин, фибриноген, иммуноглобулины и др.), белки секретов слизистых желёз (муцины), опорных тканей (муконды), нек-рые ферменты (панкреатическая рибонуклеаза Б), гормоны (эритро-поэтнн, тиреотропин), структурные белки клеточных мембран. Г., входящие в состав клеточной оболочки, участвуют в ионном обмене клетки, иммунологич. реакциях, в дифференцировке тканей, явлениях межклеточной адгезии и т. д. В крови и тканях антарктич. рыб обнаружены Г.-антифризы, препятствующие образованию кристаллов льда в организме рыб при темп-ре ниже 0°С.
БИЛЕТ 4
Изоэлектрической точкой называют такую концентрацию водородных ионов, т. е. такое значение рН, при котором имеется равновесная концентрация положительных и отрицательных зарядов у белковой молекулы.
При изоэлектрической точке молекула белка электронейтральна и не передвигается в электрическом поле. В таком состоянии молекулы белка легко выпадают в осадок, чем и пользуются для разделения белковых веществ при их совместном присутствии.
Как видно из табл. 4, большинство белков имеют изоэлектри-чеекую точку при рН от 4,0 до 8,0. Изоэлектрическая точка фермента желудочного сока пепсина находится в резко кислой среде при рН 1,0, а химотрипсина при рН 8,1.
При изоэлектрической точке молекула белка электронейтральна и не передвигается в электрическом поле. В таком состоянии молекулы белка легко выпадают в осадок, чем и пользуются для разделения белковых веществ при их совместном присутствии.Большинство белков имеют изоэлектри-чеекую точку при рН от 4,0 до 8,0. Изоэлектрическая точка фермента желудочного сока пепсина находится в резко кислой среде при рН 1,0, а химотрипсина при рН 8,1. Белковые вещества в водной среде проявляют свойства амфо-терности, т. е. они ведут себя и как кислоты, имея карбоксильные группы, и как основания благодаря наличию аминных групп. Однако если раствор белка подкислять, то его кислотная диссоциация будет подавляться, белок заряжается положительно, образуется катион белка. Если добавлять щелочь, то щелочная диссоциация белка будет подавляться, белок заряжается отрицательно, появится анион белка. Следовательно, поведение белков в электрическом поле будет зависеть от аминокислотного состава их, что и используют для разделения белков на фракции при электрофорезе.
Если в белках преобладают аминокислоты, содержащие по две карбоксильные группы (глютаминовая и аспарагиновая кислоты), такие белки в электрическом поле будут передвигаться к аноду ( + ), а белки, содержащие основные аминокислоты (аргинин, лизин и гистидин), будут передвигаться к катоду ( - ). Различают электрофорез на гелях — крахмальном, агаровом, полиакриламидном и т. д.
В последнее время наиболее часто для разделения белков, содержащихся в биологических жидкостях, применяют сефадексы1, «молекулярные» сита. При этом белковые молекулы отделяются друг от друга в зависимости от величины и их электрического заряда. Для этой цели используют катиониты и аниониты.
