
1 Лекция. Физико-химические методы иследования
.pdf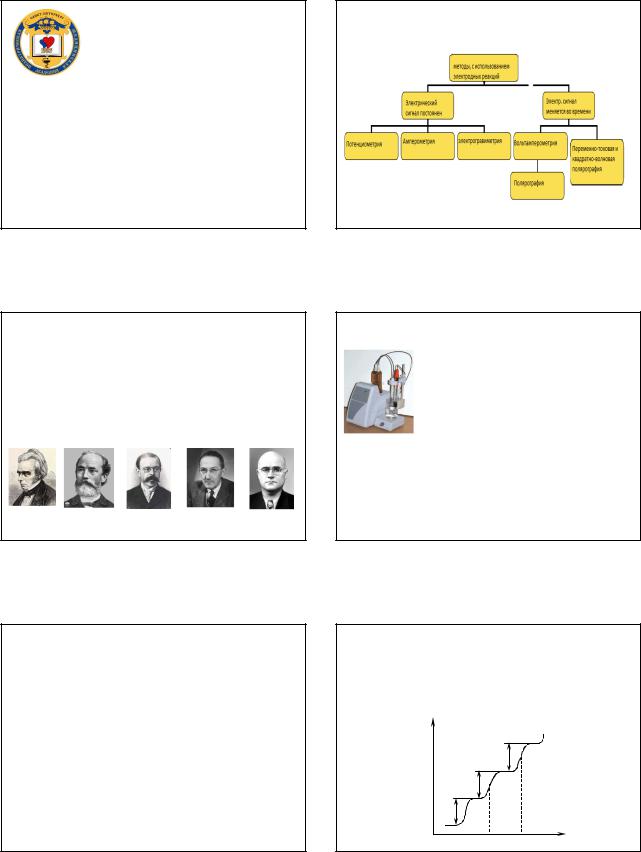
Электрохимические методы анализа
Кафедра общей имедицинской химии
Лекция
«Физико-химические методы исследования»
1
Электpохимические методы анализа основаны на процессах, пpотекающих на электpодах или межэлектpодном пpостpанстве.
Их достоинством является высокая точность и сpавнительная пpостота как обоpудования, так и методик анализа.
М.Фарадей Ф.Кольрауш В.Нернст Я.Гейровский Б.П.Никольский
3
По разновидностям аналитического сигнала электрохимические методы подразделяют на:
1)потенциометрию - измерениеравновесного потенциала индикаторного электрода;
2)кондуктометрию - измерение электропроводности исследуемого раствора;
3)электрогравиметрию - измерениемассы вещества, выделенного из раствора при электролизе;
3)кулонометрию - измерение количества электричества, необходимого для полного окисления или восстановления исследуемого вещества;
5)вольтамперометрию - измерение поляризационных характеристик электродов в реакциях с участием исследуемого вещества.
5
Инстpументом для электрохимических методов служит электpохимическая ячейка, пpедставляющая собой сосуд с pаствоpом электpолита, в котоpый погpужены как минимум два электpода.
Опpеделяемое вещество можетвходить как в состав электpолита, заполняющего ячейку, так и в состав одного из электpодов.
4
Вольтамперометрия основана на изучении поляризационных или
вольтамперных кривых (кривых зависимости силы тока I от напряжения Е), которые получают в процессе электролиза раствора анализируемого вещества при постепенном повышении напряжения с одновременной фиксацией при этом силы тока.
I |
|
|
|
|
|
|
|
IД(Cd) |
Cd |
|
|
|
IД(Ni) |
Ni |
|
|
|
IД (Zn) |
Zn |
|
|
|
|
E1/2(Zn) |
E1/2(Ni) |
E1/2(Cd) |
E |
6 |
|
|
|||||
1

Нижний предел устанавливаемых полярографическим методом концентраций составляет 10-5 – 10-6 моль/л.
Это означает возможность определения миллионных долей грамм вещества в 1 мл раствора
Вольтамперометрию, связанную с использованием ртутного капающего электрода (РКЭ), называют полярографией.
Ее открытие принадлежит чешскому ученому Я. Гейровскому
Ярослав Гейровский
(1890-1967)
В 1922, исследуя электролиз в электрохимической ячейке с ртутным капельным электродом, установил зависимость между природой веществ и их потенциалами окисления и восстановления.
В1924 г. , вместе с коллегой Масуцо Шикатой, сконструировал полярограф.
В1959, через 37 лет после создания метода полярографии, Нобелевский комитет присудил премию по химии
чехословацкому ученому. |
8 |
Вольтамперометрию широко используют для:
-качественного и количественного определения
различных электролитов, белков, гормонов, витаминов, ферментов в биологических жидкостях
-изучения газообмена у человека и животных
-определения вредных веществ в сточных водах и
воздухе промышленных предприятий
-определения ионов металлов амперометрическим
титрованием
9
При амперометрическом титровании ток прямо пропорционален концентрации электроактивного вещества
Графическоеизображение связи между полярографическим и амперометрическим титрованием:
А- полярограммырастворов соли цинкаразличной концентрации; Б- изменение силы тока в растворах соли цинка при титровании11.
Амперометрическое титрование
электрохимический метод анализа, основанный на измерении величин предельного диффузионного тока, наблюдаемого на отдельном электроде в процессе титрования.
id = КСα
Показатель степени а зависит от природы тока:
Диффузионный ток а=1 Адсорбционный ток а=0,5 Смешанный диффузионноадсорбционный 0,5< а <1
10
Впроцессе амперометрического титрования после прибавления отдельных порций реактиваотмечают силу тока при
напряжении, соответствующем величине предельного тока. По этим данным строят кривую амперометрического титрования в координатах сила тока – объем титранта и находят точку
эквивалентности.
Видкривой титрования зависитот того, какой компонентреакции титрования вступит в электродную реакцию:
-определяемого вещества;
-титранта;
-продукта реакции;
-специально введенного до титрования « индикатора».
2
1. Электрохимически активно определяемое вещество – Амперометрические кривые титрования только оно восстанавливается или окисляется на
электроде
I
|
V |
|
Титрование солей Fe2+ окислителями |
В этом случае на электроде протекает реакция окисления: |
|
|
Fe2+ - e Fe3+ |
и, следовательно, величина предельного тока будет зависеть |
|
от |
концентрации в растворе соли Fe2+. |
13 |
14 |
2. Электрохимически активен только титрант - он окисляется или восстанавливается на электроде
I
V
Титрование солей Zn 2+, Cd 2+, Mn 2+, Pb 2+, Cu 2+ ферроцианидом
В этом случае на электроде протекает реакция окисления ферроцианид-ионов, предельный ток пропорционален концентрации ферроцианидав растворе.
15
3. Восстанавливаются или окисляются на электроде два вещества - определяемое соединение и титрант
I
V
Титрование солей Cu 2+, Cd 2+, Zn 2+ ортооксихинолином
В этом случае на электроде до момента эквивалентности восстанавливаются ионы Cu 2+, Cd 2+, Zn 2+ а ортооксихинолин
- послемомента эквивалентности.
16
4. Электрохимически активны как определяемое вещество, так и титрант, причем одно восстанавливается, другое – окисляется
I
V
Титрование соли Fe3+ , раствором TiCl3
До момента эквивалентности на электроде восстанавливаются ионы Fe3+ , величина предельного тока пропорциональна концентрации соли Fe3+ в растворе. Послемомента эквивалентности на электроде протекает процесс окисления соли Ti3+ , величина предельного тока пропорциональна
концентрации последней в растворе. |
17 |
|
5. Электрохимически активен только продукт химической реакции - на электроде протекает восстановление или окисление образующегося в результате химической реакции соединения
I
V
Титрование соединений пятивалентного мышьякаиодидами. В результате химической реакции образуется иод, который восстанавливается на вращающемся платиновом электроде. Предельный ток в этом случае прямо пропорционален
концентрации иода, образующегося в растворе. |
18 |
3

6. Реагирующие вещества и продукты реакции |
|
Значение амперометрического титрования |
||
электрохимически неактивны. Тогда в раствор |
|
1. Выбирая тот или иной потенциал индикаторного электрода, |
||
вводится «полярографический индикатор» |
|
|||
|
|
|
|
можно проводить анализ данного веществав присутствии |
|
I |
|
различных других веществ. |
|
|
|
|
|
2. Дает возможность определять различные вещества в весьма |
|
|
|
||
|
|
V |
|
разбавленных растворах. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Титрование с «полярографическим индикатором» - солью Fe3+ , |
|
|
||
вводимым перед титрованием соединений алюминия или магния |
|
|
||
|
раствором фторида |
|
|
|
В этом случае до точки эквивалентности происходит |
|
|
||
взаимодействие ионов фтора с определяемым веществом с |
|
|
||
образованием прочных соединений; только после точки |
|
|
||
эквивалентности ионы фтора смогутвзаимодействовать с Fe3+19 |
|
20 |
||
3.Исключаются цветные индикаторы
4.Метод позволяет проводить определение в мутных и окрашенных растворах (чувствительность амперометрического метода значительно выше потенциометрического);
21
5.Могут быть использованы самые разнообразные химические реакции (осаждения, окисления – восстановления, комплексообразования и иногда нейтрализации)
22
6.Подбирая тотили иной реактив можно определить большинство элементов периодической системы (введение органических реактивов, различные комплексоны)
7.Помимо практического применения для аналитических целей, и как метод исследования (применение амперометрического метода для определения конечной точки при кулонометрическом титровании)
Кулонометрия
В основе кулонометрическихметодов лежат законы электролиза Фарадея:
Количество восстановленного или окисленного в процессе электролиза вещества прямо пропорционально количеству прошедшего электричества.
Массы различных веществ, выделенных или растворенных при прохождении одного и того же количества электричества, пропорциональны их электрохимическим эквивалентам.
4

Различают два основных вида кулонометрических определений:
–прямую кулонометрию
–кулонометрическое титрование.
В методах прямой кулонометрии электрохимическому превращению непосредственно в кулонометрической ячейке подвергается анализируемое вещество.
25
В методе кулонометрического титрования электролизу подвергается вспомогательноевещество, а далее продукт электролиза – титрант – реагирует с определяемым веществом.
Кулонометрическиеопределения могут проводиться при постоянном потенциале (потенциостатическая кулонометрия) и постоянной силе тока (амперостатическая кулонометрия).
В прямой кулонометрии широко применяют потенциостатическиеметоды. Массу определяемого вещества рассчитывают по формуле Фарадея.
26
M n
m n·FMe It
Число молей анализируемого вещества равно произведению силы тока на время, необходимое для образования титранта в количестве, достаточном для достижения конечной точки титрования с учетом стехиометрии. Химические стандарты не требуются. К титрантам, которыеобразуются в ходе электрохимических процессов, относятся H+, OH–, Br2 и I2.
27
Электрофорез
Электрофорез - перемещение частиц дисперсной фазы в жидкой или газообразной среде под действием внешнего электрического поля
29
В титровании используются химические реакции различных типов: кислотно-основные, окислительно-восстановительные, комплексообразования и др.
Различныевосстановители (Fe2+ , Sn2+ , Sb3+ , As3+ и др.) могут быть оттитрованы, например, перманганатом, который легко генерируется из MnSO4 в ячейке с платиновым анодом.
При анодном растворении хрома в серной кислоте получается дихромат-ион, который такжеможет быть использован для этого титрования.
Широко применяют также свободный бром, генерируемый на платиновом аноде из бромида калия в соляной кислоте.
28
С помощью электрофореза удаётся покрывать мелкими частицами поверхность, обеспечивая глубокое проникновениев углубления и поры.
Различают две разновидности электрофореза: катафорез — когда обрабатываемая поверхность имеет отрицательный электрический заряд (то есть подключена к отрицательному контакту источника тока)
анафорез — когда заряд поверхности положительный.
30
5

Электрофорез применяют в физиотерапии, для окраски автомобилей, в химической промышленности, для осаждения дымов и туманов, для изучения состава растворов и др.
Электрофорез является одним из наиболееважныхметодов для разделения и анализа компонентов веществ в химии, биохимии и молекулярной биологии.
31
Электрофорез в медицине
Лечебное вещество наносится на прокладки электродов и под действием электрического поля проникает в организм через кожные покровы (в терапии, неврологии, травматологии и др.) или слизистые оболочки (в стоматологии, ЛОР, гинекологии и др.) и влияет на физиологическиеи патологические процессы непосредственно в месте введения. Электрический ток также
оказывает нервно-рефлекторноеи гуморальное действие. |
32 |
|
Преимущества лечебного электрофореза
1.Введениемалых, но достаточно эффективных доз действующего вещества;
2.Накоплениевещества и создание депо, пролонгированность действия;
3.Введение в наиболее химически активной форме — в видеионов;
4.Возможность создания высокой местной концентрации действующего вещества без насыщения им лимфы, крови и других сред организма;
5.Возможность введения вещества непосредственно в очаги воспаления, блокированные в результате нарушения локальной микроциркуляции ;
6.Лечебное вещество неразрушается,
как например, при введении per os;
7. Слабый электрический ток благоприятно влияет на реактивность и иммунобиологический статус тканей.
33
Противопоказания к проведению электрофореза:
1.Острые гнойныевоспалительные заболевания
2.Лихорадка
3.Тяжелая форма бронхиальной астмы
4.Дерматит или нарушение целостности кожи в местах наложения электродов
5.Злокачественные новообразования.
В биохимии и молекулярной биологии электрофорез используется для разделения макромолекул — белков и нуклеиновых кислот (а также ихфрагментов).
35
Фотометрические методы анализа
Фотометрический анализоснованнаизмерении поглощения светавеществом.
36
6
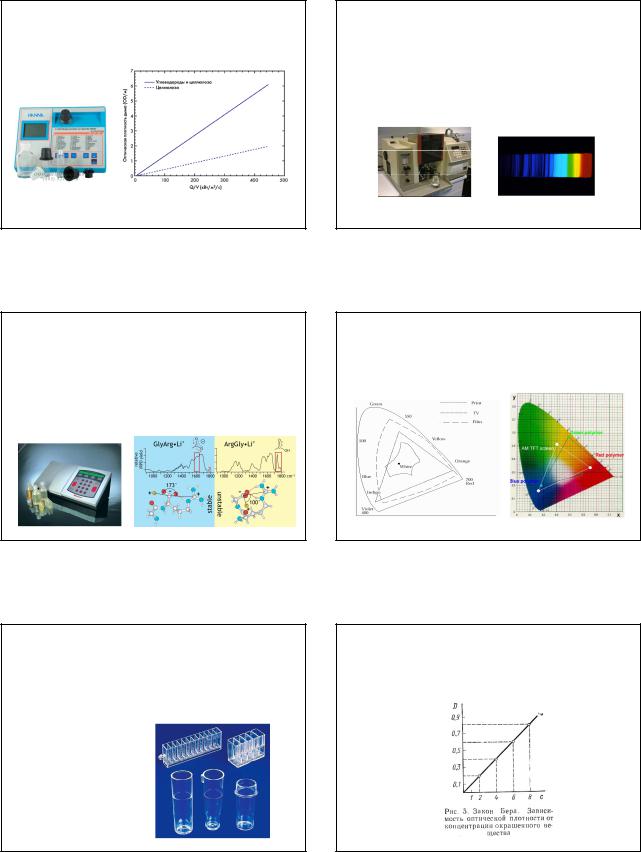
Основнаяизмеряемая характеристика: оптическая плотность – величина, значениекоторой линейно зависитотконцентрации анализируемого вещества.
37
Фотометрический анализвключает:
-спектрофотометрию
-фотоколориметрию
-колориметрию (визуальнуюфотометрию)
38
Фотометрическиеметодыанализаприменяются для контроля разнообразных производственныхпроцессов.
Эти методымогутбыть применены для анализабольшихи малыхсодержаний, но особенно ценнойихособенностью является возможность определения примесей (до 10-5...10-6%).
Методы абсорбционной спектроскопии используютв химической,металлургической, фармацевтическойи других отраслях, атакжевмедицинеи сельскохозяйственном производстве.
Закон колориметрии
Зависимость оптической плотности от концентрации вещества в раствореи толщины поглощающего слоя известна под названием закона Бугера –Ламберта – Бера (основной закон колориметрии):
Оптическая плотность растворов при прочих равных условиях прямо пропорциональна концентрации веществаи толщине поглощающего слоя.
41
Колориметрия.
(лат. color цвет + греч. metreō измерять, определять) — совокупность методов количественного химического анализа, основанных на зависимости интенсивности окраски раствора от концентрации в нем окрашенного вещества;
40
Графическоеизображение закона Бера. Зависимость оптической плотности отконцентрации веществав
растворепринято выражать графически; наоси абсцисспри этом откладываютзначениеконцентраций, анаоси ординат – соответствующуювеличинуоптической плотности. При этом согласно основномузаконуколориметрии получается прямая линия, проходящая через начало координат.
42
7

В большинстве случаев сущность колориметрических определений состоитв следующем: определяемый компонент (простой ион, сложныйион, органическое соединение) при помощи химической реакции переводятв окрашенноесоединение, послечего каким-либо способом измеряютинтенсивность окраски полученногораствора.
Применение фотометрии
Для определения содержания:
—медного купоросав растворе
—хлоравводе
—красящихначалв красильныхдеревах, в индиго, вкошенили
—в гемоглобинакрови
—обесцвечивающей способностиживотного угля на сахарных заводах
В промышленности колориметрию используются для определения степени очистки керосина, смазочных масел, пива,вина.
44
Применение фотометрии в офтальмологии
Наиболеедостоверным признаком степени выраженности атрофическихизменений при демиелинизирующих заболеванияхявляется увеличениепроцента синего цвета с преимущественным перераспределениемв височномсегменте.
Методы видеоофтальмографии и колориметрического анализа головки зрительного нерва (ГЗН) имеютсамостоятельное диагностическоеи прогностическоезначениеи позволяютс высокой достоверностьювыставить диагноз ЧАЗН демиелинизирующего генеза
45
Применение.
—приисследовании эмульсийи других коллоидныхсистем
—в метеорологии, физикеморя
—приизучении некоторыхбиологическихобъектов
—для определения концентрации антигенов, поскольку при добавлениик ним антител образуются иммунныекомплексы, рассеивающиепроходящий свет
—позволяетсвысокой точностьюопределить концентрацию IgG, IgA, IgM, подклассов IgG, C3, С4,фактораВ, С-реактивногобелкаи некоторыхдругихсывороточныхбелков.
47
Нефелометрия.
-(отгреч. nephéle —облако и ...метрия), совокупность методов измерения интенсивности рассеянного в данной среде видимого или ультрафиолетового света сцелью определения концентрации, размераи формы диспергированныхчастиц в дисперсныхсистемах.
Измеряя интенсивность светорассеяния врастворахпри разныхконцентрациях, определяютмолекулярныемассы полимеров. Угловая зависимость светорассеяния для большихчастиц, атакжестепень поляризации рассеянного света даётинформациюо формечастиц (илимакромолекул).
46
Эмиссионный спектральный анализ
Эмиссионный спектральныйанализ основанна получении и изучении спектров испускания (эмиссионных спектров).
Поположению иотносительной интенсивности отдельных линий в этих спектрах проводят качественный спектральный анализ.
Количественный спектральный анализ основанна том, что интенсивность спектральных линий элемента зависитот концентрации этого элемента в пробе.
48
8

Пламенная эмиссионная спектроскопия.
Анализируемыйраствор вводится в пламя горелки ввиде аэрозоля. При этомрастворитель испаряется, асоли металла диссоциируютнаатомы, которыепри определенной температуревозбуждаются.
Возбужденныеатомы, переходя в нормальное состояние, излучаютсветхарактерной частоты, интенсивность которого измеряется фотоэлементом.
49
Методами эмиссионного спектрального анализа выполняется значительнаячасть анализов в металлургической промышленности.
Анализируется исходноесырьеи готовая продукция. Существеннуюроль этотметодиграетдля анализа природныхи сточныхвод, почвы, атмосферыи других объектов окружающей среды, атакжевмедицинеи биологии.
Атомно - абсорбционный анализ
Физическую основу атомно-абсорбционной спектроскопии составляет поглощение резонансной частоты атомами в газовой фазе.
И если в эмиссионной спектроскопии концентрация вещества связывалась с интенсивностьюизлучения, то в атомно-абсорбционной спектроскопии аналитический сигнал связан с количеством невозбужденных атомов (уменьшение интенсивности излучения).
51
Методы атомно-абсорбционной спектроскопии могут быть использованыили используются в анализе практически любого технического или природного объекта, особенно там, где необходимо определить небольшие содержания элементов.
52
Методики атомно-абсорбционного определения разработаны более чем для 70 элементов периодической системы Д.И. Менделеева.
Флуоресцентная спектроскопия
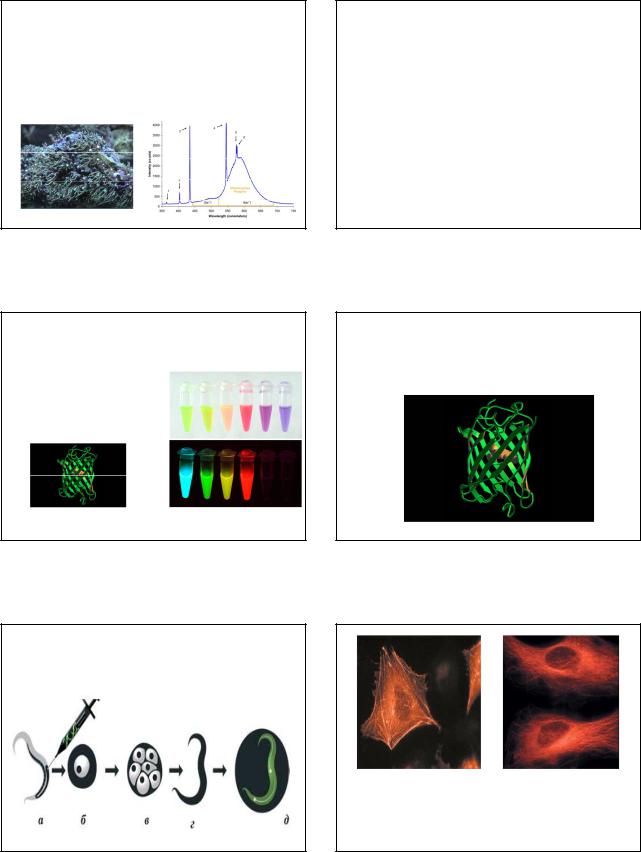
Флуоресцентная спектроскопия –весьмачувствительный метод анализа химического составаобразца, позволяющий обнаруживать следовыеколичествавеществ и дажеих отдельныемолекулы.В качествеисточников возбуждающего излученияособенно эффективнылазеры.
54
9
Для экспериментов по флуоресцентной спектроскопии в газовойфазе наиболееважным параметром является ширина линии.
Важнымвкладомв развитиефлуоресцентной спектроскопии явилась разработкаультрабыстрыхлазеров, способных генерировать пикосекундныеифемтосекундныеимпульсы для флуоресцентной спектроскопии свременнымразрешением.
Такиелазерыпозволили производить возбуждениевещества за время,многоменьшеевременижизни возбужденного состояния.
Собственная флуоресценция
Белки содержат только три собственных флуоресцирующих хромофора
триптофан!!! (изучают на практике) тирозин фенилаланин
Практическое применение флуоресценции в биологии и медицине
При изучении белков используются два типа флуоресцирующих хромофоров:
•собственные флуоресцирующие хромофоры, содержащиеся в самих макромолекулах
•внесенные флуоресцирующие хромофоры, добавленные
всистему и обычно связывающиеся с одним из компонентов. Вначалерассмотрим собственную флуоресценцию
56
Зелёный флуоресцирующий белок состоитиз 238 аминокислот.
Аминокислотная цепочка свёрнута в форме «бочки». Внутри расположена хромофорная группа, которая поглощает синий свет, а излучает зелёный
58
Используя ДНК-технологии, встроен ген зелёного флуоресцирующего белкав генный переключатель, запускающий работу шести рецепторных нейронов нематоды
59
Клеточный белок актин, меченный красным флуоресцирующим белком, выглядит под флуоресцентным микроскопом как изящная пирамидка.
Изящные облака тубулина светятся в флуоресцентном микроскопе красным светом.
60
10
