
По молекулярке / белки 1 вопрос
.docЭлементарный состав и структура белковых молекул.
Белки – высокомолекулярные полимерные органические вещества, определяющие структуру и жизнедеятельность клетки и организма в целом. Белки – самый распространенный в живой природе класс биополимеров, составляющий большую часть сухого вещества животных (50-80 %) и обладающий наибольшим по сравнению со всеми другими веществами органический природы разнообразием структуры и функций. Именно белки определяют фенотип любого организма, формируют облик всех живых систем. Их строение запрограммировано нуклеотидной последовательностью соответствующих генов.
Функции белков:
-
Энергетическая. При распаде 1 г белка выделяется 17,6 кДж энергии.
-
Каталитическая. Служат катализаторами биохимических реакций. Катализаторы - ферменты. Ферменты ускоряют биохимические реакции, но не входят в состав конечных продуктов. Ферменты строго специфичны. Каждому субстрату соответствует свой фермент. Название фермента включает название субстрата и окончание "аза": мальтаза, рибонуклеаза. Ферменты активны при определенной температуре (35-45°С).
-
Структурная. Белки входят в состав всех биологических мембран.
-
Транспортная. Например, гемоглобин переносит кислород и СО2 в крови позвоночных, трансферрин осуществляет транспорт Fe (железа).
-
Защитная. Защита организма от вредных воздействий: выработка антител. Антитела – это белки (иммуноглобулины - Ig).
-
Сократительная. Благодаря наличию белков актина и миозина в мышечных волокнах происходит сокращение мышц.
Элементарный состав: в состав белков входят углерод, кислород, водород, азот (C,O,H,N).
Аминокислотный состав белка. Мономерами белка являются аминокислоты. Белки построены из 20 различных аминокислот. Формула аминокислоты:
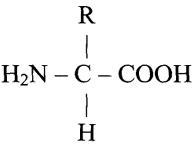
В состав аминокислот входят: 1) -NH2 – аминогруппа, обладающая основными свойствами; 2) -СООН – карбоксильная группа, имеет кислотные свойства; 3) R – боковая цепь (радикал). Аминокислоты отличаются друг от друга своими радикалами. Аминокислоты – амфотерные соединения (т.к. в растворе они могут выступать как в роли кислот, так и оснований). Они соединяются друг с другом в молекуле белка с помощью пептидных связей.
Единственной протеиногенной аминокислотой, не имеющей свободной аминогруппы, является пролин, это иминокислота.
Схема конденсации аминокислот (образование пептидной связи).
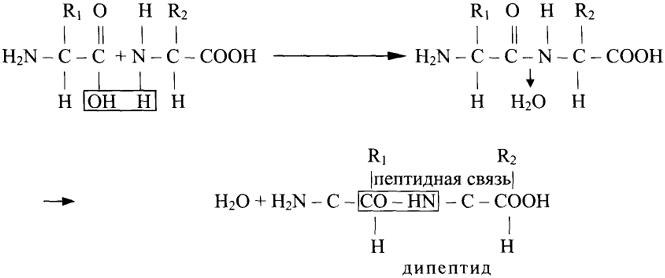
Пептиды – органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью. Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. Радикалы в образовании пептидных связей не участвуют. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом – свободная карбоксильная группа (его называют С-концом).
Пространственная организация белковых молекул. Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию.
В 1959 г. датский биохимик Кай Линдерстрем-Ланг предложил различать 4 уровня структурной организации белков: первичную, вторичную, третичную и четвертичную структуры белка.
Первичная структура белка – последовательность аминокислот в полипептидной цепи (например, инсулин, лизоцим). Первой была расшифрована аминокислотная последовательность инсулина (Фредерик Сангер, 1953). Она состоит из 51 аминокислотного остатка и организована в виде двух полипептидных цепей (цепь А – 21 остаток и цепь В – 30 остатков) ковалентно связанных между собой дисульфидными мостиками.
Для анализа и расшифровки аминокислотной последовательности используют метод секвенирования (sequence - последовательность). Созданы автоматические приборы – секвенаторы, которые позволяют в автоматическом режиме осуществлять секвенирование фрагментов полипептидных цепей длиной до 50 аминокислотных остатков. Вначале устанавливается число цепей, затем разделяют эти цепи на фрагменты, пригодные для автоматического секвенирования. Фрагментацию цепей производят с помощью ферментов (трипсина, химотрипсина, термолизина и др.) или химическим методом (обработка бромцианом). Секвенирование – длительный и трудоёмкий процесс, поэтому чаще для определения первичной структуры используют методы генетической инженерии (анализ нуклеотидной последовательности ДНК). Сопоставление первичных структур нормальных и аномальных белков позволяет раскрыть основы патологических процессов, включая генетические заболевания. Именно этот подход выявил причину серповидно-клеточной анемии – болезни крови, которая возникает из-за точечной мутации гена, кодирующего последовательность β-цепи гемоглобина, эритроциты имеют форму серпа. Замена одного остатка Glu (глутаминовой кислоты) в нормальном гемоглобине типа А на остаток Val (валин) приводит к появлению аномального гемоглобина типа S, не способного в достаточной мере связывать кислород, что приводит к развитию кислородной недостаточности в тканях человека, наблюдаемой при этом заболевании.
Белки первичной структуры могут с помощью водородных связей соединяться в спираль и образовывать вторичную структуру.
Вторичная структура белка – упорядоченное расположение отдельных участков основной полипептидной цепи, без учёта расположения радикалов, стабилизированное водородными связями. Типы вторичной структуры: 1) α-спирали, напоминающие растянутую пружину (например, α-кератин, его волокна обеспечивают прочность кожи); 2) β-слой (β-складчатый лист) (например, белок β-фиброин шелка, большое количество водородных связей делает шелк очень гибким и прочным).
В отличие от α-спирали в β-структурах водородные связи возникают не внутри цепи, а между параллельно идущими участками цепи. Большинство складчатых листов содержат не более 6 цепей. Практически не существуют белки, молекулы которых на 100% имеют α-спиральную или β-структуру.
Типы белков вторичной структуры:
-
тип α (содержат только α-спирали, например, миоглобин, белок вируса табачной мозаики),
-
тип β (обладают только β-структурами, например, нейраминидаза вируса гриппа);
-
тип α+β (содержат α-спирали в β-структуры, отчетливо разделенные в пространстве вдоль цепи, например, рибонуклеаза, лизоцим куриного яйца);
-
тип α/β (более сложное строение, с перемежающимися участками α-спиралей в β-структур, напоминает слоёный пирог или сэндвич, например, карбоксипептидаза).
Третичная структура белка – укладка полипептидных цепей в глобулу (шар). Изучение третичной структуры выполнятся методом рентгеноструктурного анализа. Большинство белков имеют третичную структуру. Аминокислоты активны только на поверхности глобулы. В стабилизации третичной структуры принимают участие: 1) ковалентные связи (между 2-мя остатками цистеинов - дисульфидные мостики); 2) ионные связи между противоположно заряженными радикалами; 3) водородные связи; 4) гидрофильно-гидрофобные связи образуются между неполярными радикалами в водной среде.
Четвертичную структуру – агрегация 2-х или большего числа глобулярных структур (например, гемоглобины млекопитающих, фермент альдолаза из скелетных мышц кролика, каталаза - фермент разрушения активных форм кислорода). Отдельные полипептидные цепи, входящие в состав белков, называются субъединицы, или протамеры, из которых формируется эпимолекула такого белка-мультимера. Субъединицы не обладают биологической активностью и приобретают ее при определенном способе пространственного объединения в эпимолекулу. Четвертичная структура поддерживается исключительно силами слабых взаимодействий, поэтому она достаточно лабильное образование и менее прочное, чем третичная и тем более вторичная структура. Белки, обладающие четвертичной структурой, содержат чётное число субъединиц (димеры, тетрамеры, гексамеры, октамеры и т.д.), что отражает общий принцип симметрии, свойственный живой природе.
Гемоглобин (2α2β) – тетрамер - образован 2-мя α-субъединицами (141 аминокислотный остаток) и 2-мя β-субъединицами (146 аминокислотных остатков), С каждой субъединицей связана молекула гемма, содержащая железо.
Крупные белковые молекулы в природе – ферритины, служащие для связывания и депонирования железа у различных видов животных и растений, представляют собой сферическую молекулу, из 24 субъединиц, между ними располагаются полости (каналы) для проникновения оксидов железа. Внутри центральной полости ферритина насекомых могут быть связаны 3500 атомов железа на 1 молекулу такого белка-мультимера.
Процесс формирования (сворачивания) пространственной структуры белка – фолдинг.

Рис. Различные структуры молекул белка. 1-первичная; 2-вторичная; 3-третичная; 4-четвертичная.
При воздействии высокой температуры, ультрафиолетовых лучей, кислот, радиации, солей тяжелых металлов и других факторов может происходить разрушение белковой молекулы. Это явление называется денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся более слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка, и как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
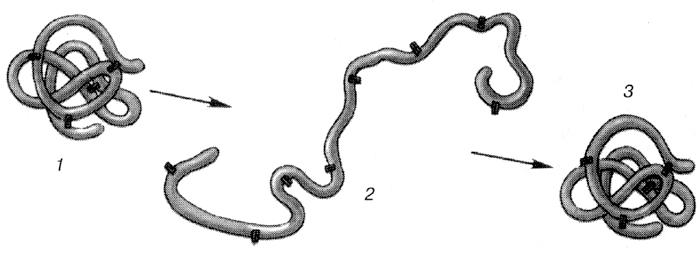
Рис. Денатурация белка. 1-молекула белка до денатурации; 2-денатурированный белок; 3-восстановление исходной молекулы белка.
В зависимости от аминокислотного состава, белки бывают полноценными – содержат весь набор аминокислот; неполноценными – какие-то аминокислоты в их составе отсутствуют.
Белки бывают простые и сложные. Простые белки состоят только из аминокислот: например, альбумины, глобулины, фибриноген, миозин. Сложные белки состоят из аминокислот и других соединений: например, металлопротеиды, гликопротеиды, липопротеиды, нуклеопротеиды.
В природе существует два вида белковых молекул: нитевидные (фибриллярные) и шарообразные (глобулярные).
Молекулярная масса белков варьирует от 57 до 186 Да (дальтон), среднее значение 110. Белок с молярной массой 44000 Да содержит 400 аминокислотных остатков.
Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот, чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н+ определяют буферные свойства белков; один из самых мощных буферов – гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген) и нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Белки отличаются видовой специфичностью. Каждый вид животных имеет свои белки. В одном и том же организме каждая ткань имеет свои белки — это тканевая специфичность. Организмы характеризуются также индивидуальной специфичностью белков.
