
5M
.pdf
P 2m v |
1 |
|
n Sv t |
|
1 |
nm v2 |
S t . |
|
0 |
6 |
|
|
|
3 |
0 |
|
|
|
|
|
|
|
|
|
||
Тогда давление газа, оказываемое им на стенку сосуда, |
||||||||
|
p |
|
P |
1 |
nm v2 . |
(1.14) |
||
|
|
|
|
|||||
|
|
|
|
|||||
|
|
|
t S |
3 |
|
0 |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
||
Если газ в объеме V содержит N молекул, движущихся со скоростями v1 ,v2 ,....vN , то целесообразно рассматривать среднюю квадратную ско-
рость
v |
|
|
|
1 |
|
N |
v2 |
|
, |
(1.15) |
|
кв |
|
|
|
|
|
||||||
|
|
|
|
|
|||||||
|
|
|
N i |
|
|
i |
|
|
|||
|
|
|
|
1 |
|
|
|
|
|||
характеризующую всю совокупность молекул газа. |
|
||||||||||
Уравнение (1.14) с учетом (1.2) примет вид |
|
|
|||||||||
|
p |
1 |
|
nm |
|
v |
|
|
2 . |
(1.16) |
|
|
|
3 |
|
0 кв |
|
|
|||||
|
|
|
|
|
|
|
|||||
Выражение (1.16) называется основным уравнением молекулярно-
кинетической теории идеальных газов. |
|
|
|
|
|||||||||
Учитывая, что n |
N |
, получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pV |
|
1 |
3 |
Nm |
v |
2 . |
(1.17) |
|||
|
|
|
|
|
|
|
|
0 |
кв |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
Так как масса газа m |
Nm0 , то уравнение (1.17) можно переписать в |
||||||||||||
виде |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pV |
1 |
3 |
m v |
2 . |
|
|
||||
|
|
|
|
|
|
|
кв |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для одного моля газа m |
M ( M — молярная масса), поэтому |
|
|||||||||||
|
|
|
pV |
1 |
3 |
M v |
2 , |
|
|
||||
|
|
|
m |
|
|
|
|
кв |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
где Vm – молярный объем. С другой стороны, по уравнению Клапейрона — Менделеева, pVm RT . Таким образом,
RT |
1 |
3 |
M v |
2 , |
|
|
|
|
|
|
|
кв |
|
||||
|
|
|
|
|
||||
откуда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
|
3RT |
, |
(1.18) |
|
|
|
|
|
|
||||
|
кв |
|
|
M |
|
|||
|
|
|
|
|
|
|||
11

Так как M m0 N A , где m0 |
— масса одной молекулы, a N A — постоян- |
|||||||||||
ная Авогадро, то из уравнения (1.18) следует, что |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
3RT |
|
|
|
3kT |
, |
(1.19) |
|
|
|
|
|
|
||||||||
|
|
кв |
|
|
m0 N A |
|
|
|
m0 |
|
||
|
|
|
|
|
|
|
|
|
||||
где k |
R |
k=R/NА – постоянная Больцмана. Отсюда найдем, что при ком- |
||||||||||
|
||||||||||||
|
N A |
|
|
|
|
|
|
|
|
|
|
|
натной температуре молекулы кислорода имеют среднюю квадратичную скорость 480 м/с, водорода – 1900 м/с. При температуре жидкого гелия те же скорости будут соответственно 40 и 160 м/с.
1.5.Закон Максвелла о распределении молекул идеального газа по скоростям и энергиям теплового движения
При выводе основного уравнения молекулярно-кинетической теории молекулам задавали различные скорости. В результате многократных соударений скорость каждой молекулы изменяется по модулю и направлению. Однако из-за хаотического движения молекул все направления движения являются равновероятными, т. е. в любом направлении в среднем движется одинаковое число молекул.
Закон Максвелла описывается некоторой функцией f v , называемой
функцией распределения молекул по скоростям. Если разбить диапа-
зон скоростей молекул на малые интервалы, равные dv , то на каждый интервал скорости будет приходиться некоторое число молекул dN v , имеющих скорость, заключенную в этом интервале. Функция f v опре-
опре-
деляет относительное число молекул dN v , скорости которых лежат в
N
интервале от v до v dv, т. е.
f v |
dN v |
. |
|
||
|
Ndv |
|
Применяя методы теории вероятностей. Максвелл нашел функцию f v — закон о распределения молекул идеального газа по скоростям:
|
|
3 |
|
|
|
m0v2 |
|
|
|
|
m0 |
|
|
|
|
|
|
|
|
f v 4 |
2 |
v |
2 |
exp |
. |
(1.20) |
|||
2 kT |
|
|
|
2kT |
|||||
|
|
|
|
|
|
|
|
||
12

Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью. Значение наиболее вероятной скорости можно найти продифференцировав выражение (1.20) (постоянные множители опускаем) по аргументу v , приравняв результат нулю и используя условие для максимума выражения f v :
Значения v = 0 и v = соответствуют минимумам выражения (1.20), а значение v , при котором выражение в скобках становится равным нулю, и есть искомая наиболее вероятная скорость vв :
vв |
|
2kT |
|
|
2RT |
|
(1.21) |
|
|
|
|
||||
m0 |
|
|
M |
||||
|
|
|
|
|
|
Средняя скорость молекулы  v
v (средняя арифметическая ско-
(средняя арифметическая ско-
рость) определяется по формуле
|
|
|
|
|
|
|
|
|
|
v |
1 |
|
|
vdN v |
vf |
v dv. |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
N 0 |
0 |
|
|
|
||||||||
|
Подставляя сюда f v и интегрируя, получаем |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
8kT |
8RT |
. |
(1.22) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
m0 |
M |
|
||||||||
|
Скорости, |
характеризующие |
состояние газа: 1) наиболее вероятная |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
v |
|
|
2RT |
; |
|
|
2) средняя v |
|
|
|
|
8RT |
1,13v ; |
3) средняя квадратичная |
|||||||||
|
в |
M |
|
|
|
|
|
|
|
M |
в |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
vкв |
|
|
3RT |
1,22vв . |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
1.6. Внутренняя энергия системы
В понятие внутренней энергии включается кинетическая энергия хаотического движения молекул и потенциальная энергия взаимодействий молекул. Внутренняя энергия является функцией состояния системы. Изменение внутренней энергии системы при переходе из одного состояния системы в другое равно разности значений внутренней энергии системы в этих состояниях.
Внутренняя энергия идеального газа:
13

U |
i m |
RT . |
(1.17) |
|||
|
|
|
||||
2 M |
||||||
|
|
|
||||
где i – число степеней свободы молекул газа (числом степеней свободы называется количество независимых величин, с помощью которых может быть задано положение системы).
Для одноатомной молекулы i 3 (только поступательное движение). Для двухатомной молекулы i 5 (3 поступательных и 2 вращательных движения). Для трехатомной молекулы i 6 (3 поступательных и 3 вращательных движения).
2. МЕТОД РАБОТЫ
В данной работе необходимо изучить зависимость давления заданной массы воздуха от его объема при постоянной температуре, измерить изотермический модуль всестороннего сжатия и определить массу воздуха.
2.1. Определение изотермического модуля всестороннего сжатия
Состояние газа в термодинамике описывается измеренными в экспериментах параметрами. К ним относится объем V, давление Р, масса m, температура Т и другие.
В общем случае, уравнение состояния представляет собой сложную зависимость
P P V ,T . |
(2.1) |
Особый интерес представляет уравнение состояния в дифференциальной форме, справедливое для любого вида зависимости (2.1). Для его вывода найдем дифференциал движения как функцию двух переменных:
dP |
dP |
dV |
dP |
dT . |
|
|
|
||||
dV |
dV |
||||
|
T |
V |
Индекс у производной показывает, что соответствующий параметр остается постоянным.
Применим полученное равенство к изобарическому процессу, то есть к процессу, при котором давление постоянно (P = const, dP = 0). Находим.
dV |
|
dP |
dV |
T . |
(2.2) |
||
|
|
|
|
|
|||
dT |
P |
dT V |
dP |
||||
|
|
||||||
При выводе (2.2) используется равенство.
14

dV dP
dP T dV
1
T
Определим следующие характеристики вещества:
– термический коэффициент давления |
1 |
|
|
dP |
; |
||||
|
|
|
|
|
|
|
|||
P |
dT |
||||||||
|
V |
||||||||
– коэффициент объемного расширения |
1 |
|
|
dV |
; |
||||
|
|
|
|
|
|
|
|||
V |
|
dT |
|||||||
|
|
T |
|||||||
– изотермический модуль сжатия (далее просто модуль сжатия)
kV dP . dV T
Перепишем формулу (2.2) в дифференциальной форме
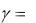 Pk .
Pk .
Для расчета модуля сжатия удобно построить изотерму в осях давление – обратный объем (P,J) где J=1/V. На диаграмме, приведенной на рис 2.1, процесс изображается прямой линией ( Р – изменение давления, J – изменение обратного объема). Тангенс угла наклона этой прямой
к оси является произведением:
tg |
P |
|
dP |
|
dV |
V |
2 |
dP |
VK . |
J |
|
dV |
T dJ |
|
dV |
||||
|
|
|
|
T |
|||||
Из этого равенства находим:
K |
1 |
|
P |
. |
(2.3) |
|
|
|
|
||||
|
V |
|
J |
|
||
Заменим в формуле (1.4) уравнения Клапейрона–Менделеева объем на J-1, получим массу идеального газа.
m |
M |
|
P |
. |
(2.4) |
|
|
||||
|
RT |
|
J |
|
|
2.2. Описание установки
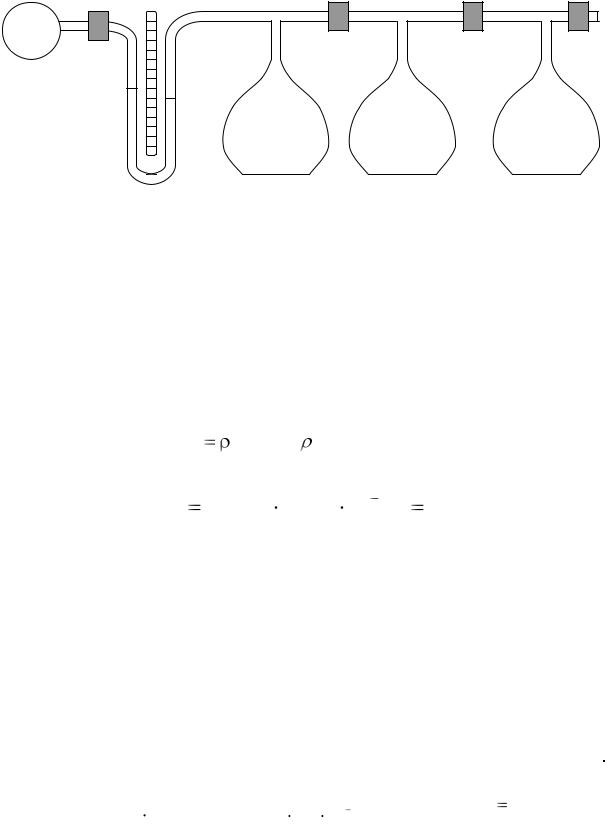
Схема установки для изучения термодинамического процесса изображена на рис 2.1.
15
М
К1 |
К2 |
К3 |
К4 |
|
|
|
Б1 |
Б2 |
Б3 |
М
Рис. 2.1. Схема установки для изучения изотермического процесса
Воздух микрокомпрессором МК через клапан К1 закачивается в баллон Б1. Давление в этом баллоне регистрируется манометром М. При этом клапаны К2, К3, К4 закрыты. При открытии клапан К2, объем, занимаемый воздухом, увеличивается в два раза. Давление при этом уменьшается. Открыв клапан К3, увеличим объем воздуха в 3 раза и тем самым уменьшим еще давление. Открыв клапан К4 мы выпускаем накаченный воздух в атмосферу. Для измерения давления воздуха в баллонах (рис 2.1) используется манометр, состоящий из двух сообщающихся сосудов, заполнен-
ных водой. Давление P |
gh, где |
=103 кг/м3-плотность воды. Для раз- |
|||||
ности уровней 1мм получим |
|
|
|
|
|
|
|
Р 10 |
3 |
кг |
9,8 |
м |
10 |
3 |
м 9,8Па |
|
м3 |
с2 |
|
||||
|
|
|
|
|
|
||
3.ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
1.Подготовить установку к работе. Открыть все клапаны и выпустить воздух в атмосферу. Манометр при этом должен показывать нулевое давление. Закрыть клапаны К2, К3, К4.
2.Накачать микрокомпрессором воздух в баллон Б1 до давления указанного преподавателем.
3.Значения давления и объема записать в таблицу результатов:
|
Разность уровней |
Объем воздуха в |
Обратный объем |
|||
№ |
в манометре, мм |
баллонах |
J |
1 |
(1/м3) |
|
|
|
|
|
|||
|
P 9,8 (Па) |
V 0,7 10 3 (м3) |
V |
|||
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
16

3.4.Открыть кран К2. При этом объем воздуха увеличивается в два раза. Полученные значения давления и объема занести в таблицу результатов.
3.5.Открыть клапан К3. Объем воздуха в баллоне увеличится в 3 раза. Значения объема и соответствующего ему давления занести в таблицу результатов.
3.6. Вычислить J |
1 |
и заполнить последнюю графу таблицы. Постро- |
||
|
||||
|
V |
|
|
|
ить график зависимости давления от обратного объема (рис. 2.1). |
||||
3.7. Вычислить по графику соотношение P |
J |
и определить по фор- |
||
|
|
|
|
|
муле (2.3) модуль сжатия.
3.8. По формуле (2.4) определить массу воздуха в баллонах.
4.КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Модель идеального газа.
2.Уравнение состояния идеального газа.
3.Дать определение температуры.
4.Дайте пояснение изобарическому процессу. Объясните понятие «абсолютный ноль».
5.Сформулируйте все газовые законы.
6.Изотермический процесс.
7.Изотерма в координатах (P,V); (P,T); (V,T).
8.Основное уравнение молекулярно-кинетической теории идеальных газов.
9.Распределение молекул идеального газа по скоростям.
10. Термический коэффициент давления.
11. Коэффициент объемного расширения.
12. Изотермический модуль всестороннего сжатия.
17
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1.Трофимова Т.И. Курс физики / Т.И. Трофимова. – 14-е изд. «Акаде-
мия» 2007.
2.Савельев, И.В. Курс общей физики / И.В. Савельев. – Т. 1. – М. Издво «Наука» 1986.
3.Яворский, Б.М. Курс физики / Б.М. Яворский, А.А. Детлаф. – Изд-во «Высшая школа» 1990.
4.Сивухин, Д.В. Общий курс физики / Д.В. Сивухин. – Т. 2. Изд-во
«Наука» 2006.
18
|
ОГЛАВЛЕНИЕ |
|
ВВЕДЕНИЕ ......................................................................................................... |
3 |
|
ТЕМА: ИЗУЧЕНИЕ ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА............................ |
4 |
|
1. |
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ .......................................................................... |
4 |
|
1.1. Идеальный газ .......................................................................................... |
4 |
|
1.2. Уравнение состояния идеального газа .................................................. |
5 |
|
1.3. Изопроцессы идеального газа ................................................................ |
7 |
|
1.4. Основное уравнение молекулярно-кинетической теории |
|
идеальных газов................................................................................................ |
10 |
|
|
1.5. Закон Максвелла о распределении молекул идеального газа |
|
|
по скоростям и энергиям теплового движения .................................. |
12 |
|
1.6. Внутренняя энергия системы ............................................................... |
13 |
2. |
МЕТОД РАБОТЫ......................................................................................... |
14 |
|
2.1. Определение изотермического модуля всестороннего сжатия ........ |
14 |
|
2.2. Описание установки .............................................................................. |
15 |
3. |
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ ...................................................... |
16 |
4. |
КОНТРОЛЬНЫЕ ВОПРОСЫ ..................................................................... |
17 |
БИБЛИОГРАФИЧЕСКИЙ СПИСОК ............................................................ |
18 |
|
19
Учебное издание
Антонычева Елена Альбертовна Рекунова Наталья Николаевна Куликова Генриетта Владимировна
ИЗУЧЕНИЕ ИЗОТЕРМИЧЕСКОГО ПРОЦЕССА
Методические указания на выполнение лабораторной работы
Отпечатано методом прямого репродуцирования
————————————————————————————
План 2013 г. Поз. 9.32. Подписано в печать 28.06.2013. Уч.-изд. л. 1,25. Усл. печ. л. 1,2. Зак. 234. Тираж 75 экз. Цена 53 руб.
————————————————————————————
Издательство ДВГУПС 680021, г. Хабаровск, ул. Серышева, 47.
20
