
- •Лекции по общей химии Введение.
- •Основные законы химии.
- •Стехиометрические законы.
- •Газовые законы.
- •3. Уравнение состояния идеального газа (Клапейрона-Менделеева).
- •Строение атома
- •Квантово-механическая модель строения атома
- •Лекция 3. Периодический закон и электронные конфигурации атомов.
- •Радиусы атомов. Потенциал ионизации. Сродство к электрону. Электроотрицательность.
- •Лекции 2, 3 Химическая связь. Метод молекулярных орбиталей (ммо).
- •Рассмотрим молекулы нf и ВеН2, в которых имеет место образование несвязывающих мо. Сравнение методов мвс и ммо.
- •О валентности.
- •Металлическая связь.
- •Ионная связь.
- •Водородная связь.
- •Межмолекулярные взаимодействия.
- •Взаимосвязь между типом хс и свойствами веществ.
- •Стеклообразное состояние вещества.
- •Применение процессов возбуждения электронов для практических целей.
- •Основы химической термоднамики. Функции состояния.
- •Внутренняя энергия
- •Энтальпия.
- •Энтропия.
- •2 Закон (Начало)т/д: в изолированной системе самопроизвольно протекают только такие процессы, которые ведут к росту энтропии.
- •Энергия Гиббса.
- •Энергия Гельмгольца.
- •Кинетика химических реакций.
- •Зависимость скорости реакции от температуры.
- •Катализ.
- •Цепные реакции.
- •Химическое равновесие.
- •Растворы.
- •Свойства разбавленных растворов неэлектролитов (коллигативные свойства – независящие от природы вещества).
- •Осмос и осмотическое давление.
- •Диссоциация кислот, оснований, солей.
- •Протонная теория кислот и оснований Бренстеда и Лоури.
- •Произведение растворимости.
- •Особенности растворов сильных электролитов.
- •Ионные реакции в растворах электролитов.
- •Комплексные соединения.
- •Количественные характеристики процесса гидролиза.
- •Буферные растворы.
- •Окислительно-восстановительные реакции.
- •Окислительно-восстановительная двойственность.
- •Составление уравнений овр.
- •Окислительно-восстановительный (электродный) потенциал.
- •Окислительно-восстановительная способность двух форм электрохимической системы.
- •Эдс как количественная характеристика возможности протекания окислительно-восстановительного процесса.
- •Окислительно-восстановительная способность двух форм электрохимической системы.
- •Уравнение Нернста.
- •1.Взаимодействие металлов с водой.
- •2.Взаимодействие металлов с растворами щелочей.
- •3.Взаимодействие металлов с кислотами, в которых окислитель – катион водорода.
- •4.Взаимодействие металлов с концентрированной серной кислотой.
- •Взаимодействие концентрированной серной с неметаллами-восстановителями.
- •5.Взаимодействие металлов с азотной кислотой (разб. И конц.).
- •Взаимодействие азотной кислоты с неметаллами
- •Взаимодействие металлов с растворами солей.
- •Окислительно-восстановительные свойства воды.
- •Коррозия металлов
- •Газовая коррозия
- •Образование оксидной пленки на металлах
- •Атмосферная коррозия
- •Электрохимическая коррозия
- •Методы защиты от коррозии.
- •1. Модификация самого металла:
- •2.Отделение (предохранение) металла от окружающей среды с помощью защитных покрытий (неметаллических):
- •3.Металлические защитные покрытия.
- •4.Электорохимические методы защиты (суть – заставить разрушаться болванкам).
- •5.Специальная обработка электролита или среды, в которой находится металл (удаление или уменьшение концентрации веществ, вызывающих коррозию).
- •6.Химическая обработка для повышения коррозионной стойкости (пассивация поверхности металла) - то, что не использовалось в выше приведенных методах, часто в расплавах или при повышенных температурах.
- •Измерение э.Д.С. Химических источников тока.
- •Химические источники электрической энергии (хиээ)
- •Аккумуляторы.
- •Типы аккумуляторов
- •Свинцово-кислотные аккумуляторы.
- •Принцип действия
- •Устройство
- •Литий-ионные аккумуляторы.
- •Литиевые элементы различных электрохимических систем
- •Электролиз.
- •Законы электролиза м. Фарадея.
- •Практическое применение электролиза.
- •Электрофорез и электродиализ.
- •Металлы и сплавы.
- •Классификация металлов.
- •Основные методы получения металлов.
- •Получение металлов высокой чистоты.
- •Металлы и сплавы
Литий-ионные аккумуляторы.
В начале 60-х годов прошлого века появились новые источники тока с высоким разрядным напряжением – более 3В на основе щелочного металла лития. Эти источники тока с высокими энергетическими характеристиками и расширенным диапазоном эксплуатационных возможностей были разработаны при отказе от водных электролитов. Самые большие успехи были достигнуты при разработке литиевых элементов с органическим и твердым электролитом. Изучались источники тока с твердофазными (MnO2, CuO, I2, CFx, FeS2 и другие) и жидкофазными катодными материалами (SO2 и SOCl2 -тионилхлорид). Основные характеристики литиевых элементов более всего распространенных систем показаны в таблице, ниже описаны их особенности и показаны рабочие характеристики.
Литиевые элементы различных электрохимических систем
|
Характеристики |
Li/MnO2 |
Li/SO2 |
Li/SOCl2 |
Li/CFx |
Li/CuO |
Li/I2 |
|
НРЦ |
3,5 |
3,0 |
3,67 |
3,3 |
1,6 |
2,8 |
|
Рабочее напряжение, В |
3,0 |
2,6-2,9 |
3,3-3,5 |
- |
1,2-1,5 |
- |
|
Конечное напряжение, В |
2,0 |
2,2 |
2,2 |
2,0 |
0,9-1,0 |
2,2 |
|
Удельная энергия: Весовая, Втч/кг Объемная, Втч/л |
до 250 |
300-340 |
до 600 |
250 |
300 |
- |
|
500 |
500-560 |
до 1100 |
600 |
600 |
до 1000 | |
|
Диапазон рабочих температур, °С |
-20 - +55 |
-60 - +70 |
-50 - +70 (до 130) |
-20 - +60 |
-10 - +70 |
-10 - +60 |
|
Саморазряд, % в год |
2-2,5 |
1-2 |
1,5-2 |
1-2 |
1-2 |
1 |
Литиевые аккумуляторы в настоящее время в ряде областей техники успешно конкурируют с более дешевыми элементами с водным электролитом. Их применяют в часах, фотокамерах, калькуляторах, для защиты памяти интегральных схем, в измерительных приборах и медицинском оборудовании, мобильных телефонах и пр., где требуется высокая сохранность и постоянство рабочего напряжения в течение многих лет эксплуатации. Существуют и мощные источники тока, способные к отдаче импульсов большой энергии даже после 10-12 лет хранения. К герметизации литиевых источников питания предъявляются повышенные требования, так как должна быть исключена вероятность не только вытекания электролита, но и попадания внутрь воздуха и паров воды, из-за чего возникает угроза пожара или взрыва элемента. Высокая реактивность лития, воздействие влажности воздуха на состояние электродов и электролита определяют и повышенные сложности при производстве элементов, необходимость проведения технологических действий в герметичных блоках с атмосферой аргона и "сухих" помещениях.
Источники тока на базе системы литий/диоксид марганца (Li/MnO2) Элементы Li/MnO2 с твердым катодом из диоксида марганца появились на рынке первичных литиевых источников тока одними из первых. В соответствии со стандартом МЭК в обозначении типа элемента Li/MnO2 присутствуют буквы CR. Атомы лития интеркалированы в углеродную матрицу. Суммарная токообразующая реакция для этой системы записывается в виде:
Li + Mn+4O2 Mn+3O2 (Li+)
т.е. диоксид марганца восстанавливается из четырехвалентного до трехвалентного состояния с помощью лития, который внедряется в кристаллическую решетку конечного оксида. Электролит - перхлорат лития в смешанном органическом растворителе. Электрохимическую схему можно представить следующим образом:
LixC |LiClO4 (в орг.раст-ле)|Li+/MnO2
На аноде (при разряде ) протекает процесс окисления атомов лития:
Li(C) Li+ + e
На катоде – восстановление диоксида марганца (неточная схема процесса):
Mn+4O2 +е Li+ Mn+3O2
Напряжение разомкнутой цепи (НРЦ) элемента Li/MnO2 - 3,5В, номинальное напряжение - 3В, хотя первоначальное напряжение при подключении нагрузки может быть и немного выше. Конечное напряжение - 2В. Рабочий диапазон температур как правило от -20 до +55 °С. Срок хранения - до 10 лет при саморазряде порядка 1% в год (и не более 2-2,5%).
|
Литий-ионные аккумуляторы Особенности литиевых аккумуляторов Источники тока с более высокими энергетическими характеристиками и расширенным диапазоном эксплуатационных возможностей были разработаны при отказе от водных электролитов. Самые большие успехи были достигнуты при разработке литиевых элементов с органическим и твердым электролитом. Первые работы по применению лития в качестве анодного материала в источниках тока появились в начале XX века, но реальное развитие они получили в 60-ых годах. Изучались источники тока с твердофазными (MnO2, CuO, I2, CFx, FeS2 и другие) и жидкофазными катодными материалами (SO2 и SOCl2). Основные характеристики литиевых элементов более всего распространенных систем показаны в таблице, ниже описаны их особенности и показаны рабочие характеристики. Литиевые элементы различных электрохимических систем
Литиевые батарейки в настоящее время в ряде областей техники успешно конкурируют с более дешевыми элементами с водным электролитом. Их применяют в часах, фотокамерах, калькуляторах, для защиты памяти интегральных схем, в измерительных приборах и медицинском оборудовании, там, где требуется высокая сохранность и постоянство рабочего напряжения в течение многих лет эксплуатации. Существуют и мощные источники тока, способные к отдаче импульсов большой энергии даже после 10-12 лет хранения. К герметизации литиевых батареек предъявляются повышенные требования, так как должна быть исключена вероятность не только вытекания электролита, но и попадания внутрь воздуха и паров воды, из-за чего возникает угроза пожара или взрыва элемента. Высокая реактивность лития, воздействие влажности воздуха на состояние электродов и электролита определяют и повышенные сложности при производстве элементов, необходимость проведения технологических действий в герметичных блоках с атмосферой аргона и "сухих" помещениях. Литиевые элементы, цилиндрические и дисковые, производятся в габаритах элементов традиционных электрохимических систем. Поэтому нужно быть внимательным, чтобы не допускать ошибок случайных замен элементов с рабочим напряжением 1,5 В на литиевые, напряжение которых значительно выше. Многие компании часто стараются уменьшить эту опасность и поставляют элементы с приваренными нестандартными выводами в виде плоских лепестков, аксиальных иглообразных штырьков для впаивания элементов в схему и т.п. Основные электрохимические системы литиевых элементов Источники тока на базе системы литий/диоксид марганца (Li/MnO2) Элементы Li/MnO2 с твердым катодом из диоксида марганца появились на рынке первичных литиевых источников тока одними из первых. В соответствии со стандартом МЭК в обозначении типа элемента Li/MnO2 присутствуют буквы CR.. Реакция для этой системы записывается в виде: Li + Mn+4O2 → Mn+3O2 (Li+) т.е. диоксид марганца восстанавливается из четырехвалентного до трехвалентного состояния с помощью лития, который внедряется в кристаллическую решетку конечного оксида. Электролит - перхлорат лития в смешанном органическом растворителе. Напряжение разомкнутой цепи (НРЦ) элемента Li/MnO2 - 3,5В, номинальное напряжение - 3В, хотя первоначальное напряжение при подключении нагрузки может быть и немного выше. Конечное напряжение - 2В. Рабочий диапазон температур как правило от -20 до +55 °С. Срок хранения - до 10 лет при саморазряде порядка 1% в год (и не более 2-2,5%). Источники тока на основе системы литий/оксид меди (Li/CuO) Элементы Li/CuO имеют рабочее напряжение, сопоставимое с напряжением щелочных марганцево-цинковых элементов. Но в них удалось достигнуть в 3 раза большей удельной энергии. При разряде имеет место реакция: 2Li + CuO → Li2O + Cu при этом разрядный процесс протекает в несколько этапов: CuO → Cu2O → Cu Напряжение разомкнутой цепи (НРЦ) элементов - 2,5В, рабочее напряжение 1,2-1,5В в зависимости от тока разряда. Начального провала напряжения не наблюдается. Элемент Li/CuO работоспособен в интервале температур от -10 до +70 °С. Срок хранения элементов при 20 °С - до 10 лет. Элементы широкого распространения не получили. Источники тока на базе системы литий/иод (Li/I2) Элементы системы Li/I2 отличаются от прочих литиевых элементов тем, что они не содержат жидкого электролита и не требуют применения специального сепаратора. Работа источника тока Li/I2 основана на реакции: 2Li + I2 → 2LiI При прямом контакте йодсодержащего катода и лития в результате прямой химической реакции образуется твердый иодид лития LiI, который является электролитом и в то же время играет роль сепаратора, разделяющего два активных материала. НРЦ элемента - 2,8В. Напряжение его определяется сопротивлением слоя иодида лития, который по мере разряда постепенно накапливается в межэлектродном пространстве и вызывает линейное снижение напряжения до 2,2-2,4В. Когда весь запас йода закончится, напряжение резко падает. Элементы обеспечивают сохранность в течение 10-15 лет при саморазряде около 10% за весь срок службы. Саморазряд определяется реакцией лития и йода, который диффундирует через слой йодида лития. Потери на саморазряд зависят от толщины слоя LiI и поэтому в наибольшей степени имеют место на начальной фазе работы: все потери на саморазряд проявляются при разряде не более чем на 25-30%. При работе элементов Li/I2 не образуется газов. Общий объем их постоянен в течение всего периода работы. Они переносят значительные нарушения условий эксплуатации без каких-либо последствий. Специфичный механизм работы элемента и его характеристики делают его пригодным для выполнения задач, требующих повышенной надежности. Источники тока с емкостью порядка нескольких ампер-часов применяются в устройствах для медицинских применений, прежде всего имплантируемых кардиостимуляторов. Они работоспособны в интервале температур от -10 до +60 °С. Источники тока на основе системы литий/полифторуглерод Удельная энергия элемента достигает 250 Втч/кг и 600 Втч/л. Эти элементы дороже, чем элементы Li/MnO2, однако они сохраняют работоспособность при более высокой температуре и поэтому находят применение в первую очередь в устройствах, нагревающихся в течении работы. Токообразующая реакция имеет вид: nLi + (CFx)n → nLiFx + nC В процессе разряда превращения, совершающиеся во фторированном углероде, приводят к росту электропроводности положительного электрода, и условия разряда улучшаются. НРЦ элемента составляет 3,2-3,3В, рабочее напряжение постоянно на протяжении почти всего разряда в широком интервале температур (от -40 до +85 °С). Конечное напряжение -2В. Элементы теряют не более 20% Сн, при хранении более 10 лет. Литий-фторуглеродные элементы были коммерциализированы более 30 лет назад и в настоящее время применяются главным образом в качестве источников питания портативной электронной аппаратуры, особенно такой, которая разогревается в ходе работы. Но при температуре ниже 0 °С и средних и больших токах разряда эти элементы уступают более дешевым элементам системы Li/MnO2. Элементы Li/CFx обеспечивают гораздо более высокую мощность, чем элементы системы Li/I2, и поэтому успешно используются для их замены в кардиостимуляторах нового поколения, а также в имплантируемых дефибрилляторах. Источники тока на базе системы литий/дисульфид железа (Li/FeS2) В последнее время, несмотря на высокую стоимость, востребованными оказались элементы системы Li/FeS2, что определено рядом неоспоримых достоинств. Реакция, протекающая при их разряде, имеет вид 4Li + FeS2 → 2Li2S + Fe Удельная энергия этих элементов достигает 300 Втч/кг и 600 Втч/л, сохранность - 15 лет и более. Они работоспособны при температуре -40 °С, что могут обеспечить только литиевые элементы с жидкофазными катодами. Li/FeS2 элементы имеют лучшие характеристики, в особенности при большой потребляемой мощности. В конструкцию этих источников питания обязательно вводятся элементы защиты для ограничения тока непрерывного потребления (2А для элементов типоразмера АА) и устройство с положительным температурным коэффициентом сопротивления, отсоединяющим нагрузку при достижении температуры 85-95 °С. Кроме того, элементы имеют аварийный клапан для сброса давления газа, которое может появиться при их разогреве до 130-160 °С. Источники тока на основе системы литий/диоксид серы (Li/SO2) Литиевые элементы системы литий/диоксид серы с жидкофазным катодным материалом хорошо исследованы и широко распространены. В качестве катода в элементах применяется смесь сажи с графитом и связующим, которая наносится на металлическую основу. Электролит элемента состоит из диоксида серы SO2 (70-75% по объему) с добавками для обеспечения необходимой электропроводности. Электрохимическая реакция, которая протекает в элементе при подключении нагрузки, имеет вид: 2Li + 2SO2 → Li2S2O4 НРЦ элементов Li/SO2 - 3В. Элементы этой системы обладают большой удельной мощностью и работоспособны в диапазоне температур от -60 до +70 °С. Разрядное напряжение 2,6-2,9В, в зависимости от плотности тока. К недостаткам Li/SO2 элементов относятся большое внутреннее давление и опасность сильного нагрева при коротких замыканиях. Для предотвращения нежелательных эффектов в корпусе устанавливают специальный предохранитель, который срабатывает при 100 °С и обеспечивает сбрасывание излишнего давления газа.Из-за повышенного давления элементы производятся чаще всего в цилиндрической конструкции, бобинной и рулонной. В первом случае литиевый анод запрессовывается по периферии, а прессованный угольный катод располагается в центре. При рулонной сборке пакета электродов обеспечиваются более высокие энергетические характеристики. Срок хранения батареек Li/SO2 - до 10 лет. Саморазряд происходит за счет реакции лития с электролитом, скорость его не превышает 1-2 % в год при 20 °С. Источники тока на базе системы литий/тионилхлорид (Li/SOCl2) Элементы системы Li/SOCl2 с жидкофазным катодом располагают наилучшими удельными характеристиками среди литиевых первичных источников тока. Реакция, протекаемая при разряде, имеет вид: 4Li + 2SOCl2 → 4LiCl + SO2 + S Так как большая часть SO2 растворяется в электролите, давления в элементе не появляется. НРЦ элементов - 3,67 В, рабочее напряжение 3,3-3,5 В в зависимости от тока разряда. Они работоспособны в интервале температур от -60 до +85 °С, некоторые до +130 °С. Конструкция элементов Li/SOCl2 подобна конструкции элементов Li/SO2, но тионилхлорид значительно агрессивнее других электролитов, вследствие этого обеспечение их пожаро- и взрывобезопасности потребовало больших усилий и от разработчиков, и от технологов.Срок хранения этих элементов до 10 лет при саморазряде 1,5-2% в год при 20 °С.При низкой температуре (порядка -50 °С) элементы отдают емкость в несколько раз меньше номинальной. Если после этого они переносятся в теплое помещение, разряд продолжается и может иметь место существенный их разогрев за счет разложения промежуточных продуктов реакции вплоть до взрыва.Для увеличения безопасности эксплуатации, литиевые элементы могут быть снабжены аварийными клапанами для сброса газа, плавкими предохранителями, тепловыми выключателями. |
ТОПЛИВНЫЙ ЭЛЕМЕНТ
Перевод
ТОПЛИВНЫЙ ЭЛЕМЕНТ
электрохимический генератор, устройство, обеспечивающее прямое преобразование химической энергии в электрическую. Хотя то же самое происходит в электрических аккумуляторах, топливные элементы имеют два важных отличия: 1) они функционируют до тех пор, пока топливо и окислитель поступают из внешнего источника; 2) химический состав электролита в процессе работы не изменяется, т.е. топливный элемент не нуждается в перезарядке. См. также БАТАРЕЯ ЭЛЕКТРОПИТАНИЯ. Принцип действия. Топливный элемент (рис. 1) состоит из двух электродов, разделенных электролитом, и систем подвода топлива на один электрод и окислителя на другой, а также системы для удаления продуктов реакции. В большинстве случаев для ускорения химической реакции используются катализаторы. Внешней электрической цепью топливный элемент соединен с нагрузкой, которая потребляет электроэнергию.
 Рис.
1. ВОДОРОДНО-КИСЛОРОДНЫЙ ТОПЛИВНЫЙ
ЭЛЕМЕНТ. Эти элементы непрерывно
снабжаются кислородом и водородом для
получения электрической энергии в
результате постоянно поддерживающейся
химической реакции.
Рис.
1. ВОДОРОДНО-КИСЛОРОДНЫЙ ТОПЛИВНЫЙ
ЭЛЕМЕНТ. Эти элементы непрерывно
снабжаются кислородом и водородом для
получения электрической энергии в
результате постоянно поддерживающейся
химической реакции.
В изображенном на рис. 1 топливном элементе с кислым электролитом водород подается через полый анод и поступает в электролит через очень мелкие поры в материале электрода. При этом происходит разложение молекул водорода на атомы, которые в результате хемосорбции, отдавая каждый по одному электрону, превращаются в положительно заряженные ионы. Этот процесс может быть описан следующими уравнениями:
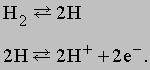 <="">
Ионы
водорода диффундируют через электролит
к положительной стороне элемента.
Подаваемый на катод кислород переходит
в электролит и также реагирует на
поверхности электрода с участием
катализатора. При соединении его с
ионами водорода и электронами, которые
поступают из внешней цепи, образуется
вода:
<="">
Ионы
водорода диффундируют через электролит
к положительной стороне элемента.
Подаваемый на катод кислород переходит
в электролит и также реагирует на
поверхности электрода с участием
катализатора. При соединении его с
ионами водорода и электронами, которые
поступают из внешней цепи, образуется
вода:
![]() <="">
В
топливных элементах со щелочным
электролитом (обычно это концентрированные
гидроксиды натрия или калия) протекают
сходные химические реакции. Водород
проходит через анод и реагирует в
присутствии катализатора с имеющимися
в электролите ионами гидроксила (OH-) с
образованием воды и электрона:
<="">
В
топливных элементах со щелочным
электролитом (обычно это концентрированные
гидроксиды натрия или калия) протекают
сходные химические реакции. Водород
проходит через анод и реагирует в
присутствии катализатора с имеющимися
в электролите ионами гидроксила (OH-) с
образованием воды и электрона:
![]() <="">
На
катоде кислород вступает в реакцию с
водой, содержащейся в электролите, и
электронами из внешней цепи. В
последовательных стадиях реакций
образуются ионы гидроксила (а также
пергидроксила O2H-). Результирующую
реакцию на катоде можно записать в виде:
<="">
На
катоде кислород вступает в реакцию с
водой, содержащейся в электролите, и
электронами из внешней цепи. В
последовательных стадиях реакций
образуются ионы гидроксила (а также
пергидроксила O2H-). Результирующую
реакцию на катоде можно записать в виде:
![]() <="">
Поток
электронов и ионов поддерживает баланс
заряда и вещества в электролите.
Образующаяся в результате реакции вода
частично разбавляет электролит. В любом
топливном элементе часть энергии
химической реакции превращается в
тепло. Поток электронов во внешней цепи
представляет собой постоянный ток,
который используется для совершения
работы. Большинство реакций в топливных
элементах обеспечивают ЭДС около 1 В.
Размыкание цепи или прекращение движения
ионов останавливает работу топливного
элемента. Процесс, происходящий в
водородно-кислородном топливном
элементе, по своей природе является
обратным хорошо известному процессу
электролиза, в котором происходит
диссоциация воды при прохождении через
электролит электрического тока.
Действительно, в некоторых типах
топливных элементов процесс может быть
обращен - приложив к электродам напряжение,
можно разложить воду на водород и
кислород, которые могут быть собраны
на электродах. Если прекратить зарядку
элемента и подключить к нему нагрузку,
такой регенеративный топливный элемент
сразу начнет работать в своем нормальном
режиме. Теоретически размеры топливного
элемента могут быть сколь угодно
большими. Однако на практике несколько
элементов объединяются в небольшие
модули или батареи, которые соединяются
либо последовательно, либо параллельно.
Типы
топливных элементов.
Существуют различные типы топливных
элементов. Их можно классифицировать,
например, по используемому топливу,
рабочему давлению и температуре, по
характеру применения.
Элементы
на водородном топливе.
В этом типичном описанном выше элементе
водород и кислород переходят в электролит
через микропористые углеродные или
металлические электроды. Высокая
плотность тока достигается в элементах,
работающих при повышенной температуре
(около 250° С) и высоком давлении. Элементы,
использующие водородное топливо,
получаемое при переработке углеводородного
топлива, например природного газа или
нефтепродуктов, по-видимому, найдут
наиболее широкое коммерческое применение.
Объединяя большое число элементов,
можно создавать мощные энергетические
установки. В этих установках постоянный
ток, вырабатываемый элементами,
преобразуется в переменный со стандартными
параметрами. Новым типом элементов,
способных работать на водороде и
кислороде при нормальных температуре
и давлении, являются элементы с
ионообменными мембранами (рис. 2). В этих
элементах вместо жидкого электролита
между электродами располагается
полимерная мембрана, через которую
свободно проходят ионы. В таких элементах
наряду с кислородом может использоваться
воздух. Образующаяся при работе элемента
вода не растворяет твердый электролит
и может быть легко удалена.
<="">
Поток
электронов и ионов поддерживает баланс
заряда и вещества в электролите.
Образующаяся в результате реакции вода
частично разбавляет электролит. В любом
топливном элементе часть энергии
химической реакции превращается в
тепло. Поток электронов во внешней цепи
представляет собой постоянный ток,
который используется для совершения
работы. Большинство реакций в топливных
элементах обеспечивают ЭДС около 1 В.
Размыкание цепи или прекращение движения
ионов останавливает работу топливного
элемента. Процесс, происходящий в
водородно-кислородном топливном
элементе, по своей природе является
обратным хорошо известному процессу
электролиза, в котором происходит
диссоциация воды при прохождении через
электролит электрического тока.
Действительно, в некоторых типах
топливных элементов процесс может быть
обращен - приложив к электродам напряжение,
можно разложить воду на водород и
кислород, которые могут быть собраны
на электродах. Если прекратить зарядку
элемента и подключить к нему нагрузку,
такой регенеративный топливный элемент
сразу начнет работать в своем нормальном
режиме. Теоретически размеры топливного
элемента могут быть сколь угодно
большими. Однако на практике несколько
элементов объединяются в небольшие
модули или батареи, которые соединяются
либо последовательно, либо параллельно.
Типы
топливных элементов.
Существуют различные типы топливных
элементов. Их можно классифицировать,
например, по используемому топливу,
рабочему давлению и температуре, по
характеру применения.
Элементы
на водородном топливе.
В этом типичном описанном выше элементе
водород и кислород переходят в электролит
через микропористые углеродные или
металлические электроды. Высокая
плотность тока достигается в элементах,
работающих при повышенной температуре
(около 250° С) и высоком давлении. Элементы,
использующие водородное топливо,
получаемое при переработке углеводородного
топлива, например природного газа или
нефтепродуктов, по-видимому, найдут
наиболее широкое коммерческое применение.
Объединяя большое число элементов,
можно создавать мощные энергетические
установки. В этих установках постоянный
ток, вырабатываемый элементами,
преобразуется в переменный со стандартными
параметрами. Новым типом элементов,
способных работать на водороде и
кислороде при нормальных температуре
и давлении, являются элементы с
ионообменными мембранами (рис. 2). В этих
элементах вместо жидкого электролита
между электродами располагается
полимерная мембрана, через которую
свободно проходят ионы. В таких элементах
наряду с кислородом может использоваться
воздух. Образующаяся при работе элемента
вода не растворяет твердый электролит
и может быть легко удалена.
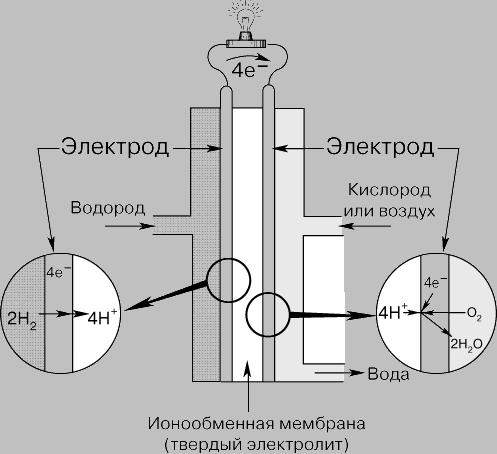 Рис.
2. ТОПЛИВНЫЙ ЭЛЕМЕНТ С ИОНООБМЕННОЙ
МЕМБРАНОЙ также работает на водороде
и кислороде, но вместо жидкого электролита
используется полимерная мембрана.
Рис.
2. ТОПЛИВНЫЙ ЭЛЕМЕНТ С ИОНООБМЕННОЙ
МЕМБРАНОЙ также работает на водороде
и кислороде, но вместо жидкого электролита
используется полимерная мембрана.
Элементы на углеводородном и угольном топливах. Топливные элементы, которые могут превращать химическую энергию таких широко доступных и сравнительно недорогих топлив, как пропан, природный газ, метиловый спирт, керосин или бензин, непосредственно в электричество, являются предметом интенсивного исследования. Однако пока не достигнуто заметных успехов в создании топливных элементов, работающих на газах, получаемых из углеводородного топлива, при нормальной температуре. Для повышения скорости реакции углеводородного и угольного топлива приходится повышать рабочую температуру топливного элемента. Электролитами служат расплавы карбонатов или других солей, которые заключаются в пористую керамическую матрицу. Топливо "расщепляется" внутри элемента с образованием водорода и оксида углерода, которые поддерживают протекание токообразующей реакции в элементе. Элементы, работающие на других видах топлива. В принципе реакции в топливных элементах не обязательно должны быть реакциями окисления обычных топлив. В перспективе могут быть найдены и другие химические реакции, которые позволят осуществить эффективное непосредственное получение электричества. В некоторых устройствах электроэнергия получается при окислении, например, цинка, натрия или магния, из которых изготавливаются расходуемые электроды. Коэффициент полезного действия. Превращение энергии обычных топлив (угля, нефти, природного газа) в электричество было до сих пор многоступенчатым процессом. Сжигание топлива, позволяющее получить пар или газ, необходимые для работы турбины или двигателя внутреннего сгорания, которые, в свою очередь, вращают электрический генератор, - процесс не очень эффективный. Действительно, коэффициент использования энергии такого превращения ограничен по второму закону термодинамики, и его вряд ли можно существенно поднять выше существующего уровня (см. также ТЕПЛОТА; ТЕРМОДИНАМИКА). Коэффициент использования энергии топлива самых современных паротурбинных энергетических установок не превышает 40%. Для топливных элементов нет термодинамического ограничения коэффициента использования энергии. В существующих топливных элементах от 60 до 70% энергии топлива непосредственно превращается в электричество, и энергетические установки на топливных элементах, использующие водород из углеводородного топлива, проектируются на КПД 40-45%. Применения. Топливные элементы могут в недалеком будущем стать широко используемым источником энергии на транспорте, в промышленности и домашнем хозяйстве. Высокая стоимость топливных элементов ограничивала их применение военными и космическими приложениями. Предполагаемые применения топливных элементов включают их применение в качестве переносных источников энергии для армейских нужд и компактных альтернативных источников энергии для околоземных спутников с солнечными батареями при прохождении ими протяженных теневых участков орбиты. Небольшие размеры и масса топливных элементов позволили использовать их при пилотируемых полетах к Луне. Топливные элементы на борту трехместных кораблей "Аполлон" применялись для питания бортовых компьютеров и систем радиосвязи. Топливные элементы можно использовать в качестве источников питания оборудования в удаленных районах, для внедорожных транспортных средств, например в строительстве. В сочетании с электродвигателем постоянного тока топливный элемент будет эффективным источником движущей силы автомобиля. Для широкого применения топливных элементов необходимы значительный технологический прогресс, снижение их стоимости и возможность эффективного использования дешевого топлива. При выполнении этих условий топливные элементы сделают электрическую и механическую энергию широко доступными во всем мире. См. также ЭНЕРГЕТИЧЕСКИЕ РЕСУРСЫ. ЛИТЕРАТУРА Багоцкий В.С., Скундин А.М. Химические источники тока. М., 1981 Кромптон Т. Источники тока. М., 1985, 1986
Британские исследователи обнаружили, что микробы могут производить электричество, вступая в контакт с металлом. Теперь они уверены, что в будущем могут появится "биоаккумуляторы", работающие на бактериях.
Национальная академия наук Великобритании опубликовала статью, в которой утверждается, что бактерии могут вырабатывать электрический ток при помощи своих клеточных мембран, просто прикоснувшись к металлам или минералам. Это означает, что можно создавать биоаккумуляторы, "привязав" микробы непосредственно к электродам.
Ученые создали синтетическую версию морских бактерий Оneidensis Shewanella, использовав при этом только белки для трансфера электронов от внутренней части микроба к элементу. Далее они были заключены в слои пузырьков, представляющие собой небольшие липидные (жировые) капсулы, точно такие же, как те, из которых состоит бактериальная мембрана. После этого ученые протестировали, насколько эффективно происходит обмен электронов между бактериями и железосодержащим минералом.
Доктор Том Кларк, ученый из университета Восточной Англии, отметил, что им и ранее было известно, что бактерии могут передавать электроэнергию на металлы и минералы, и что это взаимодействие зависит от специальных белков, находящихся на поверхности бактерий. Однако до этого исследования им было неясно, каким образом эти белки влияют на процесс — прямо или косвенно (через какой-либо посредник из окружающей среды).
Биолог заявил, что, благодаря проделанным ими опытам, выяснено, что эти белки касаются минеральных поверхностей и производят при этом электрический ток. А это, в свою очередь, означает, что этим же смогут заниматься и бактерии, если поместить их на поверхности металла или минерала.
Таким образом, уже в ближайшем будущем мы сможем увидеть первые биоаккумуляторы. Возможно, когда-нибудь они появятся и в мобильных девайсах.
