
02-Термодинам.основы теории холод.машин
.pdfРАЗДЕЛ 1 ТЕОРЕТИЧЕСКИЕ ПРОЦЕССЫ ПОЛУЧЕНИЯ ХОЛОДА
1.2 Термодинамические основы теории холодильных машин
1.2.1 Основные понятия и законы термодинамики
Искусственным охлаждением называется процесс переноса теплоты от тел с более низким температурным уровнем к телам с более высоким температурным уровнем за счет затраты внешней работы.
Назначение холодильной машины состоит в отводе теплоты от охлаждаемого объекта, имеющего низкую температуру, и передаче отведенной теплоты более теплой окружающей среде. Принцип действия холодильной машины определяется основными законами термодинамики.
Состояние любой термодинамической системы характеризуется следующими параметрами состояния: давлением, температурой, удельным объемом, внутренней энергией, энтальпией, энтропией. При изменении параметров состояния изменяется и состояние системы.
Давление, температура и удельный объем являются термическими параметрами системы, которые можно измерить. Внутренняя энергия, энтальпия и энтропия не могут быть измерены и являются расчетными параметрами.
Внутренняя энергия зависит только от внутреннего состояния системы и обусловлена энергией микрочастиц, входящих в составляющие системы, а также энергией взаимодействия между этими частицами.
Определение энтальпии следует из первого закона термодинамики. Первый закон устанавливает, что количество теплоты, прошедшее через контрольную поверхность термодинамической системы, затрачивается на изменение внутренней энергии и работу, совершенную системой. Энтальпия - это полная энергия рабочего вещества в открытой системе, т.е. энергетический параметр состояния вещества, определяемый из уравнения:
I |
U P V |
(1) |
где |
U |
внутренняя энергия вещества, Дж; |
Рдавление, Па;
Vобъем вещества, м3.
Втермодинамике обычно используется удельная энтальпия, равная отношению энтальпии к массе вещества.
i u P v |
|
(2) |
где u |
|
удельная внутренняя энергия вещества, Дж/кг; |
v |
|
удельный объем вещества, м3/кг. |
Определение энтропии вытекает из второго закона термодинамики, который устанавливает, что перенос теплоты от системы с более низкой температурой к системе с более высокой температурой не может происходить самопроизвольно, а для его осуществления необходимо затратить механическую работу или эквивалентное количество другой энергии. Направление процесса теплообмена системы с окружающей средой, а также направление любых самопроизвольных процессов в изолированной системе характеризуется особым параметром состояния системы - энтропией.
Полный дифференциал энтропии определяется из выражения:
1
dS |
dQ |
, |
(3) |
|
|||
|
T |
|
|
где dQ |
количество теплоты, участвующее в квазистатическом, т.е. обратимом |
||
|
|
|
процессе теплообмена, Дж; |
Табсолютная температура, при которой происходит процесс, К.
На практике про проведении расчетов пользуются понятием удельной энтропии, измеряемой в Дж/(кг К) :
s |
S |
|
du Pdv |
|
di vdP |
. |
(4) |
m |
T |
|
|||||
|
|
|
T |
|
|||
Как известно из термодинамики, перенос теплоты с низшего температурного уровня на высший сопровождается уменьшением энтропии и поэтому не может происходить самопроизвольно. Для того, чтобы осуществить такой процесс, его необходимо сочетать с другим процессом, протекающим с возрастанием энтропии, т.е. с затратой энергии, и компенсирующим уменьшение энтропии в процессе отвода тепла от среды с более низкой температурой.
1.2.2 Обратимые и необратимые циклы
Для непрерывной работы любой тепловой, в том числе холодильной машины, необходимо осуществление термодинамического цикла. Разность между подведенной
иотведенной теплотой в цикле равна внешней работе, что справедливо для обратимых и необратимых циклов. Если все процессы в цикле обратимы, то цикл также является обратимым, и его можно осуществить как в прямом, так и в обратном направлении.
Обратимым является такой идеализированный, абстрактный процесс, который протекает без нарушения равновесия как в самой системе (внутреннее равновесие), так
имежду ней и окружающей средой (внешнее равновесие). Процесс является обратимым в том и только в том случае, когда он является квазистатическим, т.е. таким, при котором все промежуточные состояния системы равновесны. Обратимый процесс характеризуется бесконечно большим временем протекания и нулевой разностью в каждый момент времени между температурами и давлениями в любой точке как в самой системе, так и на границе системы с окружающей средой.
Практически все реальные процессы, происходящие в термотрансформаторах энергии, являются необратимыми. Реальный процесс можно считать приближенно квазистатическим, когда время протекания процесса велико по сравнению со временем самопроизвольного установления состояния равновесия, а разности между температурами и давлениями незначительны. Это дает возможность использовать для инженерных расчетов при указанных допущениях термодинамические соотношения, строго справедливые лишь для обратимых процессов.
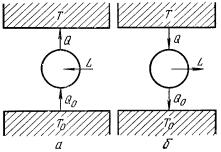
Рис. 1 – Циклы Карно:
а) обратный цикл Карно; б) прямой цикл Карно.
2
Обратимым является цикл Карно, состоящий из двух изотемических и двух адиабатических процессов. Для обеспечения обратимости температуры источников теплоты должны быть постоянными, а теплообмен рабочего вещества с источниками теплоты должен происходить при нулевой разности между температурами.
При необратимых процессах энтропия системы возрастает, исходя из чего теоремой Гюи - Стодола доказано, что любая необратимость приводит к потерям или дополнительным затратам работы. Аналитически это выражается следующим уравнением:
L Toc S , |
(5) |
|
где L |
|
потеря работы, Дж; |
Тос |
|
температура окружающей среды; |
S |
|
возрастание энтропии системы. |
Возрастание энтропии при необратимых процессах означает рассеяние (диссипацию) энергии. Рассеянная энергия в принципе не может быть превращена в работу, поэтому максимально возможные коэффициенты преобразования теплоты и работы имеют место в циклах, удовлетворяющих условиям обратимости.
1.2.3 Обратные циклы
Основными практическими задачами искусственного охлаждения является поддержание низкой температуры каких - либо объектов или понижение температуры охлаждаемых объектов. В обоих случаях необходимо отводить теплоту от тел, имеющих температуру более низкую, чем температура окружающей среды.
В холодильных установках перенос тепла от среды с более низкой температурой к среде с более высокой температурой осуществляется посредством рабочего вещества, называемого холодильным агентом или хладагентом. Рабочее вещество вступает в тепловой контакт сначала с одним, а затем с другим источником теплоты. Такие круговые процессы называются обратными холодильными циклами.
Получение холода происходит по круговому циклу, в котором процесс отвода теплоты от охлаждаемой среды сопровождается компенсирующим процессом - подводом энергии, например при сжатии паров хладагента в компрессоре. Согласно законам термодинамики, при переносе тепла от среды с более высокой температурой Тк к среде с более низкой температурой То наибольшая степень превращения тепла в работу соответствует КПД обратного цикла Карно.
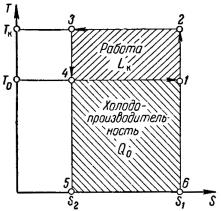
Рис. 2 Т - S диаграмма обратного цикла Карно.
Обратный цикл Карно состоит из следующих процессов:
1-2 - адиабатическое сжатие парообразного хладагента ( конечная температура сжатия Тк ); 2-3 - изотермический процесс конденсации паров
хладагента при температуре Tк с отдачей теплоты конденсации Qк окружающей среде;
3-4 - адиабатическое расширение жидкого хладагента до конечной температуры расширения То; 4-1 - изотермический процесс кипения жидкого
хладагента при температуре Tо с отводом от охлаждаемой среды теплоты Qо.
Цикл Карно осуществим только при условии постоянства энтропии системы. Если при кипении хладагента энтропия охлаждаемой среды уменьшается на величину Qо/Tо, то на такую же величину должна возрасти энтропия более нагретой окружаю-
3

щей среды. Окружающей среде передается теплота Qо, отводимая от охлаждаемого объекта, и теплота, эквивалентная работе Lк, затраченной на сжатие хладагента. В результате возрастание энтропии окружающей среды составит величину (Qо + Lк)/T.
Уравнение энергетического баланса такой системы:
Qo |
|
Qo Lk |
. |
(6) |
|
|
To T
Из уравнения (6) определяется работа, которую необходимо затратить в холодильной установке, работающей по обратному циклу Карно:
T T |
|
|
||
|
|
o |
|
(7) |
T |
|
|||
Lk Qo |
|
. |
||
|
o |
|
|
|
Количество теплоты Qo, которое отводится холодильным агентом от охлаждаемого объекта при температуре Tо < Тос, называется холодопроизводительностью цикла или холодопроизводительностью холодильной установки. На диаграмме Т - S холодопроизводительность соответствует площади прямоугольника 1-4-5-6. Площадь прямоугольника 2-3-5-6 соответствует суммарному количеству теплоты, отдаваемой хладагентом окружающей среде. Разность площадей 2-3-5-6 и 1-4-5-6 соответствует величине затраченной работы Lк (площадь 2-3-4-1).
Энергетический баланс любой холодильной машины:
Qo |
L Q. |
(8) |
где |
L |
работа реального цикла. |
|
Термодинамическая эффективность холодильных циклов выражается отноше- |
|
нием холодопроизводительности Qо к затраченной работе L. Это отношение называется холодильным коэффициентом:
Qo Qo .
L Q Qo
Из диаграммы T - S видно, что
Qo To S1 S2 и Q T S1 S2 .
Подставляя значения Q и Qо в уравнение (9), получим
|
Qo |
|
To S1 S2 |
|
|
To |
. |
|
T S1 S2 To S1 S2 |
|
|||||
|
Q Qo |
|
T To |
||||
(9)
(10)
(11)
Холодильный коэффициент характеризует степень использования механической работы на получение искусственного холода и, как следует из уравнения (11), не зависит от свойств холодильного агента или схемы холодильной установки, а является только функцией температур То и Т. Степень использования механической работы будет тем выше, чем меньше разность между температурами кипения и конденсации.
Холодильный коэффициент нельзя рассматривать как КПД холодильной машины. КПД характеризует долю теплоты, которая может быть превращена в работу, и поэтому является величиной, заведомо меньшей единицы. В данном случае затрачиваемая работа не превращается в теплоту, а служит лишь средством, обеспечивающим перенос определенного количества теплоты с низшего температурного уровня на более высокий. Величина холодопроизводительности Qо обычно больше величины затраченной работы L, поэтому холодильный коэффициент > 1.
Из уравнения (1.2.9) следует, что с понижением температуры кипения То резко возрастает значение затрачиваемой работы, и значительно увеличивается стоимость получения холода.
4
Термодинамический коэффициент полезного действия любого реального цикла определяется отношением холодильного коэффициента реального цикла к холодильному коэффициенту цикла Карно:
|
|
. |
(12) |
|
|||
|
k |
|
|
При понижении температуры кипения термодинамический КПД будет уменьшаться, т.к. возрастут необратимые потери холода.
5
