
2011-veres-08--Obmin_bilkiv--Ch_1-bez_dodatku
.pdf
Протеолітичні ензими
С-кінець |
Серинова протеїназа |
|
Амінопептидаза
Ендопептидаза
Амінокислотний залишок
11

Внутрішньоклітинний протеоліз білків відбувається в лізосомах.
Крім того білкові комплекси в цитоплазмі, відомі як протеосоми, де руйнуються неправильно укладені або «старі» білки.
Ці молекули упізнаються за спеціальним «маркуванням»/ «міченням».
Протеосоми також відіграють важливу роль у представленні антигенів імунними клітинами.
Біля 40 різних гідролаз з оптимальним кислим рН
Лізосома
Цитоплазма |
Н+АТФаза |
АДФ Фн |
АТФ |
12 |
Протеоліз Протеолітичні ензими
Комбінації з кількох ензимів з різною специфічністю є необхідними для повної деградації (розщеплення) протеїнів на вільні амінокислоти.
Протеолітичні ензими поділяються на ендо- і екзопептидази згідно їхніх сайтів розщеплення в субстратній молекулі. Ендопептидази чи протеїнази розрізають пептидні зв'язки всередині пептидних ланцюгів. Вони «розпізнають» і зв'язуються з короткими секціями амінокислотної послідовності білка-субстрату, щоб потім гідролізувати зв'язки між певними амінокислотними залишками у відносно специфічний спосіб.
Протеїнази класифікуються за їх реакційним механізмом. Наприклад, для серинових протеїназ є важливим залишок серину у ферменті для каталітичної дії, а для цистеїнових протеїназ – цистеїну і т.д.
Екзопептидази атакують пептиди із їх кінців. Пептидази, які діють з N-кінця відомі, як амінопептидази, тоді як ті, що розпізнають C- кінець називаються карбоксипептидазами.
Дипептидази гідролізують тільки дипептиди. |
13 |
|
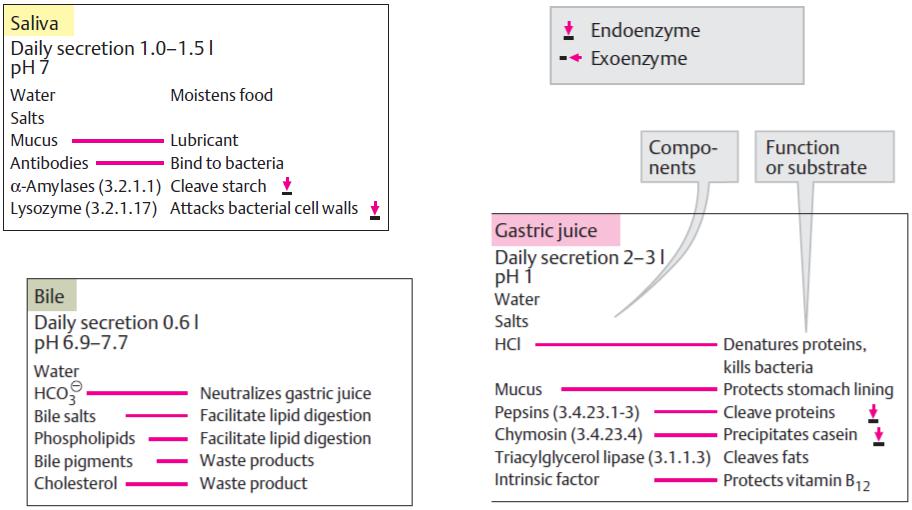
(слина) |
(ендоензими) |
|
(екзоензими) |
(шлунковий сік)
(жовч)
14
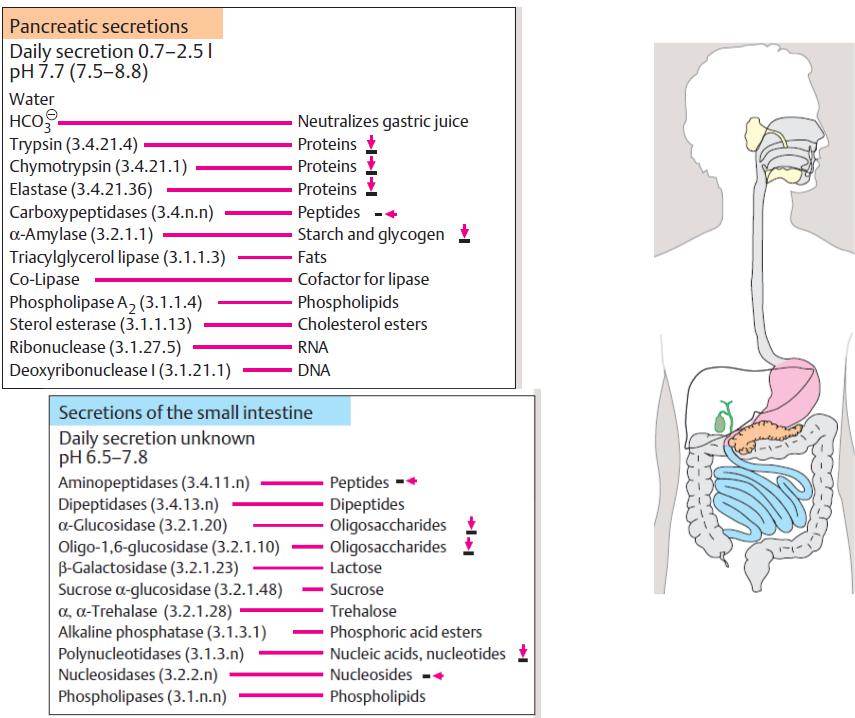
(секрет підшлункової залози)
(секрет тонкого кишечника)
15
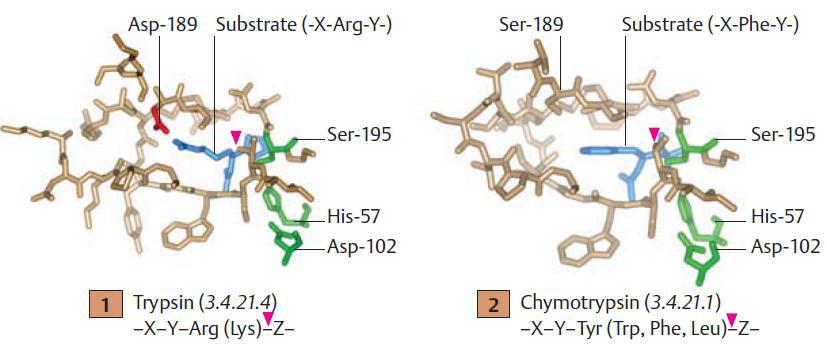
Активний центр трипсину показано на рисунку вище. Сериновий залишок активного центру в ензимі (Ser-195), який підтримується гістидиновим і аспартатними залишками (His-57, Asp-102), нуклеофільно атакує зв’язок, що мав би бути «розрізаним» (червона стрілка). Сайт «розщеплення» в субстратному пептиді локалізується на С-кінцевій стороні лізинового залишку, боковий ланцюг якого є зафіксованим під час каталізу в спеціальній кишені ензиму (зліва).
16
Протеосома
Функціональні протеїни у клітині захищаються від деградації до «дозрівання» (до стану повного формування). Деякі з внутрішньоклітинних активних протеолітичних ензимів знаходяться в лізосомах. Протеїнази, які діють тут, також відомі як катепсини.
Інша регульована система для деградації білків є розташованою в цитоплазмі і містить великі білкові комплекси (масою 2 106 Da), що називаються протеосомами. Протеосоми мають бочковоподібне ядро, яке складається із 28 субодиниць із коефіцієнтом седиментації 20 S.
Протеолітична активність (показана у вигляді «ножиць») локалізується у внутрішньому 20-S ядрі і тому є захищеною. Відкривання у бочковидному ядрі є прикритим 19-S частками зі складною структурою, що контролює вхід до ядра.
17
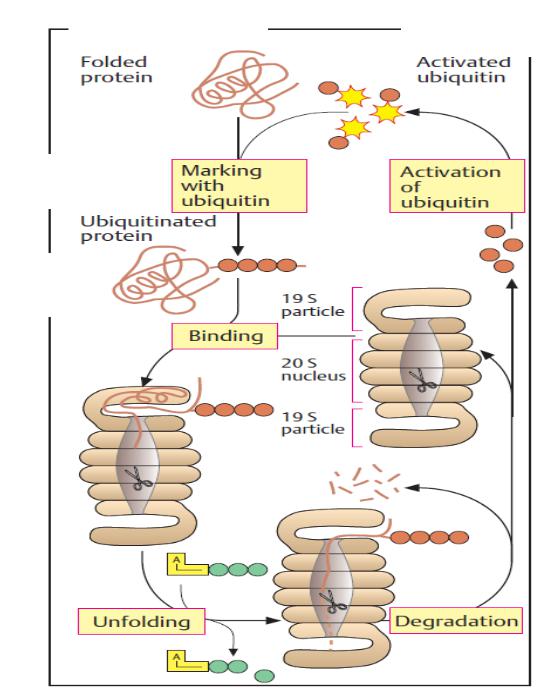
Протеосома |
укладений
протеїн
мічення
убіквітином
мічений
убіквітином
протеїн
зв'язування
АТФ
розгортання
ядро
частка
активований
убіквітин
активація
убіквітину
деградація
Призначені для деградації протеїни у протеосомі (неправильно укладені протеїни або «старі» молекули) мітяться ковалентним зв'язуванням із ланцюгами невеликого білка
убіквітину.
Убіквітин попередньо активується введенням активних тіоефіриних груп.
Мічені убіквітином молекули («убіквітиновані») упізнаються 19S часткою, розгортаючись за використання АТФ, і далі зрушуються всередину ядра, щоб бути деградованими.
Убіквітин не деградується, але використовується знову після активації. 18
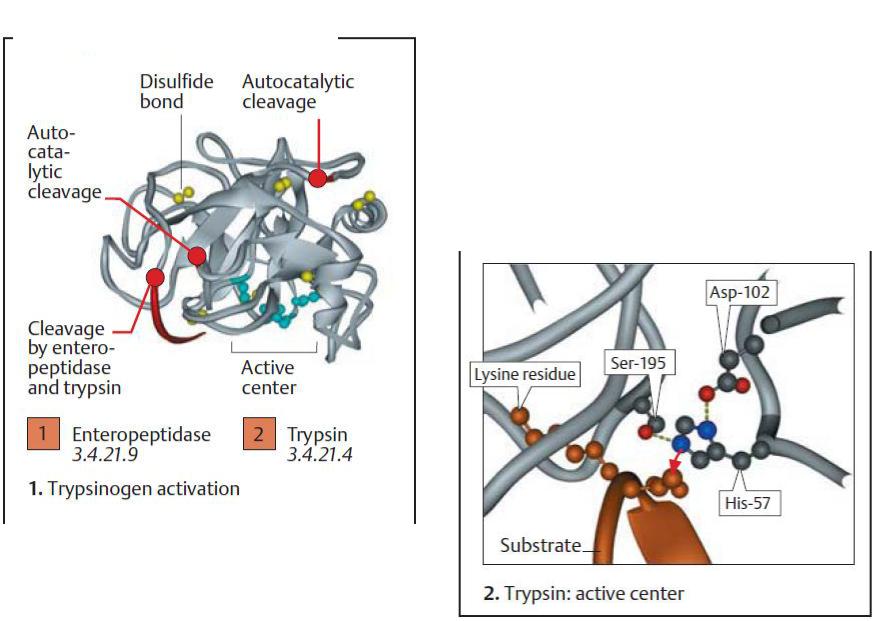
Серинові протеази
Дисульфідний автокаталітичне
зв'язок |
розщеплення |
Активний
центр
Активація
трисиногену
Велика група протеаз має серин в активному центрі. Наприклад, до серинових протеаз належать травні ензими: трипсин, хімотрипсин і еластаза, багато факторів коагуляції та фібринолітичний ензим – плазмін і його активатори.
19
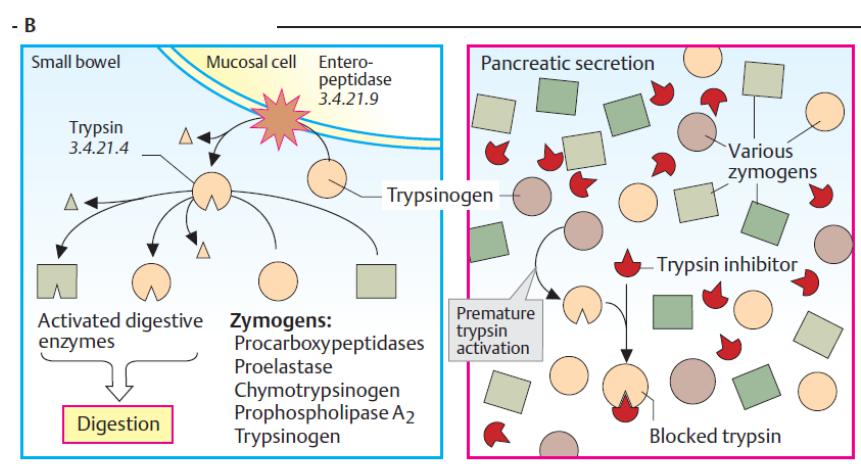
 Активація зимогену
Активація зимогену
клітина слизової оболонки
тонкий кишечник
активовані |
зимогени |
|
|
травні |
|
ензими |
|
заблокований трипсин
Панкреатичні протеїнази виділяються (секретуються) у вигляді проензимів (зимогенів). Активація проензимів також базується на протеолітичному «розрізанні».
На рисунку вище ілюструється така активація на прикладі
трипсиногену, як попередника трипсину. |
20 |
