
Общая химия (АиАХ, ПТМ, ПТЭ, РС, МиТЭ) / лекции / растворы
..docВОПРОС 2. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
При растворении в воде, как в одном из сильно полярных растворителей, вещества претерпевают значительные изменения. В ряде случаев это проявляется в электрической проводимости водных растворов, а иногда и в полном химическом превращении растворенных веществ. Действие воды на растворенные вещества настолько сильно и специфично, сто его изучением занимается целая наука – химия водных растворов.
Химически чистая вода практически не проводит электрический ток. Водные растворы многих органических веществ (спиртов, альдегидов, углеводов) также неэлектропроводны. Но при растворении неорганических веществ (солей, кислот, оснований, большинства оксидов) раствор приобретает электрическую проводимость.
Впервые гипотезу о существовании в таких растворах электрически заряженных частиц вещества – ионов (от греч. – идущий) – высказал С. Аррениус (1887). В целом токопроводящий раствор остается электронейтральным, следовательно, в нем присутствуют и положительные, и отрицательные ионы, суммарные заряды которых взаимно компенсируют друг друга.
Вещества придают раствору электрическую проводимость, если они состоят из ионов, т.е. являются ионными кристаллами, или из молекул, способных распадаться на ионы. Частицы в жидкой фазе могут совершать поступательные движения, поэтому ионные растворы и обладают электрической проводимостью в отличие от ионных кристаллов. Расплавы ионных веществ также обладают электрической проводимостью.
ЭЛЕКТРОЛИТЫ – вещества, которые проводят электрический ток в растворенном или расплавленном состоянии.
ЭЛЕКТРОЛИТИЧЕКАЯ ДИССОЦИАЦИЯ – процесс распада вещества при его растворении или расплавлении.
ЭЛЕКТРОЛИТЫ – это вещества, которые в растворе или расплаве самопроизвольно частично или полностью распадаются на ионы.
К электролитам относятся твердые вещества с ионной кристаллической решеткой или вещества, состоящие из молекул с полярной связью, т.е. большинство кислот, оснований, солей.
При попадании электролита в полярный растворитель (воду) происходит ослабление и разрыв связей между атомами в молекуле растворенного вещества, что приводит к образованию гидратированных заряженных частиц – положительно заряженных катионов и отрицательно заряженных – анионов. Например,
НCl(г)
+ (n+m)
H2O
![]() H+
.
n
H2O
+ Cl-
.
m
H2O
H+
.
n
H2O
+ Cl-
.
m
H2O
NaCl(т)
+ (p+q) H2O
![]() Na+
.
p
H2O
+ Cl-
.
qH2O
Na+
.
p
H2O
+ Cl-
.
qH2O
По способности к электролитической диссоциации электролиты условно подразделяются на сильные и слабые.
К сильным электролитам относят вещества, которые в растворе практически полностью диссоциированы на ионы:
-
почти все соли (кроме CdCl2, HqCl2 и некоторых др.)
-
большинство минеральных кислот ( H2SO4, HNO3, HCl, HBr, HI, HClO4)
-
основания щелочных и щелочноземельных металлов.
К слабым электролитам относят вещества, которые в растворе частично диссоциированы на ионы:
-
почти все органические вещества,
-
некоторые минеральные кислоты (H2CO3, H2S, HCN, HNO2, HClO, H3BO3, H3AsO3)
-
гидроксиды почти всех металлов (кроме щелочных и щелочноземельны), также NH3*H2O, вода.
Рассмотрим диссоциацию уксусной кислоты, относящейся к слабым электролитам. С учетом физико- химического взаимодействия между молекулами и ионами растворенного вещества и полярными молекулами растворителя процесс диссоциации уксусной кислоты в воде будет протекать:
СН3СООН + (n+m) H2O = CH3COO- . n H2O + H+. m H2O.
Обычно диссоциацию
записывают: СН3СООН
![]() CH3COO-
+ H+
CH3COO-
+ H+
Количественно
процесс диссоциации может быть
охарактеризован степенью диссоциации
![]() и константой электролитической
диссоциации КД.
и константой электролитической
диссоциации КД.
Степень диссоциации
![]() - это отношение числа молекул, распавшихся
на ионы, к общему числу молекул
растворенного вещества. Иными словами,
- это отношение числа молекул, распавшихся
на ионы, к общему числу молекул
растворенного вещества. Иными словами,
![]() -
это доля молекул электролита,
распавшихся на ионы, поэтому
-
это доля молекул электролита,
распавшихся на ионы, поэтому
![]() измеряют в долях единицы или процентах.
измеряют в долях единицы или процентах.
Степень диссоциации
возрастает с уменьшением концентрации
электролита в растворе, к увеличению
![]() приводит и нагревание раствора.
приводит и нагревание раствора.
У сильных
электролитов
![]() >30%
, у слабых <
30%.
>30%
, у слабых <
30%.
Пусть температура, при которой протекает обратимая реакция электролитической диссоциации, постоянна, тогда в данной системе наступит равновесие, и концентрации непродиссоциировавших молекул СН3СООН, а также ионов – продуктов диссоциации, становятся постоянными. Получаем:
![]()
Константа равновесия в данном случае называется константой диссоциации, т.к. она характеризует способность электролита диссоциировать на ионы: чем больше КД, тем больше ионов в растворе.
КД зависит от природы электролита, природы растворителя и, как любая константа равновесия, от температуры, но не зависит от концентрации электролита.
Многоосновные кислоты диссоциируют ступенчато. Так, диссоциация Н3РО4 можно представить уравнениями:
Первая ступень:
![]()
![]()
![]()
К1=
![]() =
7,5.10-3
=
7,5.10-3
Вторая ступень:
![]() =
Н+ +
=
Н+ +
![]()
К2=
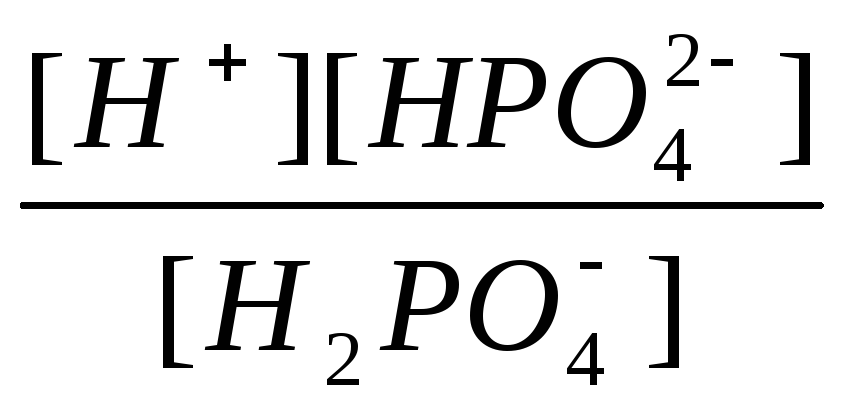 =
6,2.10-8
=
6,2.10-8
Третья ступень:
![]() =
Н+ +
=
Н+ +
![]()
К3=
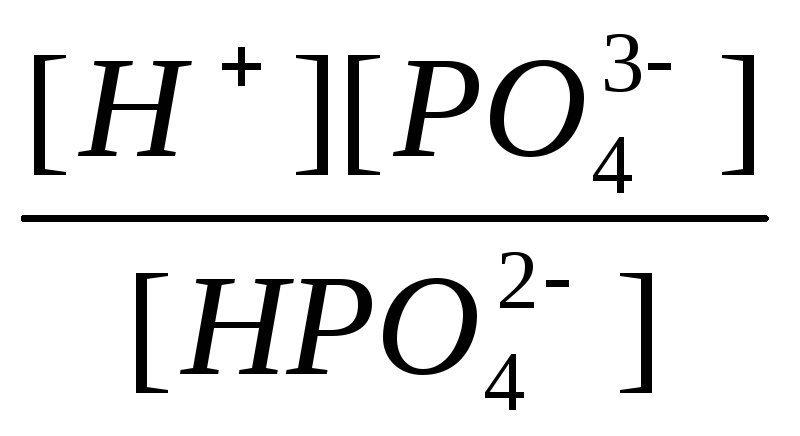 =
2,2.10-13
=
2,2.10-13
Всегда К1>К2>К3, поэтому в растворах таких кислот в заметных количествах присутствуют только те ионы, которые образуются только по первой ступени диссоциации.
Понятие константы диссоциации неприменимо к сильным электролитам, т.к. в растворах сильных электролитов отсутствует равновесие между молекулами и ионами (молекулы практически полностью распадаются на ионы).
При добавлении одного из продуктов диссоциации, т.е. одноименного иона, будет смещать равновесие влево. Следовательно, введение в раствор слабого электролита одноименных ионов подавляет диссоциацию электролита, а значит и уменьшает степень диссоциации.
Определим зависимость между константой диссоциации, степенью диссоциации и концентрацией раствора.
Пусть С – первоначальная концентрация уксусной кислоты, моль/л;
![]() -
степень ее диссоциации, тогда С
-
степень ее диссоциации, тогда С![]() - концентрация продиссоциированных
молекул кислоты; С-С
- концентрация продиссоциированных
молекул кислоты; С-С![]() = С(1-
= С(1-![]() )-
концентрация недиссоциированных молекул
кислоты. Поскольку из 1 молекулы СН3СООН
образуется 1 ион
Н+
и 1 ион СН3СОО-,
то [Н+]=[
СН3СОО-]=
С
)-
концентрация недиссоциированных молекул
кислоты. Поскольку из 1 молекулы СН3СООН
образуется 1 ион
Н+
и 1 ион СН3СОО-,
то [Н+]=[
СН3СОО-]=
С![]() ,
подставляем это в уравнение константы
диссоциации:
,
подставляем это в уравнение константы
диссоциации:
КД=
![]()
Для слабого
электролита при не слишком низкой
концентрации степень диссоциации очень
мала, и 1-![]()
![]() 1,
тогда
1,
тогда
КД=С![]() ,
откуда
,
откуда
![]() .
.
Э ти
выражения характеризуют закон
разбавления Оствальда:
степень диссоциации слабого электролита
обратно пропорциональна корню квадратному
из концентрации раствора, т.е. увеличивается
с разбавлением раствора.
ти
выражения характеризуют закон
разбавления Оствальда:
степень диссоциации слабого электролита
обратно пропорциональна корню квадратному
из концентрации раствора, т.е. увеличивается
с разбавлением раствора.
В данной форме закон применим для бинарных электролитов.
