
умк_Вабищевич_Физика_ч
.1.pdf
2.4. Примеры решения задач
Пример 1.
Определите: 1) среднюю длину свободного пробега молекул; 2) число соударений за 1 с, происходящих между всеми молекулами кислорода, находящегося в сосуде емкостью 2 л при температуре 27°С и давлении 100 кПа.
Решение. Средняя длина свободного пробега молекул кислорода вычисляетсяпоформуле
λ = |
1 |
, |
(1) |
2 π d 2 n |
|||
|
0 |
|
|
где d = 2,9 10-10 м – эффективный диаметр молекулы кислорода; n0 – число молекул в единице объема, которое можно определить по уравнению p = n0kT .
Число молекул равно
n = |
p |
, |
(2) |
|
|||
0 |
kT |
|
|
|
|
|
где k =1,38 10−23 Дж/К – постоянная Больцмана. Подставляя (2) в (1), имеем
|
kT |
|
λ = |
2 π d 2 p . |
(3) |
Число соударений z, происходящих между всеми молекулами за 1 с
z = |
1 |
z N , |
(4) |
|
2 |
|
|
где N – число молекул кислорода в сосуде объемом 2 10-3 м3; <z> – среднее число соударений одной молекулы за 1 с.
Число молекул в сосуде
N = n0V . |
|
(5) |
|
Среднее число соударений молекул за 1 с |
|
||
z = |
v , |
|
(6) |
|
λ |
|
|
где <v> – средняя арифметическая скорость молекулы. Она равна |
|
||
v = |
8RT |
, |
(7) |
|
πµ |
|
|
где µ = 32 10-3 кг/моль – молярная масса кислорода.
201

Подставляя в (4) выражения (5), (6) и (7), находим:
|
|
|
8RT |
|
2 πd 2 p |
|
p |
|
2πd 2 p2V |
|
RT . |
z = |
1 |
|
πµ |
|
|
|
V = |
|
|||
2 |
|
|
kT |
kT |
k2T 2 |
||||||
|
|
|
|
|
|
|
πµ |
Выразим все величины в системе СИ и произведем вычисления:
z = |
2 3,14 2,92 10−20 1010 2 10−3 |
|
|
8,31 300 |
|
= 9 1028 ; |
|||||||
1,382 10−46 9 |
104 |
|
|
3,41 32 |
10−3 |
||||||||
|
|
|
|
|
|||||||||
|
λ = |
|
1,38 10−23 300 |
|
|
= 3,56 |
10−8 . |
|
|||||
|
|
3,14 |
2,9 |
2 |
10 |
−20 |
10 |
5 |
|
||||
|
2 |
|
|
|
|
|
|
|
|||||
Ответ: λ = 3,56 10−8 м, z = 9 1028.
Пример 2.
Определите: 1) коэффициент диффузии; 2) коэффициент внутреннего трения азота, находящегося при температуре 300 К и давлении 105 Па.
Решение. Коэффициент диффузии |
|
|
||
D = 1 |
v λ , |
|
(1) |
|
|
3 |
|
|
|
где v – средняя арифметическая скорость молекул, равная |
||||
v |
= |
8RT , |
|
(2) |
|
|
πµ |
|
|
где µ = 28 10-3 кг/моль – молярная масса азота; |
λ – средняя длина сво- |
|||
бодного пробега молекул. Для нахождения λ |
воспользуемся формулой |
|||
λ = |
|
kT |
, |
(3) |
2 πd 2 p |
||||
где k =1,38 10−23 Дж/К – постоянная Больцмана; d = 3,1 10-10 м – эффективный диаметр молекулы азота. Подставляя (2) и (3) в (1), имеем
D = |
1 |
8RT |
|
|
kT |
|
|
= |
|
2kT |
|
RT . |
|||
3 |
πµ |
|
π |
|
2 |
|
π |
|
2 |
|
|||||
|
2 |
d |
|
|
d |
p |
πµ |
||||||||
|
|
|
|
|
p 3 |
|
|
|
|||||||
Коэффициент внутреннего трения |
|
|
|
|
|
|
|||||||||
|
|
|
η= |
1 |
v |
|
λ ρ, |
|
|
|
|
|
|||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
где ρ – плотность газа при температуре 300 К и давлении 105 Па.
202

Для нахождения ρ воспользуемся уравнением состояния идеального газа. Запишем его для двух состояний азота: при нормальных условиях
(Т0 = 273 К; р0 = 1,01 105 Па):
p V = m RT , |
и |
pV = m RT . |
|||||
0 |
0 |
µ |
0 |
|
µ |
||
Учитывая, что ρ0 |
= |
m |
; ρ = m |
, мы имеем |
|||
|
|||||||
|
|
V0 |
µ |
|
|
||
ρ = ρ0 pT0 . p0T
Коэффициент внутреннего трения газа может быть выражен через коэффициент диффузии
η = Dρ = Dρ0 pT0 . p0T
Выразим величины в системе СИ и проведем вычисления:
D = |
|
2 1,38 10−23 300 |
|
|
8,31 300 |
|
= 4,7 10−5 |
; |
|||||||
|
|
2 |
10 |
−20 |
10 |
5 |
|
3,14 28 |
10 |
−3 |
|||||
3 |
3,14 3,1 |
|
|
|
|
|
|
|
|||||||
|
η = 4,7 10−5 1,25 |
|
105 273 |
= 5,23 10−5 . |
|
||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
1,01 105 300 |
|
|
|
|
||||
Ответ: η = 5,23 10 |
−5 |
кг |
. |
|
|
|
|
|
|
|
|
|
|||
|
м с |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Пример 3.
Два тонкостенных коаксиальных цилиндра длиной 10 см могут свободно вращаться вокруг их общей оси Z. Радиус R большого цилиндра равен 5 см. Между цилиндрами имеется зазор размером d = 2 мм. Оба цилиндра находятся в воздухе при нормальных условиях. Внутренний цилиндр приводят во вращение с постоянной частотой n1 = 20 с-1. Внешний цилиндр заторможен. Определить, через какой промежуток времени с момента освобождения внешнего цилиндра он приобретет частоту вращения n2 = 1 c-1. При расчетах изменением относительной скорости цилиндров пренебречь. Масса m внешнего цилиндра равна 100 г.
Решение. При вращении внутреннего цилиндра слой воздуха увлекается им и начинает участвовать во вращательном движении. Вблизи поверхности этого цилиндра слой воздуха приобретает со временем практически
203
такую же линейную скорость, как и скорость точек на поверхности цилиндра, т.е. v = 2πn1 ( R − d ) . Так как R > d , то приближенно можно считать
v ≈ 2 πn1 R . |
(1) |
Вследствие внутреннего трения момент импульса передается соседним слоям газа и, в конечном счете, внешнему цилиндру. За интервал времени ∆t внешний цилиндр приобретает момент импульса L = p R, где р – импульс, полученный внешним цилиндром. Отсюда
p = |
|
L |
. |
(2) |
|
|
|
||||
С другой стороны |
|
|
R |
|
|
dv |
|
|
|
||
p =η |
S ∆t , |
(3) |
|||
|
dz |
|
|
|
|
где η – динамическая вязкость; dv/dz – градиент скорости; S – площадь
поверхности цилиндра ( S = 2π Rλ). |
|
|
|
|
Приравняв правые части выражений (2) |
и (3) и выразив из получен- |
|||
ного равенства искомый интервал ∆t, получим |
|
|||
∆t = |
L |
|
. |
(4) |
η R dv |
|
|||
|
S |
|
||
|
dz |
|
|
|
Найдем входящие в эту формулу величины L, dv/dz, S. Момент импульса L = J ω, где J – момент инерции цилиндра (J = mR2); m – его масса; ω2 – угловая скорость внешнего цилиндра (ω2 = 2πn2). С учетом этого запишем
L = mR2 2π n = 2π mR2n . |
|
|||
2 |
2 |
|
||
Градиент скорости dv/dz = v/z = |
v/d. Площадь цилиндра |
равна |
||
S = 2 πRλ . Подставив в (4) выражения L, dv/dz, S, получим: |
|
|||
∆t = m d n2 . |
|
|||
|
η v λ |
|
|
|
Заменив здесь v по (1), найдем |
|
|
|
|
∆t = |
m d n2 |
|
||
|
. |
(5) |
||
2 π η R λ n |
||||
|
|
1 |
|
|
Динамическая вязкость воздуха η = 17,2 мкПа с = 1,72 10–5 Па с. Подставив в (5) значения входящих в формулу величин и произведя
вычисления, получим
∆t = 18,5 с.
Ответ: ∆t = 18,5 с.
204
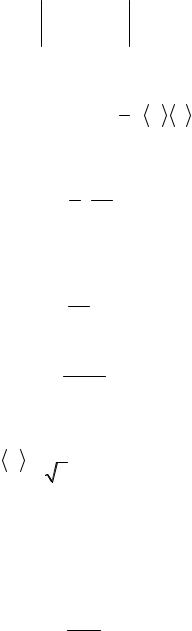
Пример 4.
Пространство между двумя параллельными пластинами площадью 150 см2 каждая, находящимися на расстоянии 5 мм друг от друга, заполнено кислородом. Одна пластина поддерживается при температуре 17°С, другая – при температуре 27°С. Определите количество теплоты, прошедшее за 5 мин посредством теплопроводности от одной пластины к другой. Кислород находится при нормальных условиях.
Эффективный диаметр молекул кислорода считать равным 0,36 нм. Решение. Количество теплоты, перенесенное газом в результате тепло-
проводности от одной пластины к другой
Q = χ ∆∆Tx S t ,
где χ – коэффициент теплопроводности.
∆T = tD |
−tD ; |
χ = 1 ρ λ v . |
2 |
1 |
3 |
|
|
СV – удельная теплоемкость газа при постоянном объеме
CV = 2i MR ,
где i – число степеней свободы (для кислорода i = 5); ρ = m/V – плотность. Используем уравнение Менделеева – Клапейрона
pV = Mm RT ,
откуда
ρ = pR MT .
Средняя длина свободного пробега молекул газа
λ = |
1 |
, |
2 π d 2 n |
где n – концентрация газа.
Уравнение состояния идеального газа p = n k T ,
откуда
n = k pT .
205
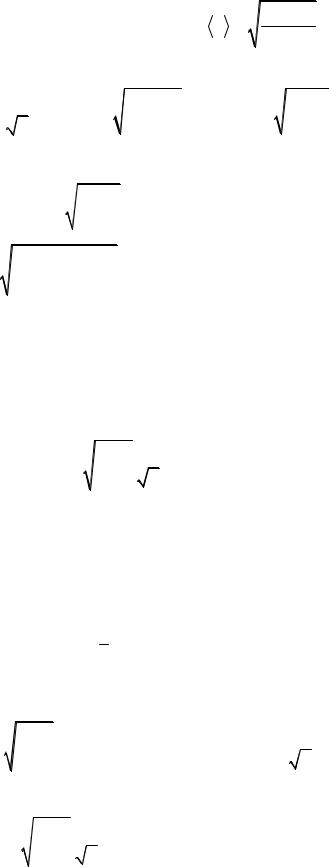
Средняя арифметическая скорость молекулы |
|
v |
= |
8 R T . |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
π M |
||
Тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
χ = 1 |
|
i |
R p M |
|
k T |
|
8 R T = |
i |
|
k |
|
|
RT |
. |
|
2 π d 2 p |
|
π d 2 |
|
|
|||||||||
3 |
2 |
M R T |
|
|
π M |
3 |
|
|
|
π M |
||||
Подставим это выражение в формулу количества теплоты:
|
|
|
|
|
i |
|
k |
|
RT |
|
|
(tD |
−tD) |
|
|
||
|
|
|
Q = |
|
|
|
|
|
|
|
|
2 |
1 |
|
S |
t ; |
|
|
|
|
3 |
π d 2 |
π M |
|
∆x |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Q = |
5 |
|
1,38 10−23 |
|
|
|
8,31 273 |
|
|
27 −17 |
15 10−3 300 = 76,4 (Дж) . |
||||||
3 |
3,14 (3,6 10−10 )2 |
|
3,14 32 10−3 |
5 10−3 |
|||||||||||||
|
|
|
|
|
|
|
|
||||||||||
Ответ: Q = 76,4 Дж.
Пример 5.
Найти зависимость коэффициента диффузии от температуры при постоянномдавлении.
D = |
1 |
υ |
|
= |
1 |
8RT |
kT |
. |
|
λ |
|||||||||
3 |
3 |
|
|||||||
|
|
|
|
πµ 2πσ2 p |
|||||
Поэтомузависимостьимеетвид D = AT 3 2 припостоянномдавлениир.
2 припостоянномдавлениир.
Пример 6.
Найти зависимость коэффициента теплопроводности от температуры. Решение. Поскольку
χ= 13 υλСV ρ,
акаждая из величин определяется как
ρ = |
pµ |
; |
υ = |
8RT ; |
C = |
i |
R ; |
|
= |
kT |
, |
|||||||
λ |
||||||||||||||||||
|
|
|
|
|
||||||||||||||
|
RT |
|
|
πµ |
V |
2µ |
|
|
|
|
2πσ2 p |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
то подставив выражение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
χ = |
1 |
8RT RT pµ υ |
R , |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
3 |
πµ |
2πυ2 p RT 2µ |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
получим
206
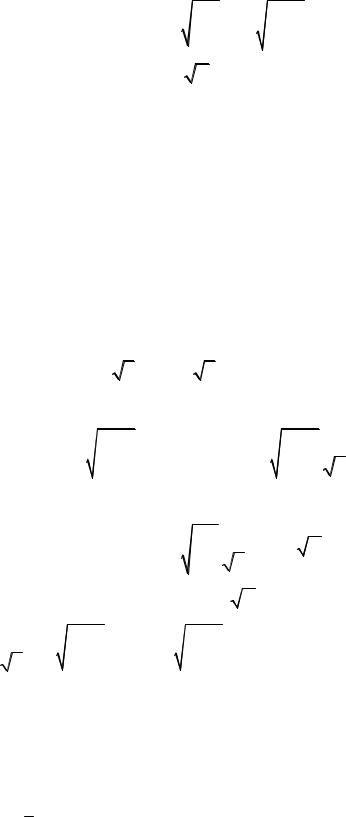
χ = |
1 |
µ k |
|
T |
, |
||
|
|
|
|
|
|
||
3 |
πR πυ2 |
|
πµR |
||||
|
|
|
|||||
т.е. зависимость имеет вид χ = A T .
Пример 7.
Найти зависимость коэффициента внутреннего трения от температуры.
Решение. Поскольку η = 1 υ |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
λρ, |
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
то согласно уравнению Менделеева – Клапейрона |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
pV = m RT ; |
|
|
|
|
pµ |
=ρ. |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
µ |
|
|
|
|
|
|
|
|
|
RT |
||||||
Длина пробега при этом может быть представлена в идее |
||||||||||||||||||||||||||
|
|
|
λ = |
|
1 |
|
|
|
= |
|
|
|
kT |
|
|
, где p = nkT , |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
2πυ2n |
|
|
2πσ2 p |
|
|
|
|
|||||||||||
тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
υ = |
8RT ; |
|
|
|
|
|
|
|
η = 1 |
pµ |
8RT |
kT |
. |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
πµ |
|
|
|
|
|
|
|
|
|
3 RT |
πµ 2πσ2 p |
||||||||||
Окончательно получаем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
η = |
1 k 8R µ |
= A T ; |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
3 R |
|
πµ |
|
σ2 |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
η = A T , |
|
|
|
|
||||||||
где A = 1 |
kp |
8µ |
|
= |
|
2k |
|
= |
|
|
µ |
. |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
3πυ |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
3 |
2πσ2 π R |
|
|
|
|
|
π R |
|
|
|
|
|
|
|
|
|||||||||||
Пример 8.
Найти коэффициент теплопроводности водорода, если известно, что коэффициент вязкости (внутреннего трения) для него при этих условиях
равен 8,6 10-6 нсек/м2. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
η = 1 υ |
λρ; χ = 1 υ |
|
С ρ; |
C = |
i |
|
R |
; υ |
|
|
3ηC |
= |
i |
η R ; |
|||||||||
λ |
|
λρ = 3η; χ = |
|||||||||||||||||||||
|
|
|
|
||||||||||||||||||||
3 |
|
3 |
|
|
|
V |
V |
2 µ |
|
|
|
|
|
|
|
3 |
V |
2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
1 |
−6 |
|
5 |
|
3 |
|
|
|
|
|
−6 |
|
|
−8 |
= 0,09 Вт/мК. |
||||||||
χ = 2 86 10 |
|
|
2 |
8,31 |
10 |
= 90 10 |
|
|
= 9 |
10 |
|
||||||||||||
207

Пример 9.
Определите, во сколько раз отличается коэффициент динамической вязкости η углекислого газа и азота, если оба газа находятся при одинаковых условиях.
|
|
η = 1 |
υ |
|
|
|
|
|
pµ |
|
; λ = |
|
kT |
|
|
; υ = |
8RT |
; |
|
|||||||||||
|
|
λρ; ρ = |
|
|
||||||||||||||||||||||||||
|
|
|
RT |
|
|
|
|
|
|
πµ |
|
|||||||||||||||||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
2πσ2 p |
|
|
|
|
|||||||||||
η1 |
= |
1 pµ1 |
|
|
|
kT |
|
8RT |
; η2 |
= |
1 pµ2 |
|
kT |
|
|
8RT |
; |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
3 RT |
|
|
2πσ12 p |
|
πµ1 |
3 |
RT |
|
2πσ22 p |
πµ2 |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
η |
|
|
|
µ |
1 |
σ2 |
|
µ |
2 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
1 |
= |
|
|
2 |
|
|
|
. |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
η2 |
µ2 |
|
µ2 |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
σ12 |
|
|
|
|
|
|
|
|
|
|||||||||||
Пример 10.
Цилиндрический термос с внешним радиусом r2 = 10 см и внутренним r1 = 9 см, высотой 20 см наполнен льдом. Температура льда 0° С, наружная температура 20° С.
1). При каком предельном давлении воздуха между стенками термоса коэффициент теплопроводности будет зависеть от давления? Температуру воздуха считать 10° С, диаметр молекул воздуха 3 10-10 м, µ = 29 г/моль.
2). Найти коэффициент теплопроводности воздуха при давлении:
|
|
|
|
|
|
|
|
|
|
|
а) 760 мм. рт. ст.; |
|
|
б) 10–4 мм. рт. ст. |
|
|
||||||||||||||||
3). Какое количество тепла проходит за 1 мин через боковую поверх- |
||||||||||||||||||||||||||||||||
ность термоса средним радиусом 9,5 см за счет теплопроводности |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
а) 760 мм рт. ст.; |
|
|
б) 104 мм рт. ст. |
|
|
||||||||||||||||
1. |
При |
|
= d коэффициент теплопроводности начинает зависеть от |
|||||||||||||||||||||||||||||
λ |
||||||||||||||||||||||||||||||||
давления |
|
|
= |
|
|
kT |
|
p = |
|
|
|
kT |
, p |
= 7,37 10−3 мм рт. ст. |
||||||||||||||||||
λ |
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
2πυ2 p |
|
|
|
2πυ2d |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
а) χ = 1 |
υ |
|
С ρ = |
|
ik |
|
|
T |
|
|
|
и χ =13,1 10−6 |
|
Вт |
; |
|
|
|
||||||||||||||
λ |
|
|
|
|
|
|||||||||||||||||||||||||||
3 |
|
|
|
|
V |
|
|
|
πυ2 |
|
|
π µ |
R |
|
|
|
|
|
|
|
м К |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
б) χ= 1 dυρ C |
|
= 1 d |
|
8RT |
pµ |
|
Ri |
= |
i |
dp |
|
8R |
|
=1,78 10−4 |
Вт |
. |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
3 |
|
|
|
|
|
V |
|
|
3 |
|
µ RT 2µ 6 |
|
|
π µ T |
|
|
|
|
|
м К |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
2. |
Q = χ |
∆T |
∆S∆t, но ∆S = 2π rλ, |
|
где r |
= |
r1 + r2 |
, Q = χ ∆T 2π rλ ∆t ; |
||||||||||||||||||||||||
∆x |
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
∆T |
|||||||
тогда с учетом 2) получаем |
|
|
|
|
|
|
|
|
|
б) Q2 = 2,55 Дж. |
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
а) Q1 = 188 Дж; |
|
|
|
|
|||||||||||||||||
208
3. УЧЕБНЫЙ БЛОК «ТЕРМОДИНАМИКА. АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВА»
Введение
Раздел механики, в котором изучается законы движения жидкости и ее взаимодействия с телами, обтекаемыми средой, называется гидродинамикой. При изучении движения жидкости рассматривают ее как сплошную среду, отвлекаясь от молекулярного строения жидкости. В ряде случаев пренебрегают внутренним трением и рассматривают модель идеальной жидкости.
При изучении данного раздела студенты должны
иметь представление:
–об основных физических величинах: давлении, работе, кинетической и потенциальной энергии;
–об основных законах гидростатики: законе Архимеда, законе Паскаля. Знание гидростатического давления;
обладать навыками:
–примененияэлементовдифференциальногоиинтегральногоисчисления.
Учебная программа блока
Содержание программы |
Форма |
Литература |
||
|
подготовки |
|
|
|
1. Первое начало термодинамики. Работа. Внут- |
|
[2, § 9.1 |
– 9.3], |
|
ренняя энергия. Теплота |
лекция |
[5, § 82 – 84], |
||
|
|
[6, § 14, 15] |
||
2. Применение первого начала термодинамики к |
|
[2, § 9.5 |
– 9.6], |
|
изопроцессам. Зависимость теплоемкости иде- |
|
|||
лекция |
[5, § 87 |
– 90], |
||
ального газа от вида процесса. Адиабатный про- |
||||
|
[6, § 21] |
|||
цесс. Политропный процесс |
|
|||
|
|
|
||
3. Обратимые и необратимые процессы. Круговой |
|
[2, § 11.1 |
– 11.2], |
|
процесс (цикл). Цикл Карно |
лекция |
[5, § 105], |
||
|
|
[6, § 29 – 30] |
||
4. Энтропия. Второе начало термодинамики. Вы- |
|
|
|
|
числение энтропии идеального газа. |
лекция |
[2, § 11.3 |
– 11.6], |
|
Статистическое толкование второго начала тер- |
[5, § 104, 107] |
|||
|
||||
модинамики |
|
|
|
|
5. Отступления от законов идеальных газов. Ре- |
|
[2, § 12.1 |
– 12.3], |
|
альные газы. Уравнение Ван-дер-Ваальса |
лекция |
[5, § 91], |
||
|
|
[6, § 97 – 98] |
||
209
|
|
|
Окончание табл. |
6. Фазовые переходы I и II рода. Критическое со- |
|
|
[2, § 12.3], |
стояние. |
|
лекция |
[5, § 120, 123], |
Уравнение Клапейрона – Клаузиуса |
|
|
[6, § 111, 113] |
7. Поверхностное натяжение. Формула Лапласа. |
|
самост. |
[5, § 115 – 119], |
Капиллярные явления |
|
[6, § 106 – 109] |
|
|
|
||
Цели обучения |
|
|
|
|
|
||
студент должен знать |
студент должен уметь |
||
– определения теплоты, внутренней энергии и работы |
– вычислять изменение внут- |
||
газа; |
ренней энергии, работу газа и |
||
– связь параметров состояния при различных про- |
количество теплоты в различ- |
||
цессах; |
ных процессах; |
||
– первый закон термодинамики. Смысл величин, |
– определять КПД различных |
||
входящих в него; |
круговых процессов; |
||
– понятие теплоемкости для различных процессов; |
– вычислять изменение энтро- |
||
– политропический процесс; |
пии; |
|
|
– КПД тепловых машин; |
– находить связь критических |
||
– цикл Карно; |
параметров вещества и попра- |
||
– определение второго начала термодинамики; |
вок в уравнении Ван-дер- |
||
– способы вычисления энтропии идеального газа; |
Ваальса; |
|
|
– статистическое толкование второго начала термо- |
– определять температуру фа- |
||
динамики; |
зового перехода; |
||
– уравнение Ван-дер-Ваальса. Смысл поправок для |
– определять работу сил по- |
||
давления и объема; |
верхностного натяжения, лап- |
||
– фазовое состояние вещества. Фазовые переходы I |
лассово давление |
||
и II рода. Критическое состояние; |
|
|
|
– уравнение Клапейрона – Клаузиуса; |
|
|
|
– причины возникновения поверхностного натяже- |
|
|
|
ния, добавочного давления над искривленной по- |
|
|
|
верхностью |
|
|
|
3.1. Краткое содержание теоретического материала
Физические свойства макросистем, состоящих из большого количества частиц, изучаются взаимно дополняющими методами: статистическим и термодинамическим. Термодинамический метод основан на анализе условий и количественных соотношений при различных превращениях энергии, происходящих в системе. Внутренняя энергия термодинамической системы включает в себя кинетическую энергию движения частиц (поступательного и вращательного движения), а также потенциальную энергию их взаимодействия. В идеальном газе пренебрегают силами межмолеку-
210
