3 курс 1 часть / 0079436_7441E_eremin_v_v_kargov_s_i_uspenskaya
.pdfГ л а в а 5. Химическая кинетика |
377 |
25-2. Диаметр метильного радикала равен 3.8 Å. Какова максимальная константа скорости (в л моль–1 с–1) реакции рекомбинации метильных радикалов при 27 °С?
25-3. Оцените стерический фактор реакции H + пара-H2 → орто-H2 + H, если константа скорости при 27 °С равна 7.3 107 см3 моль–1 с–1, а энергия активации – 34.3 кДж моль–1. Радиусы атома и молекулы водорода примите равными 0.053 нм и 0.11 нм, соответственно.
25-4. Вычислите значение стерического множителя в реакции димеризации этилена
2C2H4 → C4H8
при 300 К, если опытная энергия активации равна 146.4 кДж моль–1, эффективный диаметр этилена равен 0.49 нм, а опытная константа скорости при этой температуре равна 1.08 10–14 см3 моль–1 с–1.
25-5. Константа скорости реакции
(C2H5)3N + C2H5Br → [(C2H5)4N]Br
в бензоле при температуре 30 °С равна 2.22 10–3 см3 моль–1 с–1. Рассчитайте стерический фактор для этой реакции, если энергия активации
равна 47.8 кДж моль–1, а плотности триэтиламина и этилбромида равны
0.723 и 1.456 г см–3.
25-6. Опытная константа скорости реакции
C2H4 + H2 → C2H6
равна 1.77 10–2 л моль–1 с–1 при 787 К. Средний диаметр молекулы этилена – 4 Å, молекулы водорода – 2 Å, стерический множитель равен 0.05. Найдите истинную энергию активации этой реакции.
25-7. Экспериментально найденная энергия активации распада ацетона в газовой фазе при давлении паров 1 атм и Т = 800 К составляет 57.2 ккал моль–1. Приняв эффективный диаметр молекулы равным 5 Å, рассчитайте константу скорости и объясните возможную причину расхождения с экспериментальным значением 4 10–3 с–1.
25-8. Для реакции димеризации бутадиена при нормальном давлении получена следующая зависимость константы скорости (см3 моль–1 с–1) от температуры:
lg k = 8.362 + 0.5 lg T – 5070/T.
Определите долю активных столкновений и рассчитайте эффективный диаметр столкновений при температуре 578 К. Стерический фактор равен 1.6 10–5.
378 |
Г л а в а 5. Химическая кинетика |
25-9. Опытное значение константы скорости бимолекулярной реакции между веществами X и Y при 18 °С равно 4.96 10–4 л моль–1 с–1. Приняв радиусы молекул равными 0.264 нм и 0.274 нм, вычислите истинную и опытную энергии активации. Стерический множитель для этой реакции равен 0.8, молярные массы – 142 и 96 г моль–1.
25-10. Реакция изомеризации цис-бутен-2 → транс-бутен-2 протекает при 469 °С. Опытная энергия активации равна 263 кДж моль–1, а экспериментальная константа скорости при высоких давлениях k∞ = 1.90 10–5 с–1. Используя теорию столкновений, рассчитайте константу скорости k1 и давление перехода для этой реакции. Диаметр молекулы примите равным 0.5 нм.
25-11. Используя данные предыдущей задачи, определите сколько колебательных степеней свободы участвует в реакции изомеризации цис- бутена-2, если экспериментальное давление перехода составляет
0.04 Торр.
25-12. Термическое разложение ацетальдегида – бимолекулярная реакция. Опытная энергия активации равна 45.5 ккал моль–1, а диаметр молекулы – 4.5 Å. Рассчитайте период полупревращения этой реакции при давлении 1 атм и температуре 800 К.
25-13. Определите температурную зависимость константы скорости для реакции
N2 + O2 → 2NO
при низких и высоких температурах.
25-14. Определите температурную зависимость константы скорости для реакции
CH3I → CH3 + I
при низких и высоких температурах.
25-15. Определите температурную зависимость константы скорости для реакции
H + Br2 → HBr + Br (нелинейный активированный комплекс)
при низких и высоких температурах.
25-16. Для реакции CO + O2 = CO2 + O зависимость константы скорости от температуры при низких температурах имеет вид:
k(T) ~ T –3/2 exp(–E0/RT).
Какую конфигурацию – линейную или нелинейную – имеет активированный комплекс?
25-17. Для реакции 2NO → (NO)2 зависимость константы скорости от температуры при невысоких температурах имеет вид:
k(T) ~ T –1 exp(–E0/RT)
Г л а в а 5. Химическая кинетика |
379 |
Какую конфигурацию – линейную или нелинейную – имеет активированный комплекс?
25-18. Используя теорию активированного комплекса, вычислите истинную энергию активации E0 для реакции:
CH3 + C2H6 → CH4 + C2H5
при T = 300 K, если опытная энергия активации при этой температуре равна 8.3 ккал моль–1.
25-19. Выведите соотношение между опытной и истинной энергиями активации для реакции
2XY → нелинейный комплекс.
25-20. Используя статистический вариант ТАК, оцените стерический множитель для бимолекулярной реакции 2HI → H2 + I2 в газовой фазе.
25-21. Определите энергию активации мономолекулярной реакции при 1000 К, если частота колебаний по разрываемой связи равна ν = 2.4 1013 с–1, а константа скорости равна k = 510 мин–1.
25-22. Константа скорости реакции первого порядка разложения бромэтана при 500 °С равна 7.3 1010 с–1. Оцените энтропию активации этой реакции, если энергия активации равна 55 кДж моль–1.
25-23. Разложение перекиси ди-трет-бутила в газовой фазе представляет собой реакцию первого порядка, константа скорости которой (в с–1) зависит от температуры следующим образом:
k = 3.2 1016 exp (−4700 / T ).
Используя теорию активированного комплекса, рассчитайте энтальпию и энтропию активации при температуре 200 °С.
25-24. Изомеризация диизопропилового эфира в аллилацетон в газовой фазе представляет собой реакцию первого порядка, константа скорости которой (в с–1) зависит от температуры следующим образом:
k = 5.4 1011 exp (−3520 / T ).
Используя теорию активированного комплекса, рассчитайте энтальпию и энтропию активации при температуре 400 °С.
25-25. Зависимость константы скорости (с–1) разложения винилэтилового эфира
C2H5–O–CH=CH2 → C2H4 + CH3CHO
от температуры имеет вид
k = 2.7 1011 exp (−10200 / T ).
Рассчитайте энтропию активации при 530 °С.

380 |
Г л а в а 5. Химическая кинетика |
25-26. Для реакции
C2H5Br → C2H4 + HBr
параметры уравнения Аррениуса равны:
A = 7.2 1012 с–1, E = 218.0 кДж моль–1.
Рассчитайте энтропию, энтальпию и энергию Гиббса активации этой реакции при 200 °С.
25-27. Для диссоциации димера циклопентадиена в газовой фазе предэкспоненциальный множитель в уравнении Аррениуса равен 1.3 1013 c–1, а опытная энергия активации составляет 35 ккал моль–1. Вычислите константу скорости реакции и энтропию активации при 100 °С.
25-28. Для реакции
CH3COOC2H5 → CH3COOH + C2H4
параметры уравнения Аррениуса равны:
A = 3.2 1012 с–1, E = 200.5 кДж моль–1.
Рассчитайте энтропию, энтальпию и энергию Гиббса активации этой реакции при 200 °С.
25-29. Предэкспоненциальный множитель для реакции термического разложения озона равен 4.6 1012 л моль–1 с–1, опытная энергия активации составляет 10 кДж моль–1. Найдите изменение энтропии, энтальпии и энергии Гиббса для процесса активации при 400 К.
25-30. Используя данные о температурной зависимости константы скорости, определите энтропию и энтальпию активации при взаимодействии гидразина с малахитовым зеленым:
T, °C |
7 |
14.8 |
23.8 |
30 |
38.4 |
k, М–1 мин–1 |
1060 |
1580 |
2480 |
3750 |
4680 |
25-31. Используя данные табл. П-13 (Приложение), рассчитайте энтальпию, энтропию и энергию Гиббса активации при T = 800 К для газофазной реакции 2HI → H2 + I2. Определите стерический множитель и сравните его с оценкой, полученной в задаче 25-20.
25-32. В газовой фазе вещество X мономолекулярно превращается в вещество Y. Константы скорости реакции при температурах 120 и 140 °С равны, соответственно, 1.806 10–4 и 9.14 10–4 с–1. Рассчитайте среднюю энтропию и теплоту активации в этом температурном интервале.
25-33. Используя теорию столкновений и теорию активированного комплекса, рассчитайте энтропию активации для столкновения двух
атомов при 300 К. Радиусы атомов – 0.066 и 0.099 нм; атомные массы – 16 и 35 г моль–1.
Г л а в а 5. Химическая кинетика |
381 |
§ 26. Химическая динамика
Изучением временнóго поведения частиц в ходе элементарных реакций занимается специальный раздел физической химии – химическая динамика. Основной объект внимания химической динамики – активированный комплекс, или переходное состояние химической реакции, а ее главная задача – определить структуру активированного комплекса и проследить процесс его образования и распада в реальном масштабе времени.
Отличие химической динамики от химической кинетики
Хотя химическая динамика и химическая кинетика генетически связаны друг с другом, они принципиально отличаются друг от друга по задачам, объектам и методам исследования. Основные отличия суммированы в таблице 26.1.
Отличие химической динамики от химической кинетики |
Таблица 26.1 |
||
|
|
|
|
|
Химическая кинетика |
Химическая динамика |
|
Главная |
Подсчет числа химических превра- |
Определение структуры активиро- |
|
щений и определение механизма ре- |
ванного комплекса и анализ про- |
||
задача |
цесса его образования и распада в |
||
|
акции |
реальном времени |
|
|
|
|
|
Объекты |
Молекулы, находящиеся в тепловом |
|
|
равновесии и обладающие равно- |
Нестационарные |
колебательные |
|
исследования |
весным распределением по степе- |
состояния – волновые пакеты |
|
|
ням свободы |
|
|
Масштаб |
от 10–11 до 105 с |
от 10–14 до 10–11 с |
|
времени |
|
|
|
Если динамика химической реакции известна в виде классических траекторий ядер или зависимости волновых пакетов от времени, то можно решить одну из основных задач химической кинетики и теоретически определить константу скорости реакции. Для этого рассчитывают вероятности переходов с энергетических уровней реагентов на энергетические уровни продуктов и находят среднее значение вероятности перехода с учетом распределения Больцмана по энергии. Таким образом, химическая динамика дает гораздо более подробное описание элементарных химических реакций, чем химическая кинетика: последняя получается из первой в результате процедуры усреднения. Соотношение между этими двумя разделами физической химии в каком-то смысле аналогично взаимосвязи микроскопического и макроскопического подходов в статистической термодинамике (см. § 14).
382 |
Г л а в а 5. Химическая кинетика |
Главная проблема в исследовании динамики элементарных химических реакций состоит в том, что время жизни активированных комплексов обычно очень мало. Самые быстрые из элементарных реакций, для которых достаточно одного колебания, могут происходить за время 10–14 с. Существуют и более медленные реакции, в которых сначала возбуждается одно колебание, затем возбуждение постепенно передается другому колебанию и наконец разрывается связь. Такие элементарные реакции могут продолжаться довольно «долго»: ~10–11 с. Для измерения столь малых промежутков времени используют специальную единицу – фемтосекунду (фс): 1 фс = 10–15 с. В этом масштабе время протекания элементарных реакций составляет 10 ÷ 104 фс. Реакции в нижней части этого диапазона считают быстрыми, в верхней – «медленными».
Так, например, реакция фотодиссоциации
ICN + hν → I + CN
происходит за 200 фс, фотодиссоциация циклобутана
C4H8 + hν → 2CH2=CH2
длится около 700 фс, бимолекулярная реакция
H + CO2 → OH + CO
длится 1000 фс, а диссоциация тетрафтордииодэтана на тетрафторэтилен и два атома иода
C2F4I2 + hν → C2F4 + 2I
имеет два временных масштаба: первый атом иода отщепляется быстро, за 200 фс, а второй – за время, в 100 раз большее.
Экспериментальные методы анализа химической динамики
Для изучения столь быстрых процессов необходимо иметь измерительное устройство с соответствующим временным разрешением. Возможность осуществлять эксперименты фемтосекундной длительности появилась только в конце 1980-х годов, когда был изобретен способ временного сжатия лазерных световых импульсов до 6 фс. До этого времени структуру переходных состояний и динамику элементарных реакций определяли с помощью косвенных методов.
Экспериментальные косвенные измерения основаны на следующей идее: пусть известно состояние молекул или атомов до реакции и известно также их состояние после реакции; сравнивая одно с другим, иногда можно сделать выводы о времени жизни и структуре переходного состояния. Например, если создать пучок молекул CH3I, ориентированных в одном направлении, и подействовать на них поляризованным
Г л а в а 5. Химическая кинетика |
383 |
лазерным излучением, то связь C−I разрывается и происходит реакция мономолекулярного распада:
CH3I + hν → [CH3---I] → CH3 + I
(квадратные скобки обозначают переходное состояние). Если молекула распадается быстро (по сравнению с вращением молекулы), то все атомы иода после реакции будут двигаться в одном направлении, поскольку за время реакции исходная молекула не успеет повернуться. Если же распад молекулы происходит медленно, то благодаря вращению атомы иода будут разлетаться во всех направлениях. Оказывается, что все атомы иода, образующиеся в этой реакции, двигаются примерно в одном направлении. Это означает, что распад возбужденной молекулы происходит намного быстрее, чем ее вращение, т.е. время жизни переходного состояния не превышает 1000 фс.
Для того, чтобы получить более детальную информацию – о положении ядер в каждый момент времени, в эксперименты надо ввести временное разрешение, которое в случае элементарных реакций имеет порядок фемтосекунд.
В простейшей схеме фемтосекундного эксперимента на реагенты, приготовленные в виде молекулярных пучков, действуют два световых импульса: первый импульс (импульс накачки) инициирует элементарную реакцию, а второй (зондирующий) импульс, который стартует с некоторой задержкой относительно первого, считывает информацию о строении переходного комплекса в момент воздействия на него. Второй импульс как бы «фотографирует» переходный комплекс с очень короткой экспозицией. Используя различные времена задержки между двумя импульсами, можно получить подробную информацию о ходе протекании химической реакции в реальном времени с разрешением несколько фемтосекунд.
Поясним эту схему на примере реакции фотодиссоциации иодциана
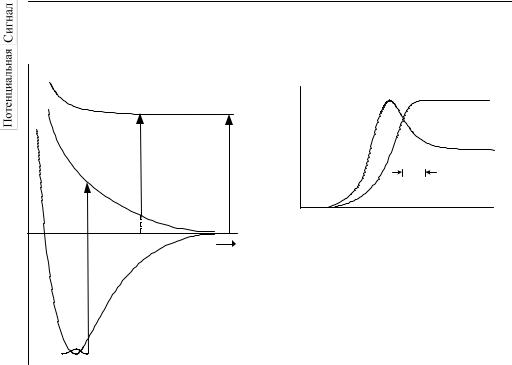
(рис. 26.1):
ICN + hν → [I CN]* → I + CN.
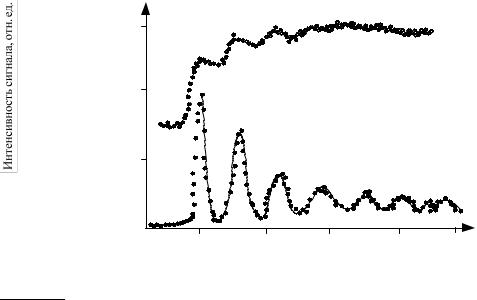
Молекула сначала находится в основном электронном состоянии с потенциальной энергией V0(R), где R – расстояние между атомом иода и центром масс фрагмента CN. Первый световой импульс с длиной волны λ1 возбуждает молекулу и переводит ее в электронное состояние с потенциальной энергией V1(R). В этом состоянии молекула неустойчива и начинает распадаться на части: I и CN, которые удаляются друг от друга. Зондирующий импульс с длиной волны λ2* может перевести фрагмент CN в возбужденное состояние CN* (с потенциальной энергией V2(R)), которое самопроизвольно излучает свет (флуоресцирует). Интенсивность флуоресценции CN* и есть экспериментально измеряемый сигнал.
Г л а в а 5. Химическая кинетика |
385 |
то такой импульс может возбудить молекулу CN только после окончания реакции распада, т.е. он зондирует только продукт реакции и таким образом фиксирует момент окончания реакции. Изменение длины волны зондирующего импульса от λ2* до λ2∞ позволяет просканировать аналогичным образом всю шкалу изменения R от R* до R → ∞ и найти зависимость R(t) в процессе реакции, т.е. определить динамику реакции распада.
Этот эксперимент вошел в историю науки (1987 год) как первое исследование химической реакции в реальном масштабе времени с фемтосекундным разрешением.
Другой знаменитый эксперимент был проведен спустя год. В нем изучалась динамика разрыва связи в молекуле NaI:
NaI → Na + I.
Импульс накачки, действуя на молекулу, находящуюся в основном ионном состоянии Na+I–, переводит ее в возбужденное ковалентное состояние NaI.
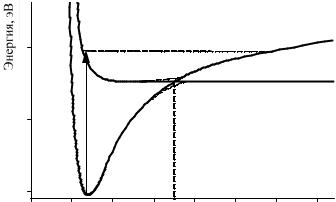
В возбужденной молекуле ядра Na и I начинают двигаться относительно друг друга (рис. 26.2). Когда расстояние становится равным примерно 6.9 Å, они достигают точки пересечения потенциальных кривых ионного и ковалентного состояний. После этого у молекулы две возможности: остаться в неустойчивом ковалентном состоянии и распасться на нейтральные атомы Na и I или перейти в устойчивое (связанное) ионное состояние, в котором будут продолжаться колебания ядер. При каждом прохождении точки пересечения потенциалов часть молекул распадается на атомы, а другая часть продолжает колебания.
|
|
V1 |
|
|
|
|
|
4 |
|
|
|
|
|
|
Na+ + I – |
|
|
нм |
|
|
|
|
Na + I |
|
|
|
|
|
|
|
|
2 |
|
= 310 |
|
|
Rx = 6.93 Å |
|
|
|
V0 |
|
|
|
|
||
|
|
λ |
|
|
|
|
|
0 |
|
|
|
|
|
|
|
0 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
|
|
Межъядерное расстояние, Å |
|
|
|||
Потенциальные кривые ионного и ковалентного электронных |
Рис. 26.2 |
|
состояний молекулы NaI. При прохождении точки пересечения слева |
||
|
||
направо возбужденная молекула может либо перейти в ионное состояние |
|
|
и остаться на верхней кривой, либо перейти в ковалентное состояние |
|
|
на нижнюю кривую и распасться на атомы. Вероятность распада |
|
|
при каждом прохождении составляет около 12% |
|