
- •Содержание
- •История
- •Происхождение названия
- •Нахождение в природе
- •Месторождения
- •В окружающей среде
- •Изотопы
- •Получение
- •Физические свойства
- •Химические свойства Характерные степени окисления
- •Свойства металлической ртути
- •Применение ртути и её соединений Медицина
- •Техника
- •Металлургия
- •Химическая промышленность
- •Сельское хозяйство
- •Токсикология ртути
- •Гигиеническое нормирование концентраций ртути
- •Демеркуризация
Химические свойства Характерные степени окисления
-
Степень окисления
Оксид
Гидроксид
Характер
Примечания
+1
Hg2O
<Hg2(OH)2>*
Слабоосновный
Склонность к диспропорционированию
+2
HgO
<Hg(OH)2>**
Очень слабое основание, иногда — амфотерный
Гидроксид не получен, существуют только соответствующие соли Гидроксид существует только в очень разбавленных (<10−4моль/л) растворах.
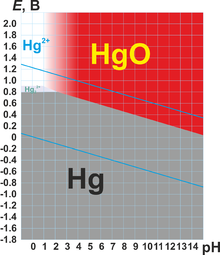
Диаграмма Пурбе системы Hg-HgO[12]
Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть представляет собой двухъядерный катион Hg22+ со связью металл-металл. Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые. В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании:
![]()
подщелачивании:
![]()
добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования и гидролиза гидроксид ртути (I) получить не удаётся.
На холоде ртуть +2 и металлическая ртуть, наоборот, сопропорционируют. Поэтому, в частности, при реакциинитрата ртути (II) со ртутью получается нитрат ртути (I):
![]()
В степени окисления +2 ртуть образует катионы Hg2+, которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных (<10−4моль/л) растворах. В более концентрированных растворах он дегидратируется:
![]()
В очень концентрированной щелочи оксид ртути частично растворяется с образованием гидроксокомплекса:
![]()
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
Из элементов IIБ группы именно у ртути появляется возможность разрушения очень устойчивой 6d10 — электронной оболочки, что приводит к возможности существования соединений ртути(IV), но они крайне малоустойчивы, поэтому эту степень окисления скорее можно отнести к курьёзной, чем к характерной. В частности, при взаимодействии атомов ртути и смеси неона и фтора при температуре 4 К получен HgF4.
Свойства металлической ртути
Ртуть — малоактивный металл. Она не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке[15]:
![]()
и азотной кислоте:
![]()
Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути:
![]()
При растворении избытка ртути в азотной кислоте на холоде образуется нитрат Hg2(NO3)2.
При нагревании до 300 °C ртуть вступает в реакцию с кислородом:
![]()
При этом образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ.
![]()
Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода. При нагревании ртути с серой образуется сульфид ртути(II):
![]()
Ртуть также реагирует с галогенами (причём на холоде — медленно).
Ртуть можно окислить также щелочным раствором перманганата калия:
![]()
и различными хлорсодержащими отбеливателями. Эти реакции используют для удаления металлической ртути.

Словенский город Идрия — крупнейший в Европе центр добычи ртути с XV века
