
- •Стистическая физика
- •РАСПРЕДЕЛЕНИЕ ГИББСА
- •1. Каноническое распределение
- •2 Свободная энергия и статистическая сумма
- •3 Распределение Максвелла
- •4. Большое каноническое распределение
- •5. Свяь большого канонического распределения с каноническим
- •ИДЕАЛЬНЫЕ ГАЗЫ
- •1 Распределение Больцмана
- •2 Термодинамические функции и уравнение состояния идеального газа
- •3. Теорема о равномерном распределении кинетической энергии по степеням свободы и теорема о вириале
- •4 Многоатомные газы. Вращение молекул
- •5 Уравнение состояния и статистический интеграл двухатомного газа
- •Распределение Ферми-Дирака и Бозе-Энштейна
- •1. Общие свойства ферми- и бозе-газов
- •2. Статистика Бозе
- •3. Статистика Ферми
- •5. Ферми- и Бозе-газы элементарных частиц
- •6 Вырожденный электронный газ
- •7 Черное излучение
- •8. Вырожденный Бозе-газ. Конденсация Бозе - Эйнштейна
- •Реальный газ. Групповое разложение в теории газов
- •Уравнение Ван-дер-Ваальса
- •ФЛУКТУАЦИИ
- •1. Флуктуации энергии
- •2 Флуктуации числа частиц в заданном объеме
- •3. Функции распределения и моменты распределения случайной непрерывной величины. Нормальное распределение
- •4. Флуктуации основных термодинамических величин
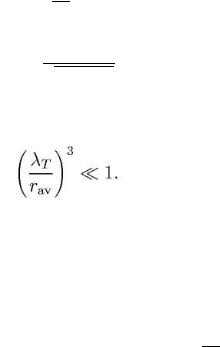
Статфизика |
18 |
Среднее расстояние между атомами в газе определяется величиной
V 1/3
r av= N
Величина
T = 2
2 mkT
называется тепловой длиной волны атомов.
Поэтому неравенство (5) можно переписать в виде:
т.о. распределение Больцмана применимо, если среднее расстояние между атомами в газе много больше их тепловой длины волны
3. Теорема о равномерном распределении кинетической энергии по степеням свободы и теорема о вириале
Нахождение внутренней эрергии E системы, задаваемой функцией Гамильтона
Н p , q =K p U q =∑ Pi2 U q1, q2, ... ,qN mi
по общему методу сводится к вычислению конфигурационного интеграла
QN =∫exp[−U N q1, q2, ... , qN /kT ]dq1, dq2, ... ,dqN
Эта задача весьма нетривиальная.
Однако во многих случаях E можно найти значитильно проще, используя две общие теоремы классической статистики.
Теорема о равномерном распределении кинетической энергии по степеням свободы гласит, что средняя кинетическая энергия, приходящаяся на одну степень свободы одинакова для всех степеней свободы и равна kT/2.
|
|
|
pi2 |
1 |
|
|
1 |
|
|
|
|
∂ H |
|
||||
|
|
|
|
|||||
|
K i= |
|
= |
2 |
Pi ∂ p |
= |
2 kT |
|
|
2m |
|||||||
|
|
|
|
|
|
i |
|
|
Согласно этой теоремы средняя кинетическая энергия системы |
||||||||
Е=1/2 NkT
Вторая теорема для понециальной энергии. Ее формулировка аналогична
W =∑W i = |
1 |
∑ qi |
∂ H = |
1 |
NkT |
i |
2 |
i |
∂ qi |
2 |
|
Величина W - называется вириалом системы, а.- Wi - называется вириалом системы, приходящимся на одну степень свободы.
Среднее значение вириала W i приходящееся на одну степень свободы
W i=12 kT
одно и то же для всех степеней свободы.
Согласно этой теоремы среднее значение системы, приходящееся на одну степень свободы
W = 12 NkT

Статфизика |
19 |
Последнее соотношение применимо для тех систем, для которых потенциальная энергия является однородной функцией координат.
4 Многоатомные газы. Вращение молекул
Рассмотрим молекулу состоящую из n атомов. 1) Линейная молекула
Если молекула состоит из двух атомов или она линейная, то молекула имеет симметрию вращения. У такой аксиально симметричной молекулы имеются две вращательных степени свободы. Кинетическая энергия вращения молекулы
где М- компоненты момента вращения, а I - момент инерции молекулы. Величины М играют роль обобщенных импульсов, а соответствующими обобщенными координатами являются углы поворота вокруг соответствующих осей. Поэтому элемент фазового пространства, соответствующий вращательным степеням свободы линейной молекулы,
dM dM d d d
d rot= |
2 2 |
|
Поскольку энергия не зависит от углов, то интегрирование по ним при вычислении статистического интеграла молекулы дает 4π − полный телесный угол .
2) Нелинейная молекула Если атомы многоатомной молекулы не расположены на одной прямой, то молекула
имеет три различных момента инерции и три вращательных степени свободы. В этом случае кинетическая энергия вращения молекулы есть
где ξ,η,ζ— координаты вращающейся с молекулой системы, оси которой направлены вдоль главных осей инерции молекулы. Элемент фазового объема, соответствующий вращательным степням свободы имеет вид
d rot= |
dM dM dM d d d |
|
2 3 |
||
|
Молекула из п атомов имеет 3n степеней свободы, если не учитывать внутриатомной структуры. Три из этих 3n степеней соответствуют поступательному движению молекулы как целого. Линейная молекула имеет две вращательных степени свободы, а нелинейная - три. Остальные Зn — 5 или Зn — 6 степеней свободы связаны с внутримолекулярными колебаниями атомов. Число колебательных степеней свободы
3n |
−5−линейная молекула |
N vib={3n |
−6−нелинейная молекула |
Атомы в молекуле совершают малые колебания вокруг положений равновесия, соответствующих минимуму потенциальной энергии. В классической механике энергия, соответствующая колебательным степеням свободы, может быть записана в форме

Статфизика |
20 |
Nvib |
|
vib =∑ ai pi2 bi qi2 |
|
i=1 |
|
где qi и pi - обобщенные координаты и импульсы, связанные с колебательными степенями свободы, ai, bi- постоянные коэффициенты, зависящие от природы внутримолекулярных сил взаимодействия между атомами, svib -,
Таким образом, энергия одной молекулы
где εtr - энергия поступательного движения молекулы, εrot - энергия вращения
молекулы как целого, εvib - энергия внутримолекулярных колебаний атомов.
Все три слагаемых представляют суммы членов, каждый из которых пропорционален квадрату одного из обобщенных импульсов pi или одной из обобщенных колебательных координат, т.е. квадрату одной из переменных pi или qi. Причем все члены входят аддитивното распределение вероятностей различных состояний молекулы оказывается произведением распределений для каждой из переменных:
dw=1z exp − kT d tr d vib d rot
Поскольку в выражение для колебательной энергии входят два слагаемых, то общее число таких переменных опредиться соотношением
N 0=N tr N rot 2Nvib
то есть
N ={3 2 2 3n−5 =6n−5−линейная молекула
0 3 3 2 3n−6 =6n−6−нелинейная молекула
Соответствующий статистический интеграл z является произведением N0 статистических интегралов для каждой из переменных. В результате статистическое распределение по каждой из упомянутых переменных пробретает вид распределения Максвелла.
Распределение по импульсам поступательного движения центра инерции молекулы такое же, как для одноатомной молекулы.
Распределение по моментам двухатомной молекулы определяется формулой
Среднее значение энергии, соответствующее поступательной степени свободы, равно кТ/2. То же самое справедливо, для каждой из N0 переменных, от которых зависит энергия молекулы. Т.е. среднее значение полной энергии молекулы
= 12 N 0 kT
причем на каждую переменную в энергии приходится по равной доле кТ/2. Это и есть
закон равнораспределения.

Статфизика |
21 |
Выше предполагалось, что как поступательное, так и вращательное и колебательное движения подчиняются классической механике. Поступательное движение молекулы как целого, действительно, с большой степенью точности подчиняется классической механике. Вращательное и колебательное движения, вообще говоря, должны описываться квантовой механикой. Рассмотрение показывает, что энергия вращательного кванта молекулы соответствует температуре порядка 10 К, а энергия колебательного кванта - температуре порядка 1000 К. Поэтому в широком интервале температур, включая обычные,
Первое неравенство означает, что вращение молекул носит квазиклассический характер и может быть приближенно описано классическим образом. Второе же неравенство означает, что при обычных температурах колебания атомов в молекулах практически не возбуждаются и их можно вообще не учитывать. Таким образом можно считать, что
Nvib=0
Ntr=3
Nrot=2, либо 3
N ={5−линейная молекула
0 6−нелинейная молекула
Отсюда следует, что средняя энергия газа, содержащего N линейных молекул,
E=52 NkT
Вслучае же газа из нелинейных молекул
E=3 NkT
Всоответствии с этим молярная теплоемкость газа при постоянном объеме равна
C ={5 R−линейная молекула
V 2
3R−нелинейная молекула
5 Уравнение состояния и статистический интеграл двухатомного газа
Вычислим статистический интеграл для молекулы, состоящей из двух различных атомов. Будем считать температуру умеренной и не будем учитывать колебаний атомов внутри молекул. Тогда статистический интеграл молекулы
z=ztr zrot
где |
|
|
|
|
|
|
|
|
|
|
|
|
|
ztr=∫exp − |
tr |
d tr |
, |
zrot=∫exp − |
rot |
d rot |
kT |
kT |
|||||
Ztr имеет тот же вид, что и в случае одноатомного газа:
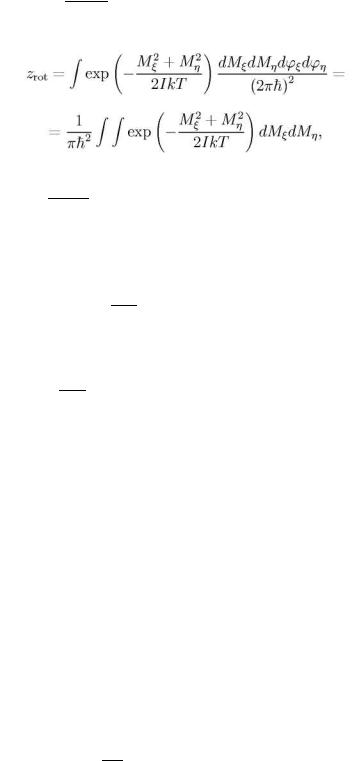
Статфизика |
22 |
ztr=V mkT2 3/2
2 Статистический интеграл для вращательного движения
откуда
z = 2 IkT
rot 2
В результате выражение для свободной энергии двухатомного газа записывается в виде
F =−NkT ln ezNtr ln zrot
Найдем уравнение состояния
p=− ∂∂VF T = NkTV
Таким образом уравнение состояния двухатомного газа имеет прежний вид
PV = NkT.
Причина этого в следующем: По сравнению со свободной энергией одноатомного газа это выражение содержит дополнительное слагаемое —NkTln zrot. В отличие от ztr, величина zrot не содержит объема V в качестве множителя. Формально это результат
того, что интегрирование по обобщенным координатам ϕη и ϕζ дает телесный угол 4π, в то время как интегрирование по координатам центра инерции молекулы х, у, z в ztr дает объем V.
Физическая причина состоит в том, что поступательное движение молекулы инфинитно и ей доступен весь объем газа. В противоположность этому, вращательное и колебательное движения молекулы ограничены ее размерами, вследствие чего колебательная и вращательная статсуммы не зависят от V.
Замечание
Для вычисления свободной энергии необходимо вычислять статистические суммы
Z =∑k exp − kTk
Вообще говоря уровни могут быть вырождены. Поэтому в статистическую сумму нужно ввести кратность вырождения уровня gk. Т.е. при суммировании нужно учитывать уровень с весом gk . Поэтому кратность вырождения уровня называют статистическим весом уровня. В этом случае статсумму нужно рассчитывать по следующей формуле

Статфизика |
23 |
Z =∑k gk exp −kTk
например в случае одноатомного газа полный момент определяется как сумма орбитального момента и спинового. Если справедлив рассель-саундерсовский тип связи в молекуле
J =L S
то gk=2J+1
где J квантовое число принимающее целочисленные значения
