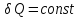Физика 50
.docx50) Термодинамический подход к описанию молекулярных явлений. Понятие термодинамического равновесия. Квазистатические процессы. Обратимые и необратимые процессы. Внутренняя энергия системы. Работа. Количество теплоты. Первое начало термодинамики и его применение к изопроцессам.
*Термодинамика – раздел физики, в котором изучают общие характеристики (свойства) макросостояний системы, находящейся в термодинамическом равновесии и процессы перехода.
-уравнения связи макропараметров.
-знание макропараметров и их изменений, находятся дедуктивным методом.
-нет моделей.
-простые варианты практических задач.
Термодинамическая система – совокупность макросостояний тел, любой физико-химической природы между которыми возможен теплообмен.
Окружающая среда – все тела, которые не входят в систему, но могут влиять на ее поведение.
Термодинамические параметры – совокупность физических величин, характеризующих свойства термодинамической системы.
*Термодинамическое равновесие – состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура, давление, объём, энтропия) в условиях изолированности от окружающей среды.
Состояние термодинамического равновесия называется устойчивым, если в этом состоянии не происходит изменения макроскопических параметров системы.
*Квазистатический процесс – процесс, состоящий из непрерывно следующих друг за другом состояний равновесия. Такие процессы называют также квазиравновесными, так как систему в каждый момент времени можно считать находящейся в состоянии термодинамического равновесия.
*Обратимые и необратимые процессы.
Обратимый процесс – термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, причем система возвращается в исходное состояние без затрат энергии.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы.
*Внутренняя энергия системы (U) – термодинамическая функция состояния системы, ее энергия, определяемая внутренним состоянием. Она складывается в основном из кинетической энергии движения частиц и энергии взаимодействия между ними.

*Работа (A) – форма обмена энергией между системой и окружающей средой (между параметрами системы).

*Теплота (Q) – форма обмена энергией, в основе которой прямое взаимодействие между молекулами системы и молекулами среды (не сопровождается изменением внешних параметров). Теплота – функция процесса.
*Первое начало термодинамики – один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.

Изопроцессы – термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными.
Изобарный процесс (Закон Гей-Люссака)
 =>{из
уравнения МКТ}
=>{из
уравнения МКТ}


Изохорный процесс (Закон Шарля)
 =>
=>
 =>
=>



Изотермический процесс (Закон Бойля-Мариотта)
 =>
=>
 =>
=>



Адиабатический процесс