
- •Введение
- •Раздел первый
- •1.2. Определение химии
- •1.3. Атомно-молекулярное учение
- •1.4. Основные стехиометрические законы химии
- •1.5. Значение химии в развитии техники
- •Глава 2. Строение атомов. Периодический закон и периодическая система химических элементов д.И. Менделеева
- •2.1. Первые модели строения атома
- •2.2. Квантово-механическая модель атома водорода
- •2.3. Квантовые числа
- •2.4. Атомные орбитали
- •2.5. Многоэлектронные атомы
- •2.6. Распределение электронов по энергетическим уровням и подуровням у элементов малых периодов
- •2.7. Распределение электронов по энергетическим уровням и подуровням у элементов больших периодов
- •2.8. Периодический закон д. И. Менделеева
- •2.9. Структура периодической системы химических элементов д. И. Менделеева
- •2.10. Свойства атомов элементов в периодической системе
- •2.11. Закономерности изменения свойств элементов и их соединений в периодической системе
- •Глава 3. Химическая связь и строение молекул
- •3.1. Развитие теории химической связи
- •3.2. Ковалентная связь. Кривая потенциальной энергии
- •3.3. Основные количественные характеристики ковалентной связи
- •3.4. Квантово – механическая теория валентности
- •3.5. Донорно – акцепторный механизм образования ковалентной связи
- •3.6. Свойства ковалентной связи
- •3.7. Метод молекулярных орбиталей
- •3.8. Ионная связь
- •3.9. Водородная связь
- •3.10. Межмолекулярное взаимодействие
- •Глава 4. Кристаллическое состояние вещества
- •4.1. Макроскопические свойства кристаллов
- •4.2. Внутреннее строение кристаллов
- •4.3. Виды элементарных ячеек
- •4.4. Металлическая связь
- •4.5. Реальные кристаллы и нарушения кристаллической структуры
- •Раздел второй
- •5.2. Первый закон термодинамики
- •5.3. Энтальпия образования химических соединений
- •5.4. Энтропия. Второй закон термодинамики
- •5.5. Третий закон термодинамики
- •5.6. Энергия Гиббса. Направленность химических реакций
- •164,9 КДж; 172,41 Дж/моль∙к;
- •Глава 6. Скорость химических реакций. Химическое равновесие
- •6.1. Влияние внешних факторов на скорость химических реакций
- •6.2. Химическое равновесие
- •6.3. Цепные реакции
- •6.4. Фазовые равновесия
- •6.5. Катализаторы и каталитические системы
- •Раздел третий растворы
- •Глава 7. Общие свойства растворов
- •7.1. Механизм процессов растворения
- •7.2. Способы выражения количественного состава растворов
- •100 ∙ 10,91 Моль % h2so4
- •7.3. Энергетика растворения
- •7.4. Свойства растворов неэлектролитов
- •7.5. Свойства растворов электролитов
- •7.6. Электролитическая диссоциация воды. Водородный показатель
- •7.7. Произведение растворимости. Гидролиз солей
- •Глава 8. Окислительно-восстановительные реакции
- •8.1.Общие понятия об окислительно- восстановительных реакциях
- •8.2. Классификация окислителей и восстановителей
- •8.3. Количественная характеристика окислительно-восстановительных реакций
- •8.4. Методы составления уравнения окислительно-восстановительных реакций
- •8.5. Влияние факторов на характер и направление реакций
- •8.6. Типы окислительно-восстановительных реакций
- •Глава 9. Электрохимические процессы
- •9.1. Строение двойного электрического слоя
- •9.2. Гальванические элементы
- •9.3. Стандартный водородный электрод
- •9.4. Поляризационные явления в гальванических элементах
- •9.5. Химические источники тока
- •9.6. Аккумуляторы
- •9.7. Топливные элементы
- •9.8. Теоретические основы электролиза
- •9.9. Последовательность электродных процессов
- •9.10. Техническое применение электролиза
- •Глава 10. Коррозия и защита металлов
- •10.1. Общие сведения о коррозии
- •10.2. Классификация коррозионных процессов
- •10.3. Количественная и качественная оценка коррозии и коррозионной стойкости
- •10.4. Химическая коррозия
- •10.5. Электрохимическая коррозия
- •10.6. Методы защиты от электрохимической коррозии
- •Раздел четвертый
- •11.2. Электропроводность металлов, полупроводников и диэлектриков
- •11.3. Химические свойства металлов высокой проводимости
- •11.4. Электропроводимость металлов подгруппы меди
- •11.5. Химические свойства магнитных материалов
- •11.6. Магнитные свойства металлов семейства железа
- •Глава 12. Химическая идентификация и анализ вещества
- •12.1. Химическая идентификация вещества
- •12.2. Количественный анализ
- •12.3. Инструментальные методы анализа
- •Заключение
- •Библиографический список
- •Глава 1. Основные понятия химии. Предмет и задачи
- •Глава 2. Строение атомов. Периодический закон и
- •Глава 3. Химическая связь и строение молекул………..54
- •Глава 4. Кристаллическое состояние вещества………..103
- •Глава 12. Химическая идентификация и анализ
9.2. Гальванические элементы
Гальваническими элементами называются устройства, в которых химическая энергия окислительно-восстановительной реакции превращается в электрическую. Гальванический элемент состоит из 2-х металлических электродов, помещённых в раствор электролитов, т.е. из 2-х полуэлементов.
Рассмотрим работу
гальванического элемента, составленного
из 2-х полуэлементов Zn2+/ZnиCu2+ / Cu, т.е. медная
пластина погружена в растворCuSO4,
и цинковая пластина – вZnSO4.
(рис.61). Для предотвращения прямого
воздействия и взаимодействия окислителя
и восстановителя электроды отделены
друг от друга пористой перегородкой.
На поверхности цинковой пластины
возникает двойной электрический слой
и устанавливается равновесиеZn
![]() Zn2+
+ 2ē. В результате протекания
этого процесса возникает электродный
потенциал цинка. На поверхности медной
пластины также возникает двойной
электрический слой и устанавливается
равновесиеCu
Zn2+
+ 2ē. В результате протекания
этого процесса возникает электродный
потенциал цинка. На поверхности медной
пластины также возникает двойной
электрический слой и устанавливается
равновесиеCu![]() Cu2+ + 2 ē.В результате
возникает электродный потенциал меди.
Потенциал цинкового электрода
отрицательнее потенциала медного
электрода (E
Cu2+ + 2 ē.В результате
возникает электродный потенциал меди.
Потенциал цинкового электрода
отрицательнее потенциала медного
электрода (E![]() /
/![]() =-0,76В
< Е
=-0,76В
< Е![]() /
/![]() =+0,34В).
=+0,34В).
При замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником, вследствие разности потенциалов часть электронов с цинковой пластинки перейдёт на медную.
Это нарушит равновесие в двойном электрическом слое у цинка. Обе системы стремятся снова к равновесию за счёт окисления цинка и восстановления катионов меди на медном электроде. Этими процессами сохраняется разность потенциалов пластинок, обеспечивающая постоянный переход электро-
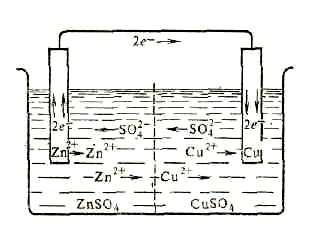
Рис. 61. Схема гальванического элемента Якоби – Даниэля.
нов по проволоке
от цинка к меди – электрический ток в
цепи. Во внутреннем участке цепи анионы
SО![]() перемещаются от медного электрода к
цинковому, а катионы цинкаZn2+и медиСu2+ - в обратном
направлении. Суммарный процесс выражается
тем же уравнением реакцииZn + CuSO4
= ZnSO4 + Cu, что и при
непосредственном взаимодействии
окислительно - восстановительных системZn2+/ZnиCu2+
/Cu0.
перемещаются от медного электрода к
цинковому, а катионы цинкаZn2+и медиСu2+ - в обратном
направлении. Суммарный процесс выражается
тем же уравнением реакцииZn + CuSO4
= ZnSO4 + Cu, что и при
непосредственном взаимодействии
окислительно - восстановительных системZn2+/ZnиCu2+
/Cu0.
Электрический ток в гальваническом элементе возникает за счёт окислительно - восстановительной реакции, протекающей так, что окислительные и восстановительные процессы оказываются пространственно разделёнными: на положительном электроде происходит процесс восстановления, на отрицательном - процесс окисления. Электрод, на котором происходит процесс восстановления, называется катодом(Cu), окисления -анодом(Zn).
Необходимое условие работыгальванического элемента -разность потенциаловэлектродов, которая называется электродвижущей силой гальванического элемента –ЭДСилиε.
ЭДС элемента считается положительной, если токообразующая реакция в данном направлении протекает самопроизвольно. Положительной ЭДС отвечает и определённая услов-
ность в значении схемы элемента. Она заключается в том, что записанный слева электрод должен быть отрицательным. Например, элемент Даниэля - Якоби схематически изображается так:
(-) Zn |ZnSO4| |CuSO4| Cu (+)
Двойная черта
указывает на то, что диффузионный
потенциал между растворами ZnSO4иCuSO4устранён. Это
достигается применением промежуточного
насыщенного раствораKClилиKNO3с одинаковой подвижностью катионов и
анионов.ЭДС элемента определяется
разностью электродных потенциалов меди
и цинка, т.е.ЭДС = Е![]() /
/![]() - E
- E![]() /
/![]()
ЭДС = Е Cu – Zn = 0,34 - (- 0,76) = 1,1 (В), если концентрация ионов цинка и меди равна1 г – ион / л.
Если на электродах испытывает превращение один г– экв. вещества, то по закону Фарадея через систему протекает один фарадей электричества, при превращении одного моля вещества -nфарадеев электричества, равное числу грамм - эквивалентов в одном моле вещества. Таким образом, максимальная электрическая работа гальванического элемента при превращении одного моля веществаAэрравна
Aэр = nFE,
где Е-Э.Д.С.гальванического элемента.
С другой стороны, максимальная полезная работа Амр, которую может совершить система при протекании реакции(p = const), равна энергии Гиббса реакции:
Aмp = - Δ G
Так как Aэp = Aэр, то получим
Е = - Δ G / nF
Для реакции, протекающей в элементе Даниэля – Якоби
Zn + CuSO4 = ZnSO4 + Cu
Изменение свободной энергии в стандартных условиях равно -51,85 ккал (-216946 Дж); подставляя эту величину получим:
Е = -
![]() 1,1
В.
1,1
В.
Эта величина совпадает с ЭДС, вычисленной по разности стандартных потенциала меди и цинка.
Таким образом, главный критерий возможности самопроизвольного течения реакции в данном направлении - положительное значение вычисленной ЭДСсоответствующего элемента.
Прямым измерением разности потенциалов на клеммах гальванического элемента при помощи обычного вольтметра можно получить значение напряжения U, которое не равноЭДС элемента: U < ЭДС, что обусловлено падением напряжения внутри элемента и другими эффектами. Поэтому измерениеЭДСобычно проводят компенсационным методом, при котором сила тока, протекающего через элемент, близка к нулю. Для этого к элементу подводятЭДСс противоположным знаком от внешнего источника тока, значение которой можно регулировать тем или иным способом. В измерительную цепь включают также гальванометр для регистрации тока и вольтметр для измерения напряжения. В момент, когда выходное напряжение внешнего источника тока равноЭДСгальванического элемента (момент компенсацииЭДС), сила тока в цепи равна нулю (стрелка гальванометра не отклоняется). Измеренное в этот момент напряжение на клеммах гальванического элемента равно егоЭДС. Менее точный метод измеренияЭДС может быть использован с помощью высокоомного вольтметра, при измерении которым мала сила тока, протекающего через элемент, поэтому невелика разница междуЭДСи напряжением элемента.
