
Энзимология
.pdf11
2.Строение и функции биологических , мембраних роль в компартментализации разнонаправленных биохимических процессов в тканях.
3.Понятие о катализе химических реакций.
Приобретаемые компетенции (знания, умения и навыки)
1.Понятие о ферментах как биокатализаторах.
2.Термины, используемые в энзимологии: фермент, субстрат, активный центр, апофермент, голофермент, кофактор, ингибитор.
Рекомендуемая литература
1.Варфоломеев, С. Д. Химическая энзимология: Учеб. / С. Д. Варфоломеев. -
М.: Академия, 2005. – 480 c.
2.Иммуно- и нанобиотехнология : учеб. пособие / Э. Г. Деева [и др.]. - СПб. :
Проспект Науки, 2008. - 215 с.
Вопросы для самоконтроля
1.Предмет и задачи энзимологии.
2.Определение понятия «фермент».
3.Что такое «субстрат» ферментативной реакции?
4.Определение понятия «активный центр».
5. |
Основное содержание и вклад в развитие энзимологии .работ |
|
Кирхгофа, Ю. Либиха, Л. Пастера, М. Бертло, Э. Бухнера, М. Траубе, Э. |
|
Фишера, Л. Анри, Л. Михаэлиса, Д. Самнера. |
6. |
Основные направления и задачи современной энзимологии. |
Тема 2. Особенности ферментов как катализаторов
Сущность явления катализа. Особенности ферментов как катализаторов:
высокая эффективность катализа, специфичность действия, возможность регуляции активности ферментов. Понятие об активности фермента, методы ее
|
12 |
|
|
|
определения. Стандартная |
единица |
фермента. Удельная |
активность |
и |
молекулярная активность фермента. |
|
|
|
|
Необходимый исходный уровень знаний
1.Понятие о катализаторах.
2.Механизм действия катализаторов.
3.Понятие о скорости химической реакции, методах ее определения.
Приобретаемые компетенции (знания, умения и навыки) |
|
||||||
1. |
Отличительные особенности ферментов как биокатализаторов: высокая |
||||||
|
эффективность |
действия, |
специфичность |
действия, возможность |
|||
|
регуляции активности. |
|
|
|
|
||
2. |
Понятие |
об |
активности |
фермента |
как |
начальной |
|
|
ферментативной |
реакции |
в |
оптимальных |
для |
фермента условия. |
|
|
Методы определения активности ферментов.. |
|
|
||||
3. |
Определение активности фермента спектрофотометрическим методом. |
||||||
Рекомендуемая литература
1.Варфоломеев, С. Д. Химическая энзимология: Учеб. / С. Д. Варфоломеев. -
М.: Академия, 2005. – 480 c.
2.Варфоломеев, С. Д. Биокинетика: Практический курс / С. Д. Варфоломеев,
К. Г. Гуревич. – М. : ФАИР-ПРЕСС, 1999. – 720 с.
3.Биохимия: Учеб. для вузов / Под ред. Е. С. Северина. – 4-е изд., испр. - М.:
Издательский дом ГЭОТАР-МЕД, 2005. – 784 c.
4.Полыгалина, Г. В. Определение активности ферментов: Справ. /Г. В.
Полыгалина, В. С. Чередниченко, Л. В. Римарева. - М.: ДеЛи принт, 2003. – 376 c.
Вопросы для самоконтроля
1. За счет чего ферменты ускоряют химические реакции?
13
2.Что такое «энергия активации» реакции.?
3.Активность фермента. Методы определения активности фермента.
4.Что такое «стандартная единица фермента». Единицы измерения.
5.Удельная активность и молекулярная активность фермента.
6. |
С чем может быть связано замедление ферментативной реакции |
|
времени? |
7. |
Определение активности фермента спектрофотометрическим методом. |
Ситуационные задания
1. Объяснить, почему для расчета активности фермента необходи определить начальную скорость ферментативной реакции.
2.Объяснить принцип выбора длины волны, при которой необходимо фиксировать изменение оптической плотности раствора для определения активности фермента спектрофотометрическим методом.
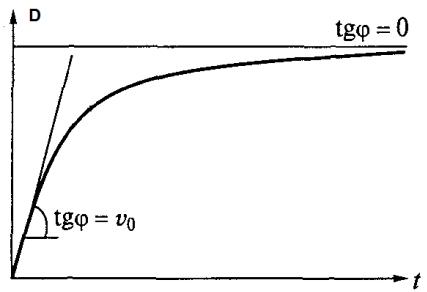
3.Какова активность фермента, выраженная в стандартных единицах, если тангенс угла наклона прямой к начальному участку кривой изменения оптической плотности раствора в ходе реакции равен0,5, а коэффициент поглощения продукта – 6500 М-1см-1 (рис. 1)?
Рис. 1. Определение начальной скорости ферментативной реакции [2].
|
14 |
|
|
Тема 3. Классификация ферментов |
|
|
|
Принцип |
классификации |
ферментов. Номенклатура |
ферментов. |
Характеристика классов и важнейших групп ферментов.
Необходимый исходный уровень знаний
1. Химические реакции гидролиза, окисления-восстановления,
изомеризации, переноса групп, образования химических связей. 2. Понятие о субстрате ферментативной реакции
Приобретаемые компетенции (знания, умения и навыки)
1.Принцип классификации ферментов.
2.Номенклатура ферментов.
Рекомендуемая литература
1.Биохимия: Учеб. для вузов / Под ред. Е. С. Северина. – 4-е изд., испр. - М.:
Издательский дом ГЭОТАР-МЕД, 2005. – 784 c.
2.Варфоломеев, С. Д. Химическая энзимология: Учеб. / С. Д. Варфоломеев. -
М.: Академия, 2005. – 480 c.
Вопросы для самоконтроля
1.Принцип классификации ферментов.
2.Характеристика классов ферментов: оксидоредуктаз, трансфераз,
гидролаз, лиаз, изомераз, лигаз.
3.Номенклатура ферментов.
Ситуационные задания
1. В базе данных ферментовBRENDA (The Comprehensive Enzyme Information System) (адрес доступа: http://www.brenda-enzyme.org) в окно поиска ввести номенклатурные номера ферментов, выписать названия ферментов, имеющих данные номера:
15
1.1.1.1
1.11.1.6
2.3.2.1
2.7.1.1
3.4.4.1
3.4.4.5
6.3.2.1
Раздел 2. ХИМИЧЕСКАЯ |
ПРИРОДА |
ФЕРМЕНТОВ, ИХ |
ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
Тема 4. Химическая природа ферментов, их функциональные группы
Ферменты – простые и сложные белки. Уровни структурной организации |
|
||||||
белков. Проблема сворачивания полипептидной цепи в нативную конформацию. |
|
||||||
Взаимодействия, стабилизирующие пространственную структуру белка. Роль |
|
||||||
доменов |
в |
пространственной |
организации |
|
и |
функционировании |
молек |
ферментов; |
их |
функциональные |
характеристики(кофермент-связывающие, |
|
|||
регуляторные, |
обеспечивающие |
связь |
с |
|
мембранами). Современные |
|
|
представления о структуре активного центра фермента. Методы идентификации функциональных групп активного центра. Коферменты, простетические группы.
Рибозимы. Базы данных информации о ферментах.
Необходимый исходный уровень знаний
1.Состав и структура белков.
2.Состав, структура и биологическая роль РНК.
Приобретаемые компетенции (знания, умения и навыки)
1. Знания об уровнях организации белков.
2. Понятие о нативном состоянии, взаимодействияхбелка,
стабилизирующих данное состояние.
16
3.Понятие о роли конформационных изменений и подвижности структуры фермента в реализации его активности.
4.Современные представления о структуре активного центра фермента.
5.Рибозимы, механизм их действия.
6.Навыки поиска сведений о ферментах в базах данных биологической информации.
Рекомендуемая литература
1.Биохимия: Учеб. для вузов / Под ред. Е. С. Северина. – 4-е изд., испр. - М.:
Издательский дом ГЭОТАР-МЕД, 2005. – 784 c.
2.Варфоломеев, С. Д. Химическая энзимология: Учеб. / С. Д. Варфоломеев. -
М.: Академия, 2005. – 480 c.
3.Степанов, В. М. Молекулярная биология. Структура и функции белков:
учебник / В. М. Степанов; под ред. А. С. Спирина. – М. Изд-во МГУ :
Наука, 2005. – 336 с.
4.Нолтинг, Б. Новейшие методы исследования биосистем / Б. Нолтинг; пер. с
анг. Н. Н. Хромова-Борисова. - М. : Техносфера, 2005. - 256 с. - (Мир биологии и медицины)
Вопросы для самоконтроля
1. |
Первичная структура белка. |
|
|
|
2. |
Вторичная |
структура |
белка; взаимодействия, |
стабилизирующие |
|
структуру. |
|
|
|
3. |
Третичная |
структура |
белка; взаимодействия, |
стабилизирующие |
|
структуру. |
|
|
|
4.Понятие об олигомерных белках.
5.Формирование нативной структуры фермента.
6.Домены, их функциональные характеристики.
7.Структура активного центра фермента, функциональные участки.
8.Коферменты, простетические группы.
17
9. Рибозимы.
Ситуационные задания
1.Освоить работу с программамиRasMol 2.6 (адрес доступа: http://www.umass.edu:80/microbio/rasmol/index2.htm), Cn3D 4.1 (адрес доступа: http://www.ncbi.nlm.nih.gov/Structure/CN3D/cn3d.shtml),
позволяющими визуализовать структуру биомолекул.
2.В базе данныхNCBI Structure (Molecular Modelling Database) – Адрес доступа: http://www.ncbi.nlm.nih.gov/Structure/index.shtml - вводя в окно
поиска название фермента на английском , языкенайти структуры
ферментов, номенклатурные номера которых приведены в теме3 (если информация о структуре данных ферментов в базе данных содержится).
Данное задание можно выполнить для любого произвольно выбранного
Вами |
фермента. Описать |
структуру |
выбранного |
фермента. Какая |
вторичная структура преобладает? |
|
|
||
Раздел 3. МЕТОДЫ ВЫДЕЛЕНИЯ И ОЧИСТКИ ФЕРМЕНТОВ
Тема 5. Методы выделения и очистки ферментов
Правила работы с ферментами. Условия, обеспечивающие сохранение
структуры и активности ферментов при выделении. Методы фракционирования
белков |
(высаливание, |
гель-фильтрация, |
ионообменная |
и |
аффинная |
хроматографии). Критерии |
чистоты ферментных препаратов(электрофорез, |
||||
ультрацентрифугирование). |
|
|
|
|
|
Необходимый исходный уровень знаний |
|
|
|
||
1.Структура аминокислот.
2.Структура и функциональные группы ферментов.
3.Локализация ферментов в клетке.
4.Методы определения концентрации белков.
5.Методы определения активности ферментов.
18
Приобретаемые компетенции (знания, умения и навыки)
1.Правила работы с ферментными препаратами.
2.Представление о методах выделения и очистки ферментов.
3.Знание методов оценки чистоты ферментных препаратов.
Рекомендуемая литература
1.Остерман, Л. А. Методы исследования белков и нуклеиновых кислот:
Пособие для студентов / Л. А. Остерман. - М.: МЦНМО, 2002. – 248 c.
2.Скоупс, Р. Методы очистки белков / Р. Скоупс. – М.: Мир, 1985. – 358 с.
3.Варфоломеев, С. Д. Химическая энзимология: Учеб. / С. Д. Варфоломеев. -
М.: Академия, 2005. – 480 c.
4.Степанов, В. М. Молекулярная биология. Структура и функции белков:
учебник / В. М. Степанов; под ред. А. С. Спирина. – М. Изд-во МГУ :
Наука, 2005. – 336 с.
5.Нолтинг, Б. Новейшие методы исследования биосистем / Б. Нолтинг; пер.
с анг. Н. Н. Хромова-Борисова. - М. : Техносфера, 2005. - 256 с. - (Мир биологии и медицины)
Вопросы для самоконтроля
1. Условия, обеспечивающие |
сохранение |
структуры |
и |
активност |
ферментов при выделении.
2.Правила работы с ферментными препаратами.
3.Методы разрушения клеточных стенок и мембран.
4.Гель-фильтрация, принцип метода и применение.
5.Ионообменная хроматография, принцип метода и применение.
6.Аффинная хроматография, принцип метода и применение.
7.Методы оценки чистоты ферментного препарата.
8.Ультрацентрифугирование, принцип метода и применение.
9.Гель-электрофорез в ПААГ в присутствия додецилсульфата натрия,
принцип метода и применение.
|
|
|
|
19 |
|
|
|
|
|
|
Ситуационные задания |
|
|
|
|
|
|
|
|
1. |
Предложить технологию выделения и очистки фермента, имеющего при |
||||||||
|
нейтральных |
значениях |
рН |
|
суммарный |
отрицательный |
заряд |
||
|
поверхности, одним из субстратов которого является АТФ. |
|
|
||||||
2. |
Как на основе электрофореграммы анализа препарата фермента методом |
||||||||
|
гель-электрофореза |
в |
ПААГ |
в |
денатурирующих |
условиях |
оцен |
||
молекулярную массу фермента и его субъединичный состав?
Раздел 4. КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
Тема 6. Кинетика ферментативных реакций. Зависимости начальной скорости ферментативной реакции от концентрации субстрата фермента
Кинетический |
эксперимент. |
Зависимость |
начальной |
скорости |
||||||
ферментативной реакции от концентрации субстрата. Модель Михаэлиса-Ментен. |
|
|||||||||
Фермент-субстратный |
комплекс. Константа Михаэлиса Km |
и |
максимальная |
|
||||||
скорость |
реакции Vmax, физический |
смысл |
и |
методы |
определения |
|
||||
экспериментальных данных (метод Лайнуивера-Берка, |
Хейнса-Вульфа, Иди- |
|
||||||||
Хофсти, Эйзенталя и Корниш-Боуден). Константа связывания |
субстрата– КS. |
|
||||||||
Число оборотов фермента. |
|
|
|
|
|
|
|
|
||
Зависимости начальной скорости ферментативной реакции от концентрации |
|
|||||||||
субстрата, не подчиняющиеся уравнению Михаэлиса. Ингибирование и активация |
|
|||||||||
избытком субстрата. |
Аллостерические |
эффекты. |
Многосубстратные |
реакции. |
|
|||||
Определение |
механизма |
реакции |
и |
кинетических |
параметр |
|||||
экспериментальных данных. |
|
|
|
|
|
|
|
|
||
Олигомерные |
ферменты. Роль |
мономер-димерных |
взаимодействий |
в |
||||||
регуляции |
активности |
ферментов. Зависимость |
скорости |
|
реакции |
от |
||||
концентрации фермента.
Необходимый исходный уровень знаний
1. Понятие о кинетике химических реакций.
20
2.Уравнение скорости химической реакции.
3.Обратимые химические реакции.
4.Понятие о химическом равновесии.
Приобретаемые компетенции (знания, умения и навыки)
1.Умение измерить, описать и объяснить зависимость начальной скорости ферментативной реакции от концентрации субстрата.
2.Навыки определения константы Михаэлиса Km и максимальной скорости реакции Vmax из экспериментальных данных.
3. Умение |
определить |
механизм |
и |
кинетические |
п |
многосубстратной реакции из экспериментальных данных.
4.Умение измерить, описать и объяснить зависимость начальной скорости ферментативной реакции от концентрации фермента.
Рекомендуемая литература
1.Березин, И. В. Практический курс химической и ферментативной кинетики /
И. В. Березин, А. А. Клесов. – М.: Изд-во МГУ, 1976. – 321 с.
2.Варфоломеев, С. Д. Химическая энзимология: Учеб. / С. Д. Варфоломеев. -
М.: Академия, 2005. – 480 c.
3.Варфоломеев, С. Д. Биокинетика: Практический курс / С. Д. Варфоломеев,
К. Г. Гуревич. – М. : ФАИР-ПРЕСС, 1999. – 720 с.
4.Корниш-Боуден, Э. Основы ферментативной кинетики / Э. Корниш-Боуден.
– М.: Мир, 1979. – 280 с.
5.Курганов, Б. И. Аллостерические ферменты / Б. И. Курганов. – М.: Наука, 1978.
Вопросы для самоконтроля
1. Модель |
Михаэлиса-Ментен. Какие |
экспериментальные |
данные |
она |
объясняет?
