
Лекция 07.Алканы.Циклоалканы 19.08.09
.doc|
Лекция 7 |
Алканы. Циклоалканы
Алканы
Углеводороды общей формулы – CnH2n+2. Гомологический ряд алканов.
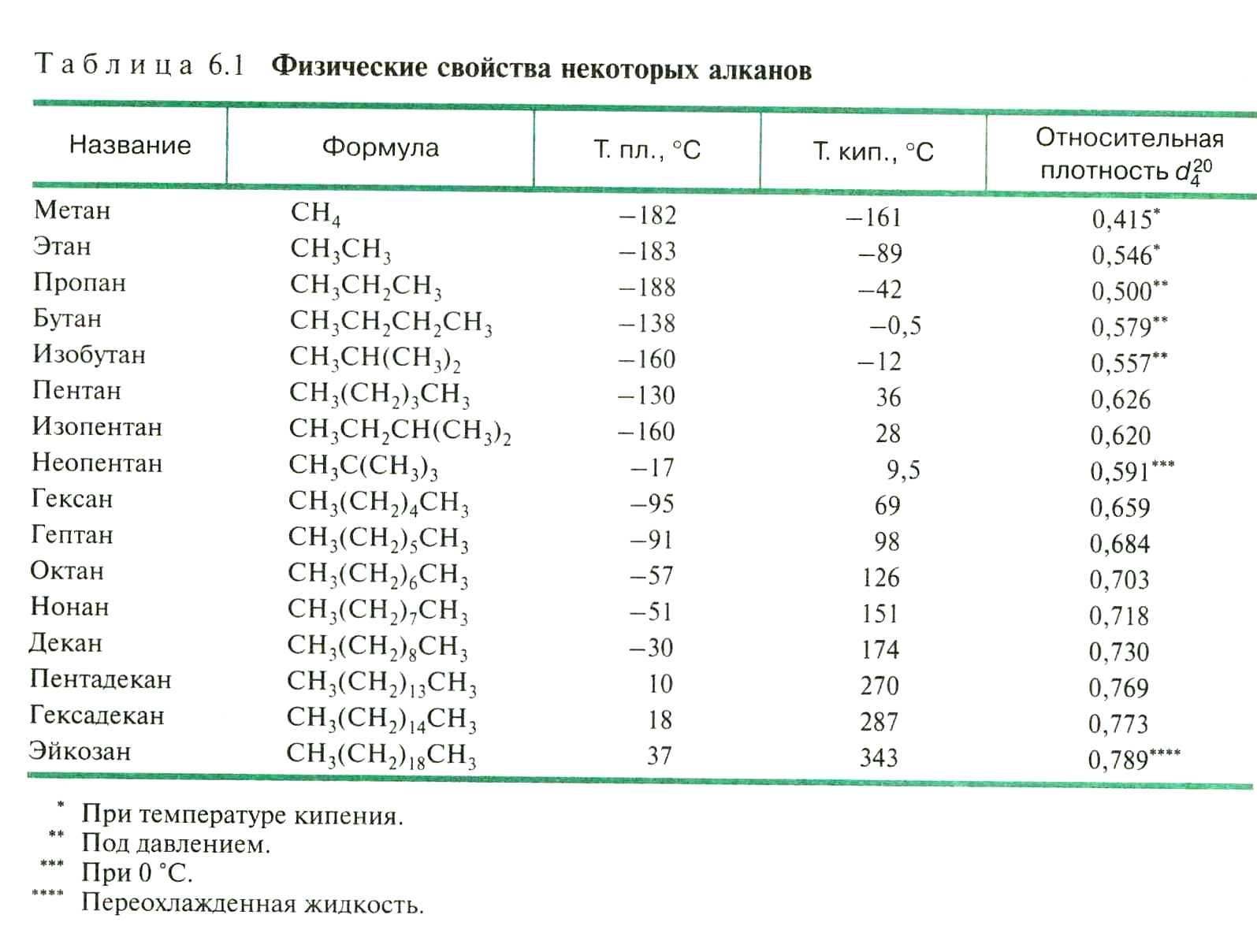
Физические свойства алканов – см. учебник.
Способы получения алканов
Источники промышленного получения алканов – природный газ, нефть.
Синтетические способы (применяются, в основном, в лабораторных условиях для получения сложных алканов):
1. Гидрирование алкенов и алкинов
![]()
2. Восстановление галогеналканов

3. Реакция Дюма
![]()
4. Реакция Вюрца
![]()
5. Реакция Кольбе
![]()
\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\ (вставка)
Химическая реакция – это, как правило, многостадийный процесс. Она начинается с разрыва связей в исходных соединениях, после чего образуются новые связи и новые соединения. В ходе реакции образуются неустойчивые промежуточные частицы. Последовательность всех стадий называется механизмом реакции.
Активные частицы – это частицы, обладающие высокой химической активностью, они инициируют реакцию.
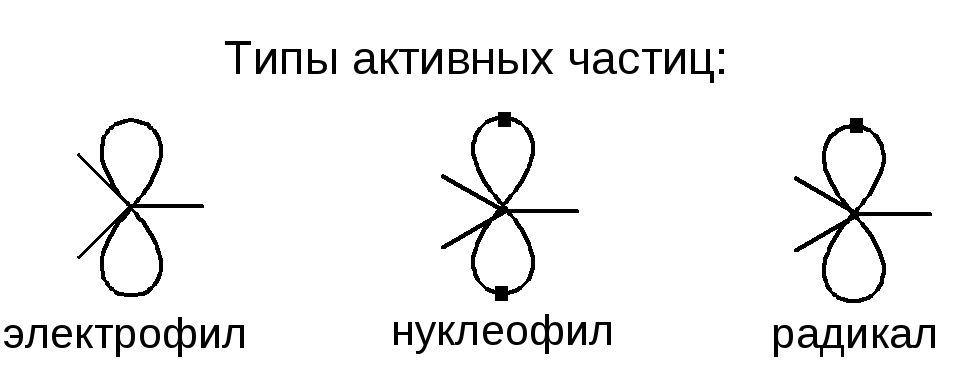
Электрофил – электронодефицитная частица, атакует в места повышенной электронной плотности.
Нуклеофил – электроноизбыточная частица, атакует в места пониженной электронной плотности.
Радикал – электронейтральная частица, атакует неполярные и малополярные связи.
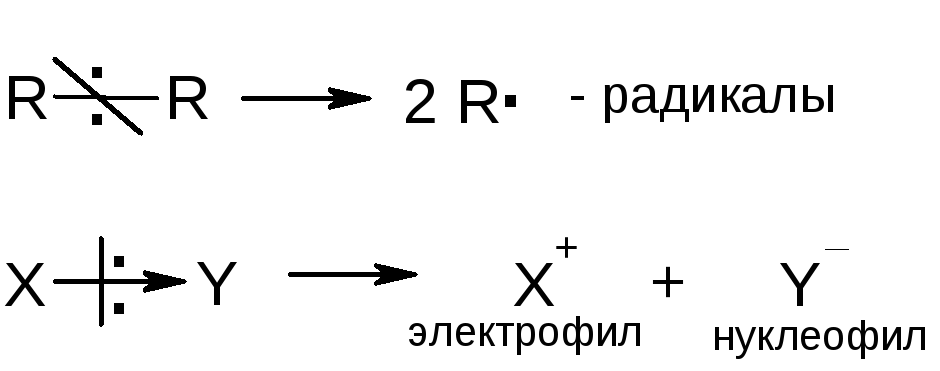
Активные частицы могут образоваться в результате разрыва химической связи. Малополярные связи разрываются гомолитически, и образуются два радикала; полярные связи разрываются гетеролитически, и образуются нуклеофил и электрофил:
\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\\
Химические свойства алканов
Алканы – наиболее инертные в химическом отношении вещества.
Связи С-С и С-Н малополярны и устойчивы к атаке электрофилов и нуклеофилов, они разрываются под действием радикалов.
1. Реакции радикального замещения (SR).
а) галогенирование:
![]()
механизм реакции – цепной радикальный:
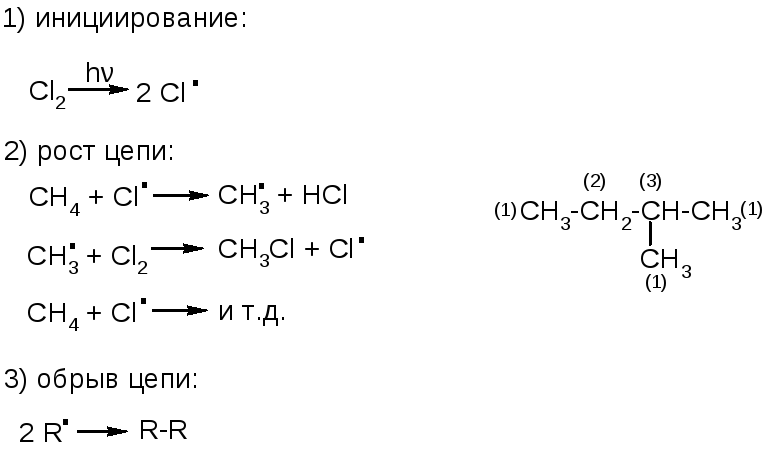
Скорость реакции у первичного, вторичного и третичного углеродов различна: она увеличивается в ряду: С(1) < С(2) < С(3) (см. предыдущую схему).
Причем в этом отношении хлорирование мало избирательно, бромирование гораздо более избирательно из-за меньшей активности радикала Br.
б) нитрование:
в паровой фазе при 400-500о;
жидкофазное – при 110-140о (Коновалов)

2. Окисление:
Алканы – одни из самых трудно окисляемых веществ. При комнатной температуре на них не действуют даже сильные окислители.
При горении алканы превращаются в СО2 и Н2О.
Регулируемое окисление кислородом при 200о и 90 атм. протекает в жидкой фазе с расщеплением С-С-связей и образованием смеси карбоновых кислот.
Например, промышленный способ получения уксусной кислоты:
![]()
3. Термическое расщепление и крекинг:
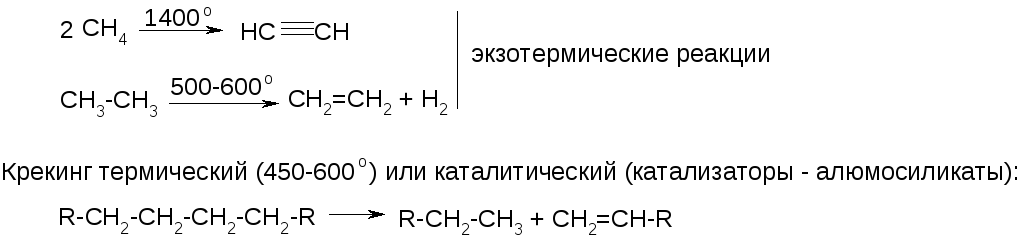
Крекинг очень широко применяется в переработке нефти для получения высокооктанового топлива.
Отдельные представители алканов – см. учебник.
Циклоалканы
Циклоалканы – предельные углеводороды с замкнутой цепью.
Общая формула – СnH2n (моноциклические незамещенные).
Циклоалканы различаются по:
- величине цикла,
- количеству циклов,
- способу соединения циклов.
Моноциклические: циклопропан, циклобутан, циклопентан, циклогексан
(формулы с пояснением).
Полициклические:
а) Конденсированные (аннелированные):
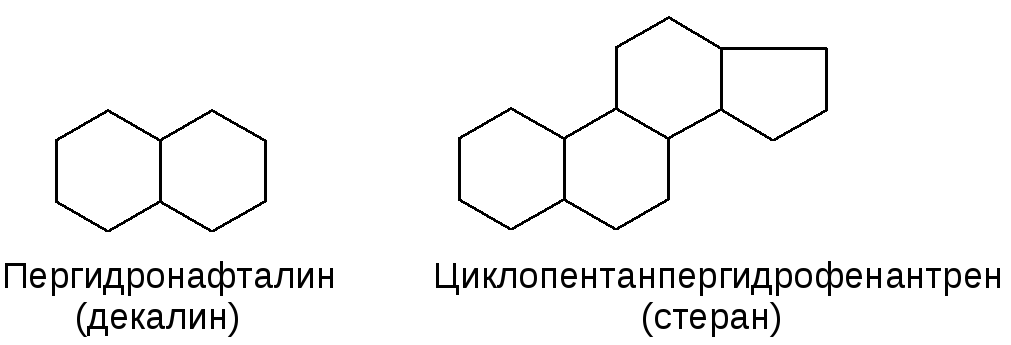
б) Мостиковые:

в) Спироуглеводороды:

Теория напряжений (Байер)
Отклонение геометрического угла от валентного угла 109о создает напряжение в цикле:
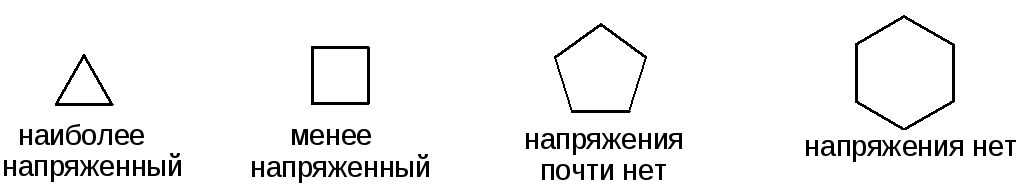
Циклопропан

"Банановые" связи промежуточные по своему характеру между π- и σ-связями: ненасыщенность циклопропана – реакции присоединения с разрывом цикла.
Способы получения циклоалканов
1. Дегидрирование дигалогеналканов (вариант реакции Вюрца):
![]()
2. Циклоприсоединение:
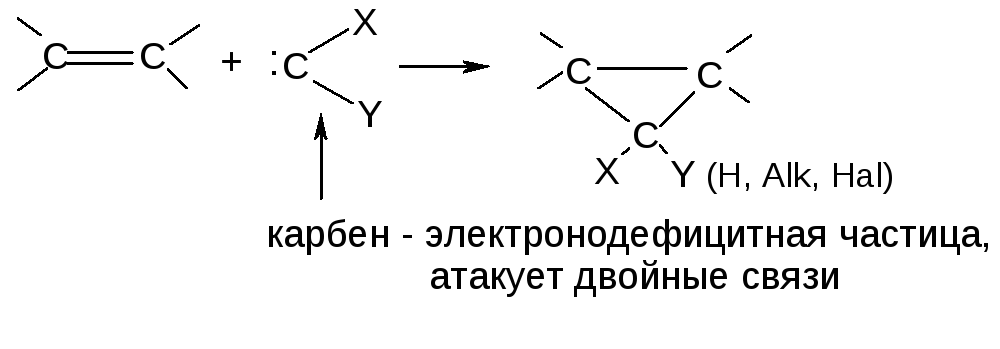
3. Диеновый синтез (реакция Дильса-Альдера):
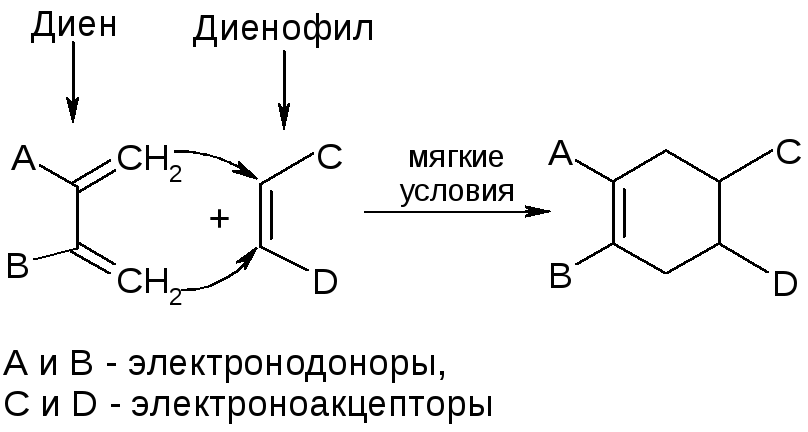
Химические свойства циклоалканов
1. Реакции малых циклов:
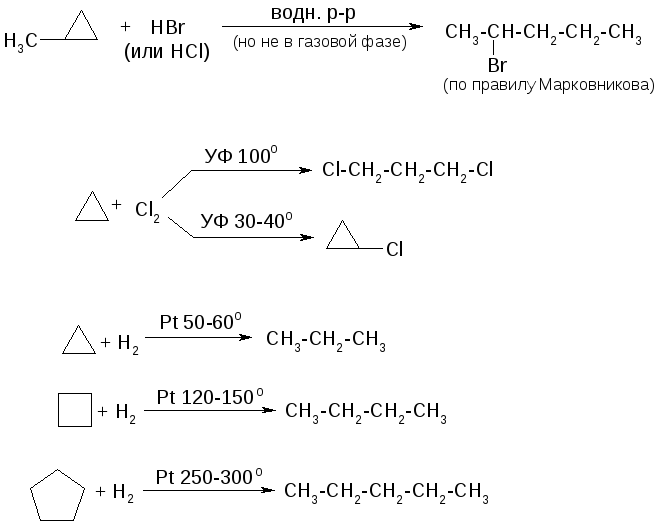
2. Реакции средних циклов практически такие же, как и для ациклических алканов.
Окисление:
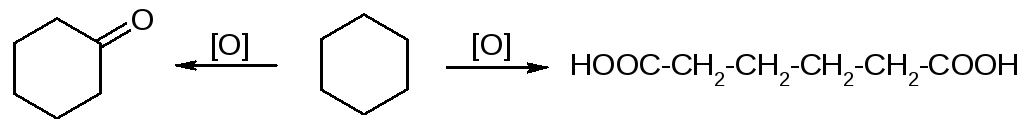
Отдельные представители циклоалканов – см. учебник.
ЛИТЕРАТУРА:
1. Белобородов В.Л., Зурабян С.Э., Лузин А.П., Тюкавкина Н.А. – Органическая химия (основной курс) – Дрофа, М., 2003 г., с. 157 – 182.
19.09.08
