
Химия
.pdf№1 Предмет органической химии. Особенности органических веществ. Основные положения теории строения
органических веществ А. М. Бутлерова.
Предмет органической химии включает следующие цели, экспериментальные методы и теоретические представления:
-Выделение индивидуальных веществ из растительного, животного или ископаемого сырья -Синтез и очистка соединений, -Определение структуры веществ, -Изучение механизмов химических реакций,
-Выявление зависимостей между структурой органических веществ и их свойствами.
Особенности органических веществ. В отличие от неорганических веществ органические вещества имеют ряд характерных особенностей:
1)атомы углерода способны соединяться друг с другом;
2)образуют цепи и кольца, что не так типично для неорганических соединений. Это одна из причин многообразия органических соединений;
3)одной из важных особенностей органических соединений, которая накладывает отпечаток на все их химические свойства, является характер связей между атомами в их молекулах.
Эти связи имеют ярко выраженный ковалентный характер. Органические вещества в большинстве неэлектролиты, не диссоциируют в растворах на ионы и сравнительно медленно взаимодействуют друг с другом.
Время, необходимое для завершения реакций между органическими веществами, измеряется часами, а иногда и днями.
Если ионные(неорганические) соединения легко диссоциируют в воде на ионы и реакции между ними протекают весьма быстро, то органические вещества, содержащие простые(одинарные) С – С и С – Н связи, взаимодействуют между собой с большим трудом.
При нагревании в пределах 400–600 °C органические соединения полностью разлагаются и обугливаются, а в присутствии кислорода сгорают. Это объясняется сравнительно небольшой прочностью связи между атомами углерода (355,6 кДж/моль);
4)важной особенностью органических соединений является и то, что среди них широко распространено явление изомерии;
5)имеется множество соединений углерода, которые обладают одинаковым качественным и количественным составом и одинаковой молекулярной массой, но совершенно различными физическими и даже химическими свойствами;
6)многие органические соединения являются непосредственными носителями, участниками или продуктами процессов, которые протекают в живых организмах, – ферменты, гормоны, витамины. Особенности атома углерода объясняются его строением:
1)он имеет четыре валентных электрона;
2)атомы углерода образуют с другими атомами, а также друг с другом общие электронные пары. При этом на внешнем уровне каждого атома углерода будет восемь электронов (октет), четыре из которых одновременно принадлежат другим атомам.
В органической химии обычно пользуются структурными формулами, поскольку атомы имеют пространственное расположение в молекуле.
Структурные формулы– это язык органической химии.
В структурных формулах ковалентная связь обозначается черточкой. Как и в структурных формулах неорганических веществ, каждая черточка означает общую электронную пару, связывающую атомы в молекуле. Используются также эмпирическиеи электронныеформулы.
Теория химического строения органических соединений А.М. Бутлерова Крупнейшим событием в развитии органической химии было создание в 1961 г. великим русским ученым А.М. Бутлеровымтеории химического строения органических соединений.
До А.М. Бутлерова считалось невозможным познать строение молекулы, т. е. порядок химической связи между атомами. Многие ученые даже отрицали реальность атомов и молекул.
А.М. Бутлеров опроверг это мнение. Он исходил из правильных материалистическихи философских представлений о реальности существования атомов и молекул, о возможности познания химической связи атомов в молекуле. Он показал, что строение молекулы можно установить опытным путем, изучая химические превращения вещества. И наоборот, зная строение молекулы, можно вывести химические свойства соединения.
Теория химического строения объясняет многообразие органических соединений. Оно обусловлено способностью четырехвалентного углерода образовывать углеродные цепи и кольца, соединяться с атомами других элементов и наличием изомерии химического строения органических соединений. Эта теория заложила научные основы органической химии и объяснила ее важнейшие закономерности. Основные принципы своей теории А.М. Бутлеров изложил в докладе «О теории химического строения».
Основные положения теории строения сводятся к следующему:
1)в молекулах атомы соединены друг с другом в определенной последовательности в соответствии с их валентностью. Порядок связи атомов называется химическим строением;
2)свойства вещества зависят не только от того, какие атомы и в каком количестве входят в состав его молекулы, но и от того, в каком порядке они соединены между собой, т. е. от химического строения молекулы;
3)атомы или группы атомов, образовавшие молекулу, взаимно влияют друг на друга.
В теории химического строения большое внимание уделяется взаимному влиянию атомов и групп атомов в молекуле.
Химические формулы, в которых изображен порядок соединения атомов в молекулах, называются структурными формуламиили формулами строения.
Значение теории химического строения А.М. Бутлерова:
1)является важнейшей частью теоретического фундамента органической химии;
2)по значимости ее можно сопоставить с Периодической системой элементов Д.И. Менделеева;
3)она дала возможность систематизировать огромный практический материал;
4)дала возможность заранее предсказать существование новых веществ, а также указать пути их получения. Теория химического строения служит руководящей основой во всех исследованиях по органической химии.
№2 Явление изомерии. Изомеры. Виды изомерии. Примеры различных видов изомерии. Написать все возможные
структурные изомеры для соединений.
Изомерия (от др.-греч. ἴσος — «равный», и μέρος — «доля, часть») — явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
Изомеры –это вещества, которые имеют одинаковый состав и одинаковую молярную массу, но различное строение молекул, а потому обладающие разными свойствами.
Виды изомерии:
1.Структурная изомерия.
2.Пространственная изомерия.
Структурная изомерия — результат различий в химическом строении.
Пример: Изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода. Простейший пример — бутан СН3—СН2—СН2—СН3 и изобутан (СН3)3СН. Другие примеры: антрацен и фенантрен (формулы I и II, соответственно), циклобутани метилциклопропан (III и IV). Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение.
Пример: σ-диастереомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности. Так, диастереомерами являются (+)-винная кислота и мезо-винная кислота, D-глюкоза и D- манноза.


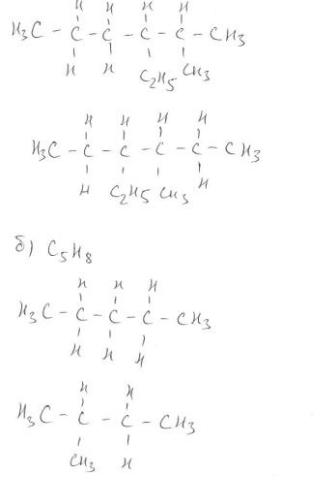
№3 Классификация органических соединений. Что такое функциональная группа? Приведите не менее 5
основных классов органических соединений. Принадлежность к каким классам органических соединений определяют следующие функциональные группы?
Все органические соединения в зависимости от природы углеродного скелета можно разделить на ациклические и циклические.
Ациклические(нециклические, ценные) соединения называют также жирными или алифатическими.
Эти названия связаны с тем, что одними из первых хорошо изученных соединений такого типа были природные жиры.
Среди циклических соединений обычно выделяют:1) карбоциклические – молекулы которых содержат кольца из углеродных атомов; 2) гетероциклические –кольца которых содержат, кроме углерода, атомы других элементов (кислорода, серы, азота и др.).
Карбоциклические соединения подразделяются:1) на алициклические(предельные и непредельные), похожие по свойствам на алифатические; 2) ароматические –содержат бензольные кольца.
Функциональные группы –это группы атомов, которые определяют химические свойства данного класса соединений.

Наличие этих групп позволяет разделить типы органических соединений на классы и облегчить их изучение.
Классы соединений: а) спирты; б) фенолы; в) альдегиды; г) кетоны; д) карбоновые кислоты; е) нитросоединения; ж) первичные амины; з) амиды кислот.
№4 Гибридизация атомных орбиталей в атомах углерода в органических соединениях. Пространственная
конфигурация атомных орбиталей.
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
1. sp-гибридизация
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
2. sp2-гибридизация
Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π- связей

3. sp3-гибридизация
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
sp-гибридизация
sp2-гибридизация
sp3-гибридизация
Если на внешней оболочке атома имеются два электрона, один в s- состоянии а другой в р- состоянии, то при затрате некоторой энергии вместо исходных s- и р- орбиталей могут образоваться две гибридные spорбитали (рис. 9). Они вытянуты вдоль прямой в противоположных направлениях.
Благодаря |
вытянутой |
форме гибридных орбиталей, |
||
достигается |
более |
полное |
перекрывание |
|
взаимодействующих |
электронных |
облаков, |
а |
|
значит, |
образуются |
более прочные химические |
||
связи. Энергия, выделяющаяся при образовании этих связей больше, чем суммарные затраты энергии на возбуждение атома и гибридизацию его атомных орбиталей. Т.к. spорбитали ориентированы в противоположных направлениях, то структура молекулы линейная и валентный угол равен 180°. Связующее электронное облако расположено симметрично между атомами и молекула является неполярной, в тоже

время связь в молекуле всегда обладает направленностью и является полярной. Такую пространственную конфигурацию будут иметь молекулы элементов II группы: MgBr2, СаН2, ВаF2.
Рассмотрим пространственную структуру молекул элементов III группы. Химическая связь образуется за счет s–электрона и двух p–электронов внешнего энергетического уровня. Возникающее явление sp2– гибридизации, приводит к образованию трех равноценных гибридных орбиталей, ориентированных в пространстве под углом 120° (рис. 10). Все три связи равноценны и имеют направление к более электроотрицательному элементу.
Образуемые |
|
элементами III группы |
молекулы |
|||
имеют |
структуру |
плоского |
треугольника. Дипольный |
момент |
||
таких |
молекул равен 0 и |
молекула |
неполярна. Валентный |
|||
угол составляет |
120°. |
Аналогичные |
структуры |
у |
||
молекул GaCl3, InBr3, TeI3. |
|
|
|
|
||
При |
образовании |
молекул элементами IV группы главной |
подгруппы |
валентные |
электроны |
|
подвергаются sp3–гибридизации (рис. 11). Гибридная орбиталь способна к более сильному перекрыванию с орбиталями других атомов и образованию более прочных связей. Гибридные орбитали расположены в пространстве под углом 109°28’ и направлены к вершинам тетраэдра. Аналогичное строение имеют
молекулы SiCl4, GeF4 СН4 и т. п. |
|
|
Молекулы элементов V группы главной |
подгруппы NH3, PH3, AsH3 используют для связей |
три |
неспаренных р–электрона, находящихся на |
взаимно перпендикулярных орбиталях. Но результаты |
|
экспериментальных измерений показывают, |
что угол между связями в молекуле NH3 отличен от |
90° и |
составляет 108° (рис. 12). Полагают, что имеет место sp3–гибридизация и из четырех гибридных орбиталей одна занята неподеленной электронной парой. Она влияет на связующие электронные пары, отталкивая их и угол отличается от тетраэдрического (109°). Молекулы имеют структуру тригональной пирамиды. Молекула является полярной.
Молекулы элементов VI группы имеют угловую пространственную структуру, что обусловлено наличием двух неспаренных р–электронов, участвующих в образовании химических связей. Валентный угол у таких молекул составляет примерно 90°. Отклонения валентного угла от 90° объясняют эффектом взаимного
отталкивания неподеленных пар электронов. Образуются полярные молекулы, так как результирующая векторов связей отлична от нуля (рис. 13).
№5 Природа ковалентной связи, определение, параметры ковалентной связи.
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость
— определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные — двухатомная молекула состоит из одинаковых атомов (H2, Cl2, N2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные — двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
Простой ковалентной связью соединены атомы в молекулах простых газов (Н2, Cl2 и др.) и соединений (Н2О, NH3, CH4, СО2, HCl и др.). Соединения с донорно-акцепторной связью — аммония NH4+, тетрафторборат анион BF4− и др. Соединения с семиполярной связью — закись азота N2O, O−-PCl3+.
Кристаллы с ковалентной связью диэлектрики или полупроводники. Типичными примерами атомных кристаллов (атомы в которых соединены между собой ковалентными (атомными) связями могут служить алмаз, германий и кремний.
Единственным известным человеку веществом с примером ковалентной связи между металлом и углеродом является цианокобаламин, известный как витамин B12.

№6 Электронные эффекты заместителей в органически молекулах. Индуктивный и мезомерный эффекты –
основные характеристики. Расставить электронные эффекты в молекулах.
Электронные эффекты - смещение электронной плотности в молекуле, ионе или радикале под влиянием заместителей.
Заместителем считается любой атом (кроме водорода) или группа атомов, связанные с атомом углерода. Различают индуктивный (I) и мезомерный (M) эффекты заместителей.
Индуктивный эффект — смещение электронной плотности по цепи σ-связей, которое обусловлено различиями в электроотрицательностях атомов.
Мезомерный эффект - смещение электронной плотности по цепи делокализованных (сопряженных) π- связей.
№7 Номенклатура органических соединений. Номенклатура ИЮПАК. Назвать соединения по номенклатуре ИЮПАК.
В настоящее время для наименования органических соединений применяются три типа номенклатуры: тривиальная, рациональная и систематическая номенклатура — номенклатура IUPAC (ИЮПАК) — International Union of Pure and Applied Chemistry (Международного союза теоретической и прикладной химии).
Тривиальная (историческая) номенклатура — первая номенклатура, возникшая в начале развития органической химии, когда не существовало классификации и теории строения органических соединений. Органическим соединениям давали случайные названия по источнику получения (щавелевая кислота, яблочная кислота, ванилин), цвету или запаху (ароматические соединения), реже — по химическим свойствам (парафины). Многие такие названия часто применяются до сих пор. Например: мочевина, толуол, ксилол, индиго, уксусная кислота, масляная кислота, валериановая кислота, гликоль, аланин и многие другие.
Рациональная номенклатура — по этой номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда. Все остальные соединения рассматриваются как производные этого соединения, образованные замещением в нем атомов водорода углеводородными или иными радикалами (например: триметилуксусный альдегид, метиламин, хлоруксусная кислота, метиловый спирт). В настоящее время такая номенклатура применяется только в тех случаях, когда она дает особенно наглядное представление о соединении.
Систематическая номенклатура — номенклатура IUPAC — международная единая химическая номенклатура. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений и пытается решить главную проблему номенклатуры: название
