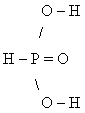- •Элементы viia подгруппы
- •Работа №1 Галогены
- •Опыт 1. Получение хлора из соляной кислоты действием различных окислителей
- •Опыт 2. Получение брома
- •Опыт 3. Растворимость брома и йода в органических растворителях
- •Опыт 4. Окислительные свойства галогенов
- •Опыт 5. Сравнительная характеристика окислительных cвойств свободных галогенов
- •Опыт 6. Сравнительная характеристика восстановительных свойств галогенид-ионов
- •Опыт 7. Гипохлориты и их окислительные свойства
- •Опыт 8. Хлораты и йодаты
- •Контрольные вопросы и задания
- •2. Элементы via подгруппы
- •Работа №2 Сера
- •Опыт 2. Получение малорастворимых сульфидов металлов.
- •Опыт 3. Окислительно – восстановительные свойства сернистой кислоты и сульфит - ионов ()
- •Опыт 4. Окислительные свойства персульфатов.
- •Опыт 5. Гидролиз солей.
- •Опыт 6. Качественное определение ионов серы.
- •Контрольные вопросы и задания
- •3.Халькогениды металлов
- •Значения пр некоторых сульфидов металлов
- •Растворители сульфидов
- •Работа № 3 Получение сульфидов металлов и исследование их свойств
- •Опыт 1. Получение осадков сульфидов металлов и исследование их растворимости
- •Опыт 2. Изучение растворимости осадков сульфидов металлов
- •Опыт 3 (контрольная задача). Качественное определение ионов металлов
- •Опыт 4. Получение пленки CdS методом осаждения из растворов
- •Контрольные вопросы и задания
- •4. Элементы vа подгруппы
- •Мышьяк. Сурьма. Висмут.
- •Работа № 4 а. Азот. Фосфор
- •Опыт 1. Восстановительные свойства аммиака.
- •Опыт 2. Свойства азотистой кислоты и нитритов.
- •Опыт 3. Качественное определение ионов азота
- •Опыт 4. Качественная реакция на фосфат-ион (po43-)
- •Опыт 7. Получение гидроксида висмута (III) и исследование его свойств
- •Опыт 8. Окислительно-восстановительные свойства соединений висмута (III)
- •Опыт 9. Окислительные свойства соединений висмута (V)
- •Контрольные вопросы и задания
- •5. Элементы iva подгруппы
- •Гидролиз солей олова и свинца протекает с образованием основных солей. Например:
- •Работа № 5 а. Кремний. Германий
- •Опыт 1 (демонстрационный). Получение аморфного кремния восстановлением диоксида кремния металлическим магнием Получение аморфного кремния основано на реакции
- •Опыт 2. Получение геля кремниевой кислоты
- •Опыт 3. Гидролиз силиката натрия
- •Опыт 7. Определение химической природы диоксида германия
- •Б. Олово. Свинец Опыт 8. Взаимодействие олова с концентрированными кислотами
- •Опыт 9. Получение гидроксида олова (II) и исследование его свойств
- •Опыт 10. Гидролиз солей олова (II)
- •Опыт 11. Восстановительные свойства соединений олова (II). Восстановление железа (III)
- •Опыт 12. Вытеснение свинца из раствора его соли более активными металлами
- •Опыт 13. Отношение свинца к разбавленным кислотам
- •Опыт 14. Малорастворимые соли свинца (п)
- •Опыт 15. Получение гидроксида свинца (п) и изучение его свойств
- •Опыт 16. Амфотерные свойства диоксида свинца
- •Опыт 17. Окислительные свойства соединений свинца (IV)
- •Контрольные вопросы и задания
- •6. Комплексные соединения
- •Работа №6. А Свойства комплексных соединений
- •Опыт 1. Получение и свойства аммиаката никеля.
- •Опыт 2. Получение и свойства ацидокомплекса ртути и изучение его свойств.
- •Опыт 3. Получение соединения,
- •Опыт 6. Разрушение комплексов.
- •Б Синтез двойных и комплексных солей
- •Синтез двойных солей.
- •Частные реакции на ионы
- •Синтез комплексных солей
- •Контрольные вопросы и задания
- •7. Металлы
- •Ib. Медь, серебро, золото
- •Iib. Цинк, кадмий, ртуть
- •Iiia. Элементы iiia подгруппы
- •Алюминий, галлий, индий, таллий
- •Viiib. Железо, кобальт, никель
- •Работа № 7. Химические свойства металлов
- •Опыт 1. Растворение металлов в кислотах и щелочах
- •Опыт 2. Получение гидроксидов металлов и исследование их свойств
- •Опыт 3. Получение сульфидов металлов
- •Опыт 4. Гидролиз солей некоторых металлов
- •Опыт 5. Комплексные соединения d-элементов
- •Опыт 6. Окислительно-восстановительные свойства ионов металлов
- •Индивидуальные задания.
- •Контрольные вопросы и задания
- •8. Элементы iа подгруппы
- •Работа № 8. Натрий
- •Опыт 1. Взаимодействие натрия с водой.
- •Опыт 2. Свойства пероксида натрия.
- •Опыт 3. Гидролиз карбоната и гидрокарбоната натрия.
- •Контрольные вопросы и задания
- •9. Элементы iiа подгруппы
- •Работа №9. Свойства металлов iia подгруппы и их соединений
- •Опыт 1. Получение гидроксида бериллия и исследование его свойств.
- •Опыт 2. Гидролиз хлорида бериллия.
- •Контрольные вопросы и задания
- •10. Элементы vib подгруппы
- •Изменение характера оксидов и гидроксидов хрома
- •Работа № 8. Хром
- •Опыт 1. Получение оксида хрома (ш) разложением бихромата аммония
- •Опыт 2. Получение гидроксида хрома (III) и исследование его свойств
- •Опыт 3. Гидролиз солей хрома
- •Опыт 4. Окисление хрома (III) до хрома (VI)
- •Опыт 5. Хроматы и бихроматы
- •Опыт 6. Получение малорастворимых хроматов бария, свинца, серебра
- •Опыт 7. Окислительные свойства хрома (VI) в кислой среде
- •Опыт 8. Образование надхромовой кислоты h2CrO6
- •Опыт 9. Травление хромовых покрытий
- •Опыт 10. Пассивирование (оксидирование) хрома
- •Контрольные вопросы и задания
- •11. Элементы viib подгруппы
- •Работа № 11. Марганец
- •Опыт 1. Получение гидроксида марганца (II)
- •Опыт 4. Окислительно-восстановительные свойства манганатов (реакция диспропорционирования)
- •Опыт 5. Окислительные свойства перманганатов
- •Опыт 6. Влияние среды на окислительные свойства перманганата
- •Контрольные вопросы и задания
- •12. Элементы viiiв подгруппы
- •Работа 12. Железо. Кобальт. Никель
- •Опыт 1. Получение гидроксида железа (II) и исследование его свойств.
- •Опыт 2. Получение гидроксидов кобальта (II) и никеля (II) и исследование их свойств.
- •Опыт 3. Получение гидроксида железа (III) и исследование его свойств.
- •Опыт 4. Гидролиз солей железа (II) и (III).
- •Опыт 5. Получение малорастворимых сульфидов железа, кобальта, никеля.
- •Опыт 6. Восстановительные свойства соединений железа (II).
- •Опыт 7. Окислительные свойства соединений железа (III).
- •Опыт 8. Комплексные соединения железа, кобальта, никеля.
- •Контрольные вопросы и задания
- •Приложение. Таблицы физико-химических констант.
- •Константы нестойкости некоторых комплексных ионов
- •Растворимость некоторых солей и оснований в воде
- •Оглавление
Опыт 4. Получение пленки CdS методом осаждения из растворов
Выполнение опыта. Подложку стекла (меди или кремния), тщательно обезжиренную и промытую в дистиллированной воде, закрепить на подвеске. В стакан налить 400 мл дистиллированной воды, добавить 5 мл 10 М раствора CdCl2, 25 мл 1 М раствора тиомочевины. После перемешивания раствора магнитной мешалкой опустить подложку в стакан на 1 мин (при этом происходит активация подложки, что способствует более быстрому росту пленки СdS). При дальнейшем перемешивании раствора прибавить в стакан 5 мл 2 М раствора NH40H. Наблюдать осаждение пленки CdS. Время осаждения 10 мин.
Привести уравнения реакций образования пленки CdS.
Контрольные вопросы и задания
1. Из значений произведения растворимости солей вычислите концентрацию ионов в насыщенных растворах ZnS, PbS, HgS (моль/л и г/л). (ПРZnS = 2·5 10-22, ПРPbS = 2·5 10-27, ПРHgS = 1·6 10-52).
2. К 1 л 0,01 М раствора CdCl2, прибавили 1 л 0,001 М раствора Na2S. Выпадет ли осадок? (ПРCdS = 7,9·10-27).
3. К раствору, содержащему в 1 л по 10 М следующих солей: FeCl2, МnСl2, Pb(NO3)2, и CuSO4, прибавили 10-18 М Na2S. Сульфиды каких металлов и в какой последовательности выпадут в осадок? (ПРFeS=5·10-18, ПРMnS =2,5·10-10, ПРPbS = 2,5·10-27, ПРCuS = 6,3·10-36).
4. Вычислите произведение растворимости сульфида кадмия (II), если его растворимость при комнатной температуре равна 1,3.10-4 в 100 г воды.
5. Вычислите произведение растворимости сульфида сурьмы (III), растворимость осадка которого при комнатной температуре равна 1,8·10-4 г в 100 г раствора.
6. Вычислите растворимость сульфида ртути (моль/л и г/л) при комнатной температуре (ПРHgS = 1,6·10-52).
7. Составьте уравнения реакций растворения:
а) сульфида марганца в соляной кислоте,
б) сульфида цинка в серной кислоте,
в) сульфида кобальта в соляной кислоте в присутствии пероксида водорода,
г) сульфида свинца в азотной кислоте,
д) сульфида меди (II) в азотной кислоте,
е) сульфида ртути (II) в царской водке,
ж) сульфида висмута (III) в азотной кислоте,
з) сульфида мышьяка (III) в азотной кислоте,
и) сульфида сурьмы (III) в избытке сульфида натрия.
8. Составьте уравнения реакций:
а) HgS + KI + KCl → б) Sb2S3+ Na2S →
в) Sb2S3 + NaOH → г) As2S3 + Na2S →
д) CdS+ НCl →
избыт.
9. Назовите области применения полупроводников группы АIIВVI и пленок на их основе.
10. Перечислите химические методы осаждения пленок халькогенидов.
11. Напишите уравнение реакции взаимодействия хлорида кадмия с тиомочевиной.
4. Элементы vа подгруппы
Азот и фосфор являются элементами VА подгруппы периодической системы Д.И.Менделеева. Они относятся к р‑электронному семейству. На внешнем энергетическом уровне их атомов находится пять электронов ns2np3. В нормальном состоянии они проявляют валентность, равную трем.
Окислительные числа азота и фосфора в различных соединениях изменяются от ‑3 до +5.
Азот и фосфор с водородом и кислородом образуют соединения со слабо-полярными ковалентными связями, поэтому в водных растворах они не образуют ни элементарных катионов (подобных Al3+), ни элементарных анионов (подобных S2-).
Азот образует молекулы N2 с тройными связями и является химически инертным. При обычной температуре он реагирует только с литием, образуя нитрид Li3N, с остальными веществами он реагирует только при повышенных температурах.
Фосфор в свободном состоянии существует в виде нескольких аллотропних модификаций (белый, красный, черный). Он легко соединяется с кислородом (белый воспламеняется), галогенами, серой, металлами.
С водородом фосфор непосредственно не соединяется. Соответствующее водородное соединение фосфин получается косвенным путем из фосфидов:
Mg3P2 + 6HCl = 3MgCl2 + 2PH3
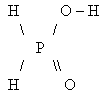
Фосфор окисляется концентрированной азотной кислотой до ортофосфорной кислоты:
![]()
При действии щелочи он диспропорционирует с образованием фосфина и гипофосфита:
4P + 3NaOH + 3H2O = PH3 + 3NaH2PO2
С водородом азот и фосфор образуют летучие соединения ЭH3.
Аммиак (NH3) и фосфин (PH3) существенно различаются по свойствам. Молекулы NH3 полярны, а PH3 – неполярны. В соответствии с этим, аммиак взаимодействует в водой с образованием слабого основания, диссоциирующего на ионы аммония и гидроксид-ионы:
|
NH3+H2O | ||
|
|
|
|
Фосфин – ядовитый газ, слабо растворим в воде, не взаимодействует с нею, а аналогичный ион фосфония PH4+ образуется лишь при взаимодействии PH3 с очень сильными кислотами HClO4 и HI:
PH3+ HI = PH4I.
Азот, в отличие от фосфора, образует такие соединения, как N2H4 (гидразин), NH2OH (гидроксиламин) и HN3 (азотоводородная кислота), соли которой называются азидами.
Аммиак и фосфин – прекрасные восстановители. Например:
2NH3 + 2KMnO4 = N2 + 2MnO2 + 2KOH + 2H2O
5PH3 + 8KMnO4 + 12H2SO4 = 5H3PO4 + 8MnSO4 + 4K2SO4 + 12H2O
NH2OH, N2H4, H[N3] обладают окислительно-восстановительной двойственностью с преобладанием восстановительных свойств. При этом все они восстанавливаются до аммиака и окисляются до азота:
С кислородом азот образует пять оксидов, два из которых (N2O и NO) относятся к несолеобразующим, а три (NО2, N2O3 и N2O5) - к кислотным:

Азотистая кислота и ее соли (нитриты) обладают окислительно-восстановительной двойственностью:
![]()
![]()
![]()
Азотная кислота относится к сильным кислотам и обладает высокой окислительной способностью. Она окисляет все металлы, за исключением золота и платиновых металлов. При этом в зависимости от концентрации раствора HNO3 и активности металла она восстанавливается с образованием различных оксидов и даже аммиака:
|
а) |
HNO3 конц. |
Al, Fe, Cr |
пассивирует |
|
Me до Al* |
N2, N2O | ||
|
Ме от Al до H |
NO | ||
|
Ме после Н |
NO2 | ||
|
Au, Pt, Rh, Pd |
не взаимодействует | ||
|
|
|
|
|
|
б) |
HNO3 разб. |
Ме до Al* |
N2 |
|
Ме от Al до H |
N2O | ||
|
Ме после Н |
NO | ||
|
|
|
| |
|
в) |
HNO3 очень разб. |
Ме до Al, Sn |
NH3 (NH4NO3) |
|
от Al до H |
N2O, N2 | ||
|
Ме после Н |
NO |
Например:
![]()
![]()
![]()
Соли азотной кислоты – нитраты – проявляют окислительные свойства в щелочной среде, восстанавливаясь до нитритов (в растворах), до NO2 или до NH3 (в расплавах):
Например:
KNO3 + 4Zn + 7KOH = NH3 + 4K2ZnO2 + 2H2O
3KNO3 + Cr2O3 + 4KOH = 3KNO2 + 2K2CrO4 + 2H2O
Почти все нитраты хорошо растворимы в воде. При нагревании разлагаются, причем продукты разложения зависят от природы катионобразующего металла (положения в ряду напряжений металлов):
|
Me(NO3)x |
до Mg |
Me(NO2)x + O2 |
|
| ||
|
Mg – Cu |
MeyOx + NO2 + O2 | |
|
| ||
|
после Cu |
Me + NO2 + O2 | |
|
|
Например:
2KNO3 = 2KNO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
Фосфор образует с кислородом оксиды P2O3 и P2O5. Оксиду P2O3 соответствует двухосновная фосфористая кислота H2HPO3 (H3PO3), в ней можно заместить на металл лишь два атома водорода.
Оксид P2O5 образует большое количество кислот, из которых наиболее важны метафосфорная (HPO3), ортофосфорная (H3PO4) и пирофосфорная (H4P2O7). Ортофосфорная кислота образует средние соли – фосфаты и кислые – гидро -, дигидро-фосфаты, например Na3PO4, Na2HPO4, и NaH2PO4.
Растворимы в воде фосфаты только щелочных металлов. Их водные растворы имеют щелочную реакцию среды за счет гидролиза:
PO43- + H2O ![]() HPO42- + OH-
HPO42- + OH-
Na3PO4 + H2O ![]() Na2HPO4 + NaOH
Na2HPO4 + NaOH
Фосфорная кислота является кислотой средней силы и не обладает ярко выраженными окислительными свойствами. Она используется в составе травителей как регулятор скорости, обеспечивая оптимальную вязкость травителей.
Фосфорноватистая кислота (H3PO2) – одноосновная, ее кислотные свойства выражены несколько сильнее, чем у двухосновной фосфористой. H3PO3 и ее соли гипофосфиты обладают также несколько более сильными восстановительными свойствами (особенно в кислой среде), чем фосфористая кислота и фосфиты:
|
H3PO2 + 2H2O – 4e = H3PO4 + 4H+ |
(E = ‑ 0,39 B) |
|
H3PO3 + H2О ‑ 2e = H3PO4 + 2H+ |
(E = ‑ 0,276 B) |
Распределение связей в молекулах фосфорноватистой и фосфористой кислот можно представить следующим образом:
|
H3PO2 |
H3PO3 |
|
|
|